Открытие периодического закона менделеева кратко
Обновлено: 02.07.2024
Периодический закон сформулирован Д. И. Менделеевым в \(1869\) году. К этому времени было известно \(63\) химических элемента. В качестве основного свойства элементов Менделеев выбрал относительную атомную массу . Учитывал также состав, физические и химические свойства образованных элементом простых и сложных веществ.
Расположив все известные химические элементы в порядке возрастания атомных масс, Менделеев обнаружил, что свойства повторяются через определённое число элементов.
Повторим действия Менделеева с учётом того факта, что благородные газы в его время ещё не были известны. Расположим элементы по возрастанию атомной массы (вторая строчка таблицы), укажем металлические и неметаллические свойства, формулы и свойства высших оксидов и гидроксидов, а также формулы газообразных водородных соединений.
Если внимательно проанализировать полученные последовательности, то можно увидеть повторяемость металлических и неметаллических свойств, состава и свойств соединений. Через семь элементов от щелочного металла лития в ряду располагается щелочной металл натрий, а через семь элементов от галогена фтора — галоген хлор. Через семь элементов появляются одинаковые формулы оксидов и водородных соединений, так как повторяются значения валентностей в соединениях с кислородом и водородом. Можем составить их общие формулы.
Период — ряд элементов, расположенных в порядке возрастания относительной атомной массы, начинающийся щелочным металлом и заканчивающийся галогеном и инертным газом.
- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от I (у щелочных металлов) до VII (у галогенов);
- валентность элементов неметаллов в летучих водородных соединениях уменьшается от IV до I (у галогенов);
- свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
Периодический закон получил дальнейшее развитие после изучения физиками строения атома. Оказалось, что главной характеристикой химического элемента является не относительная атомная масса, а заряд ядра атома. Современная формулировка периодического закона несколько изменена:
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864), однако главное отличие было в том, что за основу периодичности была взята валентность, которая не является единственной и постоянной для отдельно взятого элемента. В результате чего такая таблица не может претендовать на полноценное описание физики периодического закона.
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил:
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и с поразительной точностью описал целый ряд физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. В 2010 году, с синтезом 117 элемента, седьмой период периодической системы был завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.

Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеев исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы.
В 1871 г. на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Периодическая система элементов оказала большое влияние на последующее развитие химии. Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований. В то время, когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Менделеев был не только убеждён, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. В течение следующих 15 лет предсказания Менделеева блестяще подтвердились; все три ожидаемых элемента были открыты (Ga, Sc, Ge), что было величайшим триумфом периодического закона.
РУССКОЕ ХИМИЧЕСКОЕ ОБЩЕСТВО
Русское химическое общество – научная организация, основанная при Санкт-Петербургском университете в 1868 г. и представлявшая собой добровольное объединение российских химиков.
О необходимости создания Общества было заявлено на 1-м Съезде русских естествоиспытателей и врачей, состоявшемся в Санкт-Петербурге в конце декабря 1867 – начале января 1868 г. На Съезде было оглашено решение участников Химической секции:
К этому времени уже были учреждены химические общества в нескольких европейских странах: Лондонское химическое общество (1841), Химическое общество Франции (1857), Немецкое химическое общество (1867); Американское химическое общество было основано в 1876 г.
Устав Русского химического общества, составленный в основном Д. И. Менделеевым, был утверждён Министерством народного просвещения 26 октября 1868 г., а первое заседание Общества состоялось 6 ноября 1868 г. Первоначально в его состав вошли 35 химиков из Петербурга, Казани, Москвы, Варшавы, Киева, Харькова и Одессы. Первым Президентом РХО стал Н. Н. Зинин, секретарём – Н. А. Меншуткин. Члены общества платили членские взносы (10 руб. в год), приём новых членов осуществлялся только по рекомендации трёх действующих. В первый год своего существования РХО выросло с 35 до 60 членов и продолжало плавно расти в последующие годы (129 – в 1879 г., 237 – в 1889 г., 293 – в 1899 г., 364 – в 1909 г., 565 – в 1917 г.).
На страницах ЖРХО впервые были напечатаны многие труды классиков русской химии. Можно особо отметить работы Д. И. Менделеева по созданию и развитию периодической системы элементов и А. М. Бутлерова, связанные с разработкой его теории строения органических соединений; исследования Н. А. Меншуткина, Д. П. Коновалова, Н. С. Курнакова, Л. А. Чугаева в области неорганической и физической химии; В. В. Марковникова, Е. Е. Вагнера, А. М. Зайцева, С. Н. Реформатского, А. Е. Фаворского, Н. Д. Зелинского, С. В. Лебедева и А. Е. Арбузова в области органической химии. За период с 1869 по 1930 г. в ЖРХО было опубликовано 5067 оригинальных химических исследований, печатались также рефераты и обзорные статьи по отдельным вопросам химии, переводы наиболее интересных работ из иностранных журналов.
РФХО стало учредителем Менделеевских съездов по общей и прикладной химии; три первых съезда прошли в С.-Петербурге в 1907, 1911 и 1922 гг. В 1919 г. издание ЖРФХО было приостановлено и возобновлено лишь в 1924 г.

Периодический закон Дмитрия Ивановича Менделеева — один из фундаментальных законов природы, который увязывает зависимость свойств химических элементов и простых веществ с их атомными массами. В настоящее время закон уточнен, и зависимость свойств объясняется зарядом ядра атома.
 |  |  |
| Алюминий гранулированный | Йод кристаллический | Сера молотая |
Научное сообщество далеко не сразу приняло идеи великого русского химика, даже в России. Но после того, как были открыты три новых элемента (галлий в 1875-м, скандий в 1879-м и германий в 1886-м годах), предсказанные и описанные Менделеевым в своем знаменитом докладе, периодический закон был признан.
Периодический закон Менделеева:
- Является всеобщим законом природы.
- В таблицу, графически представляющую закон, включаются не только все известные элементы, но и те, которые открывают до сих пор.
- Все новые открытия не повлияли на актуальность закона и таблицы. Таблица совершенствуется и изменяется, но ее суть осталась неизменной.
- Позволил уточнить атомные веса и другие характеристики некоторых элементов, предсказать существование новых элементов.
- Химики получили надежную подсказку, как и где искать новые элементы. Кроме этого, закон позволяет с высокой долей вероятности заранее определять свойства еще неоткрытых элементов.
- Сыграл огромную роль в развитии неорганической химии в 19-м веке.
История открытия
Есть красивая легенда о том, что свою таблицу Менделеев увидел во сне, а утром проснулся и записал ее. На самом деле, это просто миф. Сам ученый много раз говорил, что созданию и совершенствованию периодической таблицы элементов он посвятил 20 лет своей жизни.
Все началось с того, что Дмитрий Иванович решил написать для студентов учебник по неорганической химии, в котором собирался систематизировать все известные на этот момент знания. И естественно, он опирался на достижения и открытия своих предшественников. Впервые внимание на взаимосвязь атомных весов и свойств элементов обратил немецкий химик Дёберейнер, который попытался разбить известные ему элементы на триады с похожими свойствами и весами, подчиняющимися определенному правилу. В каждой тройке средний элемент имел вес, близкий к среднему арифметическому двух крайних элементов. Ученый смог таким образом образовать пять групп, например, Li–Na–K; Cl–Br–I. Но это были далеко не все известные элементы. К тому же, тройка элементов явно не исчерпывала список элементов с похожими свойствами. Попытки найти общую закономерность позже предпринимали немцы Гмелин и фон Петтенкофер, французы Ж. Дюма и де Шанкуртуа, англичане Ньюлендс и Одлинг. Дальше всех продвинулся немецкий ученый Мейер, который в 1864-м году составил таблицу, очень похожую на таблицу Менделеева, но она содержала лишь 28 элементов, в то время как было известно уже 63.

Дмитрий Иванович Менделеев – один из самых величайших российских ученых 19-го - начала 20-го века. Он известен как автор периодического закона, который оказал значительное воздействие на процветание множества наук и образования. Менделеев является автором работ не только по химии, но и физике, метрологии, метеорологии, экономике, воздухоплаванию, сельскому хозяйству и др. Так в каком году Менделеев открыл периодический закон?

Предпосылки открытия закона
В фундаменте собственных работ по систематизации химических элементов Менделеев разместил два ведущих и неизменных признака: атомная масса и свойства элементов. Он расписал на листах все имеющиеся знания об открытых и изученных химических элементах и их соединениях. Сравнивая эти данные, ученый создал естественные ряды химических элементов, похожих по своим свойствам. Сравнение этих элементов друг с другом дало понять, что элементы несхожих групп имеют общие свойства.
Таким образом, Менделеев объединил получившиеся группы химических элементов в одну систему. Объединение позволило обнаружить, что свойства элементов меняются в пределах явных совокупностей линейно (возрастание либо убывание). Вслед за тем время от времени совпадают, то есть через определенное количество элементов появляются похожие.
Химик выявил периоды, где свойства химических элементов и веществ, которые получились из них, подвергаются неизбежному изменению.

Когда появился периодический закон
Открытие периодического закона Менделеевым произошло предположительно 1 марта 1869 г.
Периодический закон и периодическая система элементов химии имеют повторяющуюся неслучайность: кроме известной периодичности по горизонтали (период) имеется также периодичность по вертикали (группа) и по диагонали. В связи с учетом всех этих видов Д. И. Менделеев смог не только предугадать, расписать свойства веществ, которые являлись не открытыми элементами, но и показать ход их появления, земные ресурсы (руда и соединения), из которых были выявлены простейшие вещества.
Суть открытия периодического закона Менделеева заключается в росте атомного веса химических элементов, из-за которого изменения свойств происходят не размеренно, а время от времени.

Публикация периодической таблицы
Менделеев разместил периодическую таблицу всех найденных на тот момент элементов в российском журнале и открыл некоторые новые элементы для завершения таблицы. При появлении системы элементов в немецком журнале Менделеев заявил:
- При расположении элементов в таблице в соответствии с их атомной массой проявляется видимая периодичность свойств.
- Элементы, которые сходны химическими свойствами, имеют атомный вес, который либо имеет почти одинаковое значение (пример: платина Pt, иридий Ir, осмий Os), либо постоянно увеличивается (пример: калий K, рубидий Rb, цезий Cs).
- Элементы или группы элементов расположены в таблице в соответствии с их атомными массами и их валентностями, а также их характерными химическими свойствами. Это можно отследить в ряду: Li - литий, Be - берилий, B - бор, C - углерод, N - азот, O - кислород, F - фтор.
- У наиболее рассеянных элементов имеется наименьший атомный вес.
- Характер элемента зависит от величины атомного веса, так же как и характер сложного тела зависит от величины молекулы.
- Возможно открытие множества неизвестных миру элементов, таких как алюминий Al и кремний Si, которые имеют атомный вес 65 и 75 соответственно.
- Элемент иногда может менять свой атомный вес в соответствии со значениями своих соседних элементов. Например, атомный вес теллура (Te) может меняться от 123 до 126, но не может составлять 128.
- Атомная масса химического элемента позволяет определить определенные характерные свойства данного элемента.

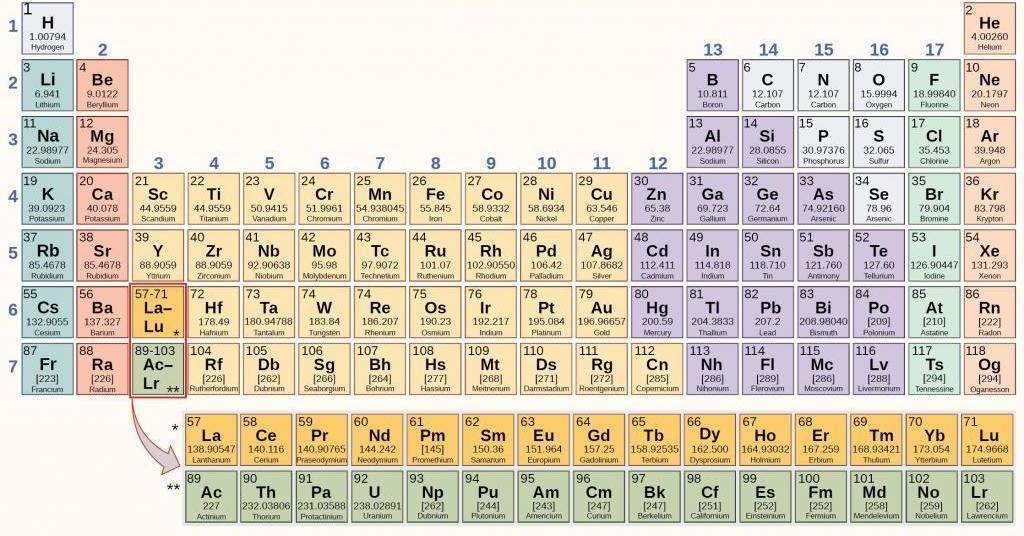
Периодическая таблица химических элементов
Периодическая таблица элементов является отображением открытия периодического закона Менделеева. Каждое число в таблице обозначает некоторую особенность в строении атома:
- На значение заряда атомного ядра влияет порядковый (атомный) номер элемента (значение протонов и электронов рядом с атомным ядром.
- Значение энергетического уровня (электронные слои) в атомах элементов выбранного периода совпадает с номером периода.
- Значение электронов внешнего уровня для элементов главных подгрупп и максимальное число валентных электронов для побочных подгрупп совпадает с номером группы.
Причиной периодичности элементов является перемена структуры наружных электронных слоев атома.
Из вышесказанного напрашивается некоторое заключение: свойства химических элементов и полученные из них вещества располагаются в периодической привязанности от структуры наружных электронных слоев атомов.
Современная периодическая таблица элементов
На сегодняшний день для группирования элементов возможно использование числа протонов в ядре взамен атомного. В таблице числится 120 элементов, расположенных слева направо в соответствии с увеличением атомного числа.
Столбцы таблицы обозначают собой группы, а строки – это периоды. Таблица включает в себя 18 групп и 8 периодов.
Металлические свойства элементов при перемещении по периоду в правую сторону снижаются, а в обратном – возрастают.
Величина атомов при движении направо продольно периоду уменьшается.
При смещении сверху вниз по группе возрастают восстановительные металлические свойства элементов.
Окислительные и неметаллические свойства при движении по периоду слева направо возрастают.
Заключение
Открытие периодического закона Менделеева дает возможность каждому химику предугадывать с определенной вероятностью свойства любого элемента перед работой с ним. Металлурги используют периодическую систему для изготовления новых сплавов, так как можно заменить один из металлов сплава другим, близким ему по свойствам. Это гарантирует незначительное изменение свойств получившегося сплава.
Читайте также:

