Опыт перрена по определению числа авогадро кратко
Обновлено: 04.07.2024
АВОГАДРО ЧИСЛО, NA = (6,022045±0,000031)·10 23 , число молекул в моле любого вещества или число атомов в моле простого вещества. Одна из фундаментальных постоянных, с помощью которой можно определить такие величины, как, например, массу атома или молекулы (см. ниже), заряд электрона и т.д.
Моль – количество вещества, которое содержит столько же структурных элементов, сколько атомов содержится в 12 г 12 С, причем структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моль вещества, выраженная в граммах, численно равна его мол. массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит 6,02·10 23 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2·18,998) = 78,076 г и содержит 6,02·10 23 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4·35,453) = 153,823 г и т.п.
Закон Авогадро.
На заре развития атомной теории (1811) А.Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объемах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при стандартных температуре и давлении (0° С, 1,01Ч10 5 Па) равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й.Лошмидт; было установлено, что в 1 см 3 идеального газа при нормальных (стандартных) условиях содержится 2,68675Ч10 19 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Метод Лошмидта
представляет только исторический интерес. Он основан на предположении, что сжиженный газ состоит из плотноупакованных сферических молекул. Измеряя объем жидкости, которая образовалась из данного объема газа, и зная приблизительно объем молекул газа (этот объем можно было представить исходя из некоторых свойств газа, например вязкости), Лошмидт получил оценку числа Авогадро ~10 22 .
Определение, основанное на измерении заряда электрона.
Единица количества электричества, известная как число Фарадея F, – это заряд, переносимый одним молем электронов, т.е. F = Ne, где е – заряд электрона, N – число электронов в 1 моль электронов (т.е. число Авогадро). Число Фарадея можно определить, измеряя количество электричества, необходимое для растворения или осаждения 1 моль серебра. Тщательные измерения, выполненные Национальным бюро стандартов США, дали значение F = 96490,0 Кл, а заряд электрона, измеренный разными методами (в частности, в опытах Р.Милликена), равен 1,602Ч10 –19 Кл. Отсюда можно найти N. Этот метод определения числа Авогадро, по-видимому, является одним из самых точных.
Эксперименты Перрена.
Расчеты с использованием числа Авогадро.
С помощью числа Авогадро были получены точные значения массы атомов и молекул многих веществ: натрия, 3,819Ч10 –23 г (22,9898 г/6,02Ч10 23 ), тетрахлорида углерода, 25,54Ч10 –23 г и т.д. Можно также показать, что в 1 г натрия должно содержаться примерно 3Ч10 22 атомов этого элемента.
См. также АТОМНАЯ МАССА.
До конца XIX в. реальность существования атомов и молекул не могла быть подтверждена из-за невозможности непосредственно их измерить и взвесить. Считалось, что атомно-молекулярное учение не отражает объективной реальности, а введено в науку для облегчения понимания химических процессов. Этим сомнениям был положен конец классическими опытами французского физика Перрена.
Он изготовил из смолистого вещества очень маленькие шарики, которые в его опытах играли роль моделей молекул газа. Шарики были приблизительно одинакового объема, и их массу можно было вычислить. Взболтав эти шарики в воде, Перрен наблюдал в микроскоп их распределение в сосуде. Вычислив количество шариков в единице объема на различных уровнях, ученый установил, что оно точно соответствует закону уменьшения концентрации газов с высотой. А этот закон был выведен из кинетической теории газов, в основе которой лежало атомно-молекулярное учение.
Французский физик Перрен воспользовался распределением Больцмана для экспериментального определения числа Авогадро.

Под микроскопом исследовалось броуновское движение частиц, которые распределялись по высоте подобно молекулам газа в поле тяготения.
1 – предметное стекло,
2 – покровное стекло,
4 – эмульсия с шариками диаметром доли микрон (частицы гуммигута – млечного сока деревьев).
Микроскоп наводился на верхний слой эмульсии (рис. 10.5), делали через микроскоп мгновенную фотографию, подсчитывали число броуновских частиц на фотографии. Далее тубус микроскопа опускали на 0,01 мм, снова фотографировали и подсчитывали число броуновских частиц на фотографии. Оказалось, что на дне сосуда броуновских частиц больше, на поверхности эмульсии меньше, а в целом распределение броуновских частиц по высоте соответствует распределению Больцмана. Так как шарики гуммигута находятся в жидкости (эмульсии), то потенциальная энергия их с учетом выталкивающей силы Архимеда можно записать , гдеm0 – масса шарика, mж – масса объёма жидкости, вытесненной шариком. Тогда распределение Больцмана можно записать .
Если n1иn2– измеренные концентрации частиц на высотахh1иh2, то;, а.
Тогда можно определить и.

,
где и– плотности материала шариков и эмульсии.
Определив экспериментально постоянную Больцмана kПеррен получил из зависимостизначение числа Авогадро. Точное значение:

(10.17)
Тема 11 работа, внутренняя энергия и теплота. Первое начало термодинамики
Термодинамика – это наука, изучающая условия превращения различных видов энергии в тепловую и обратно, а также количественные соотношения, наблюдаемые при этом. Термодинамика охватывает большой круг явлений, наблюдаемых в природе и технике. Особое значение она имеет для теплотехники, т.к. даёт основу для разработки тепловых и холодильных машин. В термодинамике часто пользуются словом тело. В термодинамике телом можно назвать воздух, воду, ртуть, любой газ, т.е. любое вещество, занимающее определённый объём.
Термодинамическая система может включать в себя несколько тел, но может состоять из одного тела, очень часто этим телом является идеальный газ.
Термодинамической системой называется любая совокупность рассматриваемых тел, которые могут обмениваться энергией между собой и с другими телами.Например, термодинамической системой может быть идеальный газ.

Состояние термодинамической системы характеризуется термодинамическими параметрами. Термодинамические параметры – это величины характеризующие состояние системы.К термодинамическим параметрам относятся такие величины, как давление, объём, температура, плотность вещества и т.д. Параметрами состояния идеального газа, например, являются давлениеP, объёмV, температураT. Уравнение, связывающее между собой параметры состояния термодинамической системы, называетсяуравнением состояния.Например, уравнение Менделеева – Клапейрона:.
Состояние термодинамической системы называется равновесным, если все его параметры имеют определенное значение и не изменяются со временем при неизменных внешних условиях.
Если термодинамическая система выведена из состояния равновесия и предоставлена сама себе, то она возвращается в исходное состояние. Этот процесс называется релаксацией.
В термодинамике изучают закономерности всевозможных переходов системы из одного состояния в другое. Переход системы из одного состояния в другое, который сопровождается изменением хотя бы одного параметра состояния, называется процессом.Уравнение, определяющее изменение параметров системы при переходе из одного состояния в другое, называется уравнением процесса.
Термодинамика изучает только термодинамически равновесные состояния тел и медленные процессы, которые рассматриваются как равновесные состояния, непрерывно следующие друг за другом. Она изучает общие закономерности перехода систем в состояния термодинамического равновесия.
Равновесные процессы – процессы, при которых скорость изменения термодинамических параметров бесконечно мала, т.е. изменение термодинамических параметров происходит за бесконечно большие времена. Это модель, т.к. все реальные процессы – неравновесные.
Равновесный процесс – процесс, который проходит через последовательность равновесных состояний.
Неравновесный процесс – процесс, при котором изменение термодинамических параметров на конечную величину происходит за конечное время.
Неравновесный процесс графически изобразить нельзя.
В термодинамике используется особый метод изучения явлений – термодинамический метод.Термодинамика рассматривает, как протекает процесс.
В основу термодинамики положено два основных закона, являющиеся обобщением громадного фактического материала. Эти законы дали начало всей науке термодинамике и поэтому получили название начал.
Рассмотрим некоторые явления, экспериментально подтверждающие основные положения и выводы молекулярно-кинетической теории.
2. Опыт Штерна. Первое экспериментальное определение скоростей молекул выполнено немецким физиком О. Штерном (1888—1970). Его опыты позволили также оценить распределение молекул по скоростям. Схема установки Штерна представлена на рис. 70. Вдоль оси внутреннего цилиндра с щелью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током при откачанном воздухе.
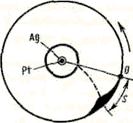
При нагревании серебро испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра, создавая изображение щели О. Если прибор привести во вращение вокруг общей оси цилиндров, то атомы серебра осядут не против щели, а сместятся от точки О на некоторое расстояние S. Изображение щели получается размытым. Исследуя толщину осажденного слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
Зная радиусы цилиндров, их угловую скорость вращения, а также измеряя S, можно вычислить скорость движения атомов серебра при данной температуре проволоки. Результаты опыта показали, что средняя скорость атомов серебра близка к той, которая следует из максвелловского распределения молекул по скоростям.
3. Опыт Ламмерт. Этот опыт позволяет более точно определить закон распределения молекул по скоростям. Схема вакуумной установки приведена на рис.71. Молекулярный пучок, сформированный источником, проходя через щель, попадает в приемник. Между источником и приемником помещают два диска с прорезями, закрепленных на общей оси. При неподвижных дисках молекулы достигают приемника, проходя через прорези в обоих дисках.
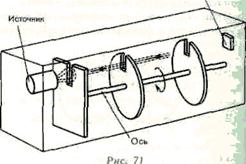
Если ось привести во вращение, то приемника достигнут только те прошедшие прорезь в первом диске молекулы, которые затрачивают для пробега между дисками время, равное или кратное времени оборота диска. Другие же молекулы задерживаются вторым диском. Меняя угловую скорость вращения дисков и измеряя число молекул, попадающих в приемник, можно выявить закон распределения скоростей молекул. Этот опыт также подтвердил справедливость максвелловского распределения молекул по скоростям.
4. Опытное определение постоянной Авогадро. Воспользовавшись идеей распределения молекул по высоте (см. формулу (45.4)), французский ученый Ж. Перрен (1870—1942) экспериментально определил постоянную Авогадро. Исследуя под микроскопом броуновское движение, он убедился, что броуновские частицы распределяются по высоте подобно молекулам газа в поле тяготения. Применив к ним больцмановское распределение, можно записать
где m — масса частицы, — масса вытесненной ею жидкости:
( — радиус частицы, — плотность частицы, — плотность жидкости).
Если и — концентрации частиц на уровнях и , a k = R/NA, то
Значение NA, получаемое из работ Ж. Перрена, соответствовало значениям, полученным в других опытах, что подтверждает применимость к броуновским частицам распределения (45.4).

Рассмотрим некоторые явления, экспериментально подтверждающие основные положения и выводы молекулярно-кинетической теории.
2. Опыт Штерна. Первое экспериментальное определение скоростей молекул выполнено немецким физиком О. Штерном (1888—1970). Его опыты позволили также оценить распределение молекул по скоростям. Схема установки Штерна представлена на рис. 70. Вдоль оси внутреннего цилиндра с щелью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током при откачанном воздухе.

При нагревании серебро испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра, создавая изображение щели О. Если прибор привести во вращение вокруг общей оси цилиндров, то атомы серебра осядут не против щели, а сместятся от точки О на некоторое расстояние S. Изображение щели получается размытым. Исследуя толщину осажденного слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
Зная радиусы цилиндров, их угловую скорость вращения, а также измеряя S, можно вычислить скорость движения атомов серебра при данной температуре проволоки. Результаты опыта показали, что средняя скорость атомов серебра близка к той, которая следует из максвелловского распределения молекул по скоростям.
3. Опыт Ламмерт. Этот опыт позволяет более точно определить закон распределения молекул по скоростям. Схема вакуумной установки приведена на рис.71. Молекулярный пучок, сформированный источником, проходя через щель, попадает в приемник. Между источником и приемником помещают два диска с прорезями, закрепленных на общей оси. При неподвижных дисках молекулы достигают приемника, проходя через прорези в обоих дисках.

Если ось привести во вращение, то приемника достигнут только те прошедшие прорезь в первом диске молекулы, которые затрачивают для пробега между дисками время, равное или кратное времени оборота диска. Другие же молекулы задерживаются вторым диском. Меняя угловую скорость вращения дисков и измеряя число молекул, попадающих в приемник, можно выявить закон распределения скоростей молекул. Этот опыт также подтвердил справедливость максвелловского распределения молекул по скоростям.
4. Опытное определение постоянной Авогадро. Воспользовавшись идеей распределения молекул по высоте (см. формулу (45.4)), французский ученый Ж. Перрен (1870—1942) экспериментально определил постоянную Авогадро. Исследуя под микроскопом броуновское движение, он убедился, что броуновские частицы распределяются по высоте подобно молекулам газа в поле тяготения. Применив к ним больцмановское распределение, можно записать
где m — масса частицы, — масса вытесненной ею жидкости:
( — радиус частицы, — плотность частицы, — плотность жидкости).
Если и — концентрации частиц на уровнях и , a k = R/NA, то
Значение NA, получаемое из работ Ж. Перрена, соответствовало значениям, полученным в других опытах, что подтверждает применимость к броуновским частицам распределения (45.4).
Читайте также:
- Цели и задачи изучения основ алгоритмизации и программирования в школьном курсе информатики
- Принцип фундаментальности и прикладной направленности обучения кратко
- Безопасность общества это кратко
- Ознакомление родителей с нормативными документами в школе
- Дифференциальные уравнения первого порядка задача коши кратко

