Охарактеризуйте применение водорода на основе его свойств кратко
Обновлено: 05.07.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Описание презентации по отдельным слайдам:
О ЧЕМ ИДЕТ РЕЧЬ.
самый распространенный элемент во Вселенной
является одним из двух элементов, из которых состоит вода
занимает первое место в периодической системе Д.И. Менделеева
Водород, его общая характеристика, нахождение в природе, получение. Свойства и применение водорода
ПЛАН УРОКА
Историческая справка
Положение в ПСХЭ Д.И. Менделеева
Физические свойства
Получение
Химические свойства
Применение
Рефлексия
1766 г. – водород открыл Г. Кавендиш
Г. Кавендиш
1784 г. – А. Лавуазье назвал водород hydrogene (др.-греч. hydro genes – порождающий воду)
А. Лавуазье
Изотопы водорода
Изотопы - разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа
Положение водорода в ПСХЭ
Д. И. Менделеева
IA
VII A
Сходство с щелочными металлами
Сходство с галогенами
1 валентный электрон
Восстановительные свойства
Не хватает 1 электрона до завершения уровня
Окислительные свойства
Двухатомные молекулы
При обычных условиях газ (фтор, хлор)
Физические свойства
Газ без цвета, вкуса и запаха.
Самый легкий газ.
Малорастворим в воде.
1. Действием разбавленных кислот (кроме HNO3) на металлы:
ZnCl2
+
H2
2
Аппарат Киппа
Прибор Кирюшкина
Получение
2. Взаимодействием активных металлов с водой:
Ca + H2O =
Ca(OН)2
+ H2
2
Получение
3. Электролиз воды:
Химические свойства
1. Взаимодействие с металлами:
Ca + H2 =
CaH2
2. Взаимодействие с неметаллами:
H2 + Сl2 =
2
Химические свойства
НСl
Химические свойства
H2 + О2 =
H2О
2
3. Взаимодействие с неметаллами:
3. Восстановление металлов из оксидов:
СuO + H2 =
Химические свойства
Сu + H2O
Краткое описание документа:
Водород, его общая характеристика, нахождение в природе, получение. Свойства и применение водорода
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 922 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 28 человек из 18 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Дистанционные курсы для педагогов
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 612 620 материалов в базе
Материал подходит для УМК
§ 19. Водород — химический элемент и простое вещество
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 03.03.2022 19
- PPTX 10.5 мбайт
- 0 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Купрюхина Наталья Николаевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Россияне ценят в учителях образованность, любовь и доброжелательность к детям
Время чтения: 2 минуты
Академическая стипендия для вузов в 2023 году вырастет до 1 825 рублей
Время чтения: 1 минута
Время чтения: 2 минуты
Время чтения: 2 минуты
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
В Госдуме предложили ввести сертификаты на отдых детей от 8 до 17 лет
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Ключевые слова конспекта: химические свойства водорода, применение водорода,
Водород при комнатной температуре малоактивен. При нагревании водород реагирует со многими простыми и сложными веществами.
Реакции соединения
В реакциях с неметаллами водород является восстановителем. При поджигании на воздухе водород сгорает или реагирует с кислородом с взрывом:
2Н2 + О2 = 2Н2O.
При поджигании водород реагирует с газом хлором Сl2 (на ярком свету — с взрывом) с образованием газа хлороводорода НСl.
Н2 + Сl2 = 2НСl.
Реакции с бромом и йодом обратимы и протекают при 400-500 °С.
При температуре 150-200 °С водород реагирует с серой, при этом получается газообразный сероводород:
При более высокой температуре идет заметное разложение сероводорода.
Синтез метана в реакции с графитом проходит при повышенном давлении и 600 °С. При более высокой температуре преобладает обратное направление процесса:
Реакция водорода с азотом протекает достаточно быстро только при 500 °С в присутствии катализатора Fe3O4 при давлении 20-30 МПа:
Летучие водородные соединения, в формулах которых первым стоит Н, называют, прочитывая формулы справа налево: НСl — хлороводород, H2S — сероводород, НВг — бромоводород. Названия веществ СН4 — метан, NH3 — аммиак.
В реакциях с металлами водород оказывается окислителем. При нагревании он реагирует с щелочными и щелочноземельными металлами, образуя гидриды:

В гидридах щелочных и щелочноземельных металлов водород находится в степени окисления -1.
Реакции замещения
При нагревании водород реагирует с оксидами многих металлов. Продукты реакции — свободный металл и вода. Реакции замещения с участием водорода — реакции восстановления:
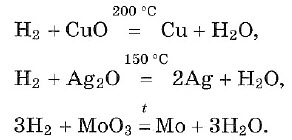
Хром и более активные металлы водородом из соединений не восстанавливаются.
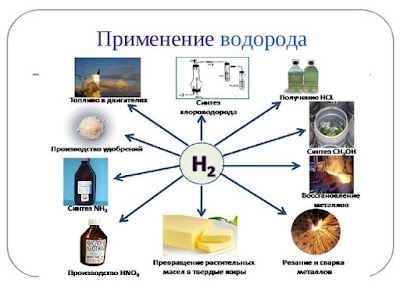
Применение водорода
Раньше водород использовали для наполнения воздушных шаров и дирижаблей. Впоследствии от этого отказались из-за взрыво- и пожароопасности водорода. Сейчас водород — ракетное топливо. Водород необходим для синтеза аммиака NH3 и хлороводорода НСl. С помощью водорода получают особо чистые металлы для полупроводниковой техники. В органической химии с применением водорода получают метиловый спирт СН3ОН, твердые пищевые жиры из растительных масел, синтетическое жидкое топливо. Изотопы водорода — дейтерий 2 D и тритий 3 Т — термоядерное горючее.
Полезный материал про водород есть на сайте. Рекомендую.
Основные тезисы параграфа:
Водород – бесцветный газ без запаха. В 14,5 раз легче воздуха (плотность 0,09 г/л). Малорастворим в воде.
Спокойно горит на воздухе, но может образовывать взрывоопасную смесь – гремучий газ.
При нагревании водород вступает во взаимодействие с хлором, расплавленной серой, активными металлами, оксидами неактивных металлов. При повышенном давлении и температуре, водород способен взаимодействовать с азотом, с образованием важного соединения – аммиака.
Применение водорода: химический синтез (получение аммиака, получение соляной кислоты), гидрогенизация растительных масел (получение твёрдых жиров), получение некоторых металлов из их оксидов, в качестве топлива, резка и сварка металлов.

Химические свойства водорода
При обычных условиях молекулярный водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами.
Водород вступает в реакции с простыми и сложными веществами.

При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ
Взаимодействие водорода с металлами приводит к образованию сложных веществ - гидридов, в химических формулах которых атом металла всегда стоит на первом месте. При высокой температуре водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя белые кристаллические вещества - гидриды металлов ( Li Н, Na Н, КН, СаН 2 и др.):
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
Рассмотрим более подробно некоторые реакции:
1). При взаимодействии (в/д) с кислородом образуется вода:
При обычных температурах реакция протекает крайне медленно, выше 550°С - со взрывом (смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом).
2). При взаимодействии (в/д) с галогенами образуется галогеноводороды, например:
При этом с фтором водород взрывается (даже в темноте и при - 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании.
3). При взаимодействии (в/д) с азотом образуется аммиак:
лишь на катализаторе и при повышенных температуpax и давлениях.
4). При взаимодействии (в/д) с серой образуется сероводород:
значительно труднее с селеном и теллуром.
5). При в/д с чистым углеродом водород может реагировать без катализатора только при высоких температуpax:
Водород вступает в реакцию замещения с оксидами металлов , при этом образуются в продуктах вода и восстанавливается металл. Водород - проявляет свойства восстановителя: используется для восстановления многих металлов , так как отнимает кислород у их оксидов:

Применение водорода
В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород".
Водород используется для превращения жидких жиров в твердые (гидрогенизация), производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов (германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой - для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из наиболее эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Составьте уравнения реакций взаимодействия водорода со следующими веществами: Br2, Mg, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций.
Задание №3.
Вычислите массу воды, которую можно получить при сжигании 4 г водорода?
Читайте также:
- Какова роль старославянского языка в становлении современного русского литературного языка кратко
- К содержанию образования относятся понятия учебные программы школьные учебники учебная доска
- Гуманистическая воспитательная система современной массовой школы
- Отчет о мероприятиях ко дню победы в школе
- Характеристика на ученика 4 класса начальной школы отрицательная

