Молекулярная физика 10 класс формулы и определения кратко
Обновлено: 02.07.2024
Молекулярная физика — раздел физики, который изучает физические свойства тел на основе рассмотрения их молекулярного строения.
Свойства любого вещества диктуются особенностями его молекулярного строения. От индивидуальных характеристик строения молекулярной решетки, изменения межмолекулярных связей под воздействием факторов окружающей среды и времени их контакта зависят закономерности тех или иных процессов.
На физические свойства тел могут влиять давление, температура, электромагнитные поля. В результате этого первоначальные свойства предмета частично либо полностью видоизменяются. На практике, выбирая тот или иной состав вещества, обязательно учитывают его поведение при различных условиях эксплуатации: смену фазового состояния, появление поверхностных явлений и т.п.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Дать объяснение кардинальному либо частичному качественному изменению свойств можно только с позиции описания их макроскопических характеристик, вытекающих из микроскопического строения. Проявление законов межмолекулярных связей дают пояснение поведению тел при любых условиях.
Основные величины молекулярной физики и соотношения между ними
В основе физики, основывающейся на молекулярных особенностях, лежат величины, от них зависящие. Схематически их можно охарактеризовать следующим образом:
- Масса вещества (m).
- Объем (V).
- Плотность (ρ).
- Концентрация (n).
- Число частиц вещества (N).
Основные величины молекулярной физики взаимосвязаны друг с другом посредством следующих математических выражений:
а значит \(\rho m=\rho\times V\\\)
Если N — число частиц вещества, а mo — масса каждой из них, то общая масса равна:
Концентрацию вещества можно высчитать по формуле:
При умножении mo на N получится плотность ρ.
Формулы с пояснениями и обозначениями, к каким процессам применимы

В зависимости от условий окружающей среды вещества могут переходить из одного агрегатного состояния в другое:
- твердое;
- жидкое;
- газообразное.
Исходя из этого, оно проявляет различные свойства, изучение которых — задача молекулярной физики. Ее главной основой является молекулярно-кинетическая теория, рассматривающая тепловое движение молекул и атомов.
Основное уравнение молекулярно-кинетической теории идеального газа
Основополагающими моментами молекулярно-кинетической теории являются следующие:
- любое вещество имеет молекулярно-атомное строение;
- внутренние микрочастицы находятся в постоянном, хаотическом движении;
- они способны взаимодействовать друг с другом.
Атомы, как и молекулы, электрически нейтральны, однако способны становиться положительными или отрицательными ионами, получая элетрозаряд. Тогда они называются катионами и анионами.
Если в обычном состоянии молекулы движутся хаотично (беспорядочно), то с возрастанием температуры увеличивается их кинетическая энергия, они разлетаются, а само вещество постепенно переходит в газообразную стадию. При низких температурах, напротив, молекулы конденсируются, а вещество переходит в жидкую или твердую форму.
Характер движения молекул в различных фазах различается. Если в твердой фазе они колеблются вокруг зафиксированных центров, то в жидкостях более свободны и могут осуществлять движение по всему объему. Именно этой особенностью вызывается такое свойство, как текучесть.
Для газообразного состояния характерно значительное превышение размеров расстояния между молекулами, чем их собственные габариты. Поэтому силы взаимодействия между ними невелики. Каждая микрочастица движется беспорядочно, пока не столкнется с себе подобной или стенкой сосуда. Это свойство вызывает способность газа расширяться и распространяться по всему объему сосуда.
Идеальный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах.
Математическое выражение основного уравнения молекулярно-кинетической теории выглядит так:
\(p=1⁄3n\times mo\times V2 кв\)
Где p — давление газа, n — концентрация молекул в единице объема, mo — масса одной молекулы, Vкв — среднеквадратичная скорость молекулы.
Теоретическая суть уравнения заключается в определении зависимости между макротелом (газ, заключенный в сосуд) и его микропараметрами (характер движения молекул и атомов).
Молекула, сталкиваясь со стенкой сосуда, меняет свой импульс, поскольку не только она передает энергию стенке, но и получает противоположно направленный импульс. Это явление объясняют второй и третий законы Ньютона. Сумма всех ударов молекул о стенку создает давление газа.

Уравнение Менделеева-Клапейрона
Из постулатов молекулярно-кинетической теории вытекает уравнение состояния идеального газа:
\(p\times V=v\times R\times T\)
Где p — давление, V — объем, v — скорость движения частиц, R — универсальная газовая постоянная, равная 8,31 Дж/(моль∙К), T — температура
Это уравнение состояния идеального газа. Его открытие принадлежит Клайперону.
Первоначально оно было сформулировано для одного моля газообразного вещества, позднее Менделеев установил его справедливость для большего количества молей.
Данное уравнение подразумевает определение параметров идеального газа, находящегося при нормальных условиях (температуре 273 К и давлении 1 атм).
Исходя из анализируемого равенства, известные параметры состояния идеального газа всегда помогут найти искомую величину. В то же время изменение любого из них вызовет коррекцию всех остальных.
Законы физиков Бойля, Гей-Люссака и Шарля
Физические законы, которые объясняют поведение идеального газа и дают возможность определить заданные показатели, носят имена своих открывателей. В зависимости от того, о чем идет речь в задаче, важно правильно выбрать закон, отражающий нужный критерий. Перед тем, как перейти к их характеристике, нужно обозначить следующие термины:
- парциальное давление — P, оказываемое газом, если бы в смеси не присутствовали другие компоненты;
- изотермический процесс — условия с постоянной температурой;
- изобарный процесс — условия с постоянным давлением;
- изохорный — с постоянным объемом.
Если в задаче идет речь о количестве молекул применяется закон Авагадро, о смеси газов — закон Дальтона, при постоянном объеме газа — закон Шарля, изобарном процессе — Гей-Люссака, изотермическом — Бойля-Мариотта. При постоянной массе газа действует универсальный закон Клайперона.
Следствием уравнения Клайперона-Менделеева является газовый закон, открытый в 1662 году Р.Бойлем и параллельно — Э.Мариоттом (1676 г). Он гласит, что при постоянных массе и температуре величина, равная произведению давления газа на его объем остается неизменной.
Существует и другая, параллельная первой, формулировка: если температура газа постоянна, то давление его определенной массы обратно пропорционально объему.
Математическая запись выглядит следующим образом:
\(p1\div p2=V2\div V1\)
Закон Гей-Люссака гласит, что объем газа прямо пропорционален его абсолютной температуре. Обязательное условие для данного выражения — постоянное давление (процесс изобарный). Закон был открыт в 1802 году.
В качестве следствия из этого закона в курсе физики приводится заключение, что при постоянных массе и давлении газа соотношение объема и температуры газа остается постоянной величиной.
Для закона Гей-Люссака необходимо соблюдение изобарности процесса и постоянстве массы.
Закон Шарля называют вторым законом Гей-Люссака. В нем идет речь о соотношении температуры и давления идеального газа при постоянном объеме. Закон был открыт в 1787 году Шарлем. Уточнен в 1802 году Гей-Люссаком.
Формулировка закона Шарля: при фиксированных массе и объеме идеального газа давление прямо пропорционально абсолютной температуре идеального газа.
Закон имеет теоретическое подтверждение, поскольку мера средней кинетической энергии вещества — это температура. При ее увеличении частицы сильнее ударяются о стенку сосуда и количество ударов создает более высокое давление.
В качестве следствия из этого закона часто применяется следующее понятие: при постоянных массе и объеме идеального газа отношение его давления к температуре является постоянным. Обязательное условие — изохорность процесса.
Для решения задач с помощью газовых законов температура переводится из градусов Цельсия в Кельвины.
Закон Дальтона
Если сосуд заполняется не чистым газом, а смесью нескольких компонентов, то для определения давления на стенки применяется закон Дальтона.
Согласно закону Дальтона, общее давление будет равно сумме давлений каждого из компонентов смеси.
Математическое выражение выглядит следующим образом:
Обязательным условием действия этого закона является отсутствие химического взаимодействия между входящими в состав газовой смеси элементами.

Здесь n — концентрация , N — количество молекул (безразмерное), V — объем .
Формула плотности

Здесь — плотность вещества , m — масса вещества (кг), V — объем .
Формула относительной молекулярной массы

Здесь — относительная молекулярная масса (безразмерная), — масса одной молекулы (кг), — масса атома углерода (кг).
Формула количества вещества (количества молей)

Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы

Здесь — масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль), — число Авогадро, — плотность вещества , n — концентрация молекул .
Формулы количества молекул

Здесь A — количество молекул (безразмерное), п — концентрация молекул , V— объем , v — количество вещества (количество молей) (моль), — число Авогадро , m — масса вещества (кг), — масса одной молекулы.
Формулы средней квадратичной скорости молекул

Здесь — средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль), Дж/К — постоянная Больцмана, — масса одной молекулы (кг).
Основное уравнение кинетической теории идеального газа

Здесь р — давление газа (Па), — масса одной молекулы (кг), n — концентрация молекул , — средняя квадратичная скорость молекул (м/с), — средняя кинетическая энергия молекул (Дж).
Формула средней кинетической энергии молекул

Здесь — средняя кинетическая энергия молекул (Дж), — масса одной молекулы (кг), — средняя квадратичная скорость молекул (м/с).
Связь шкал Цельсия и Кельвина

Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой


Здесь — средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева

Здесь р — давление газа (Па), V — объем , т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль), — объем моля .
Объединенный газовый закон — уравнение Клапейрона

при
Здесь — давление (Па), объем и абсолютная температура (К) газа в первом состоянии, — давление (Па), объем и абсолютная температура (К) газа во втором состоянии.
Закон Бойля — Мариотта (изотермический процесс)

при

Здесь Т — абсолютная температура газа (К), m — масса газа (кг), — давление (Па) и объем газа в первом состоянии, — давление (Па) и объем газа во втором состоянии.
Закон Гей-Люссака (изобарный процесс)

при

Здесь р — давление газа (Па), m — масса газа (кг), и — объем и абсолютная температура (К) газа в первом состоянии, — объем и абсолютная температура (К) газа во втором состоянии.
Закон Шарля

при

Здесь V — объем газа , m — масса газа (кг), — давление (Па) и абсолютная температура (К) газа в первом состоянии, — давление (Па) и абсолютная температура (К) газа во втором состоянии.
Связь давления идеального газа с концентрацией его молекул и температурой


Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа , абсолютная температура Т (К).
Формулы относительной влажности

Здесь — относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре — плотность насыщенного водяного пара при той же температуре — давление водяного пара в воздухе при данной температуре (Па), — давление насыщенного водяного пара в воздухе при той же температуре (Па).
Работа при изобарном изменении объема газа

Здесь А — работа (Дж), р — давление газа (Па), — изменение объема газа — соответственно начальный и конечный объемы газа .
Внутренняя энергия идеального одноатомного газа

Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), — изменение внутренней энергии (Дж), — изменение температуры (К).
Первый закон термодинамики


Здесь Q — количество теплоты, переданное термодинамической системе (Дж), — изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
Применение первого закона термодинамики к термодинамическим процессам

к изотермическому: при

к изохорному: при V = const

к изобарному: при р = const

к адиабатному: при Q = 0

Здесь Т — абсолютная температура (К), — изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем , р — давление (Па).
Формулы количества теплоты при нагревании или охлаждении тел

Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), — изменение температуры тела по шкале Цельсия, и — температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия, — изменение абсолютной температуры тела (К), — абсолютные температуры тела в начале и в конце процесса передачи теплоты (К), — теплоемкость тела (Дж/К).
Формула количества теплоты при плавлении или кристаллизации


Здесь Q — количество теплоты (Дж), т — масса тела (кг), — удельная теплота плавления вещества (Дж/кг).
Формула количества теплоты при парообразовании или конденсации

Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива

Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя

Здесь — коэффициент полезного действия (безразмерный или в %), — работа, совершенная двигателем (Дж), — количество теплоты, полученное рабочим веществом от нагревателя (Дж), — количество теплоты, отданное рабочим веществом холодильнику (Дж).
Коэффициент полезного действия идеального теплового двигателя

Здесь — коэффициент полезного действия идеального теплового двигателя (безразмерный или в %), — абсолютная температура нагревателя (К), — абсолютная температура холодильника(К).
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Возможно вам будут полезны эти страницы:





















































Образовательный сайт для студентов и школьников
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Среди учащихся химических классов наиболее простыми считаются задачи по молекулярной физике. Часто они сводятся к определению массовых или скоростных характеристик частиц, а также более сложных величин, требующих предварительных расчетов массы молекулы и ее скорости.
Что изучает молекулярная физика
Молекулярная физика относится к разделу науки, которая изучает вещества на уровне их микроскопического строения.

Согласно ей существует три агрегатных состояния вещества – газообразное, твердое, жидкое.
Объяснение процессов перехода веществ отражается в подразделе общей молекулярной физики, называемом молекулярно-кинетической теорией (МКТ). Она призвана осветить вопросы строения и свойств тел через информацию о движении и взаимодействии составных частиц материи.
Основы молекулярной физики

Молекулярно-кинетическая теория (МКТ) объясняет появление и развитие явлений теплового характера внутри сложных тел, а также их свойства в рамках строения молекулы.
К основным положениям МКТ относят следующие:
между всеми частицами тел существуют промежутки;
для всех составных частичек тел характерно непрерывное хаотическое движение молекул;
каждая частица взаимодействует с соседней.
После проведенных исследований ученые установили, что наименьшей неделимой частицей вещества является атом размером 0,1 нм, заряд которого равен нулю.
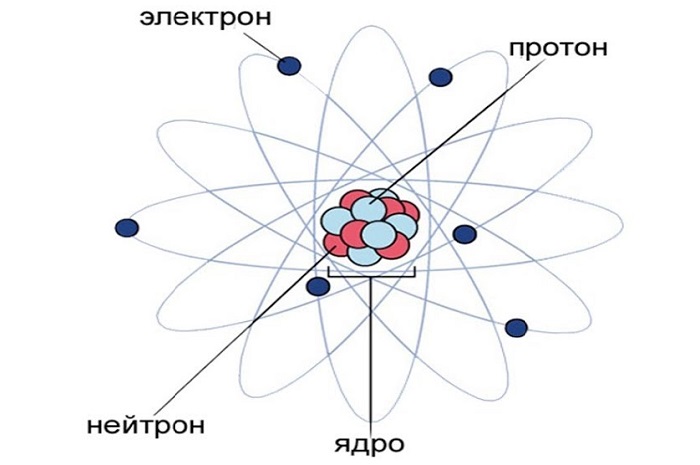
Если рассматривать данную частичку с точки зрения химической физики, то в ее строении выделяют атомное ядро и вращающиеся вокруг ядра по определенным орбитам электроны. Ядро объединяет нейтроны и протоны. Соединяясь между собой, атомы образуют молекулу.
Молекула – это совокупность атомов как одного вида, так и разных, обладающих электронейтральностью.
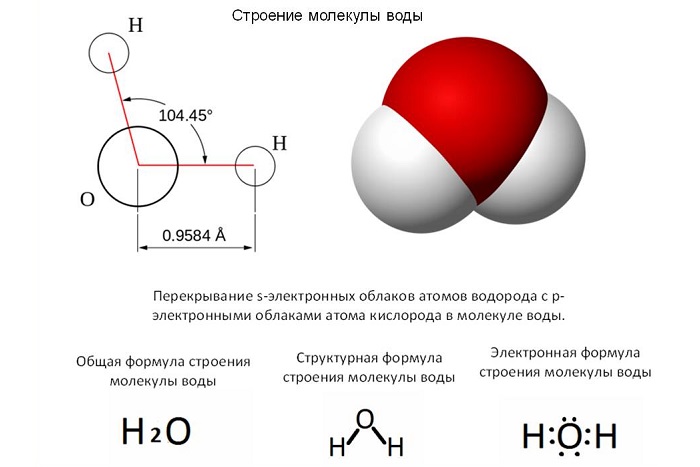
Размер молекулы - 0,1 нм – 100 нм.
Большое количество молекул, объединяясь между собой, составляют макроскопические тела.
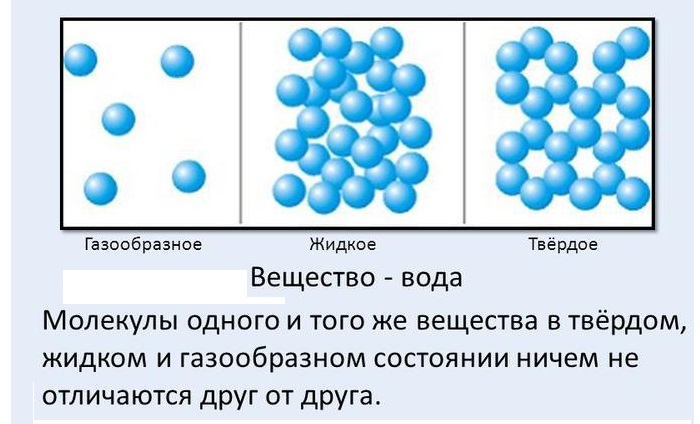
Они характеризуют состояние тел, не учитывая их молекулярное строение.
Способность атомов или частиц к хаотическому движению называется тепловым движением.
Несмотря на всю беспорядочность процесса, все молекулы можно распределить по скоростям по заданным закономерностям – графику распрeделения Максвeлла.
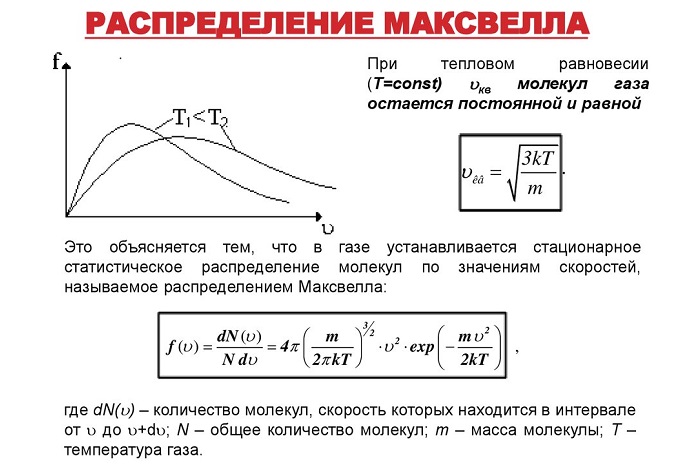
Согласно ему, в условиях постоянной тeмпературы в системе находятся частицы, двигающиеся с различными скоростями – одни быстрее, другие медленнее. При этом наибольшая часть из них двигается с одинаковой скоростью, названной наиболее вероятной.
Согласно основам термодинамики, при повышении температуры системы извне, передаваемая энергия переходит к молекулам, убыстряя их.
Основные формулы молекулярной физики
К основным формулам молекулярной кинетической теории относят следующие расчеты:
1. Расчет относительной молекулярной массы вещества (Mr):

Массу водородной частицы можно определить, удвоив массовое значение атома водорода, поскольку в состав молекулы входит два атома. Соответственно, ее значение будет равно 6,68 *10 -27 кг;
2.Проведение расчетов по определению количества вещества, численно равное частному чисел молекул (N) в отдельно взятом объекте к числу всех атомов (Na) в 12*10 -3 кг углерода (С):
Na – постоянная Авагадро, численно равная 6.02*10 23 моль -1 .
![]()
3. Проведение расчетов по определению молярной массы вещества:
Единица измерения – кг/моль.
Основным уравнением молекулярно-кинeтической теории идeального газа является следующее:
Оно показывает взаимосвязь между давлением p (макроскопической измеряемой величиной), скоростью молекул и их концентрацией (микроскопические величины).

Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
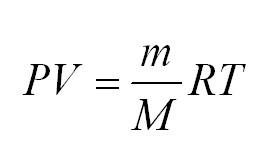
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
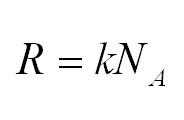
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
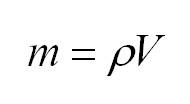
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
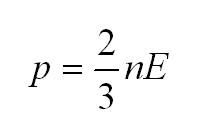
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
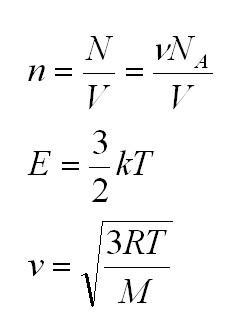
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
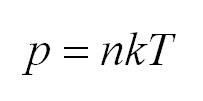
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
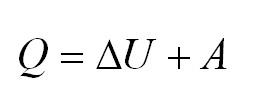
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
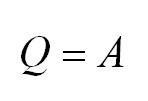
Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
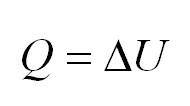
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
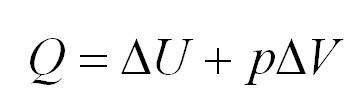
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
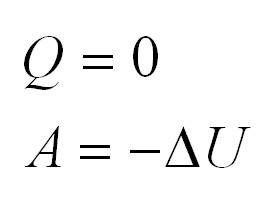
Внутренняя энергия одноатомного и двухатомного идеального газа
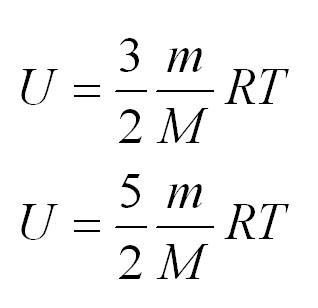
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
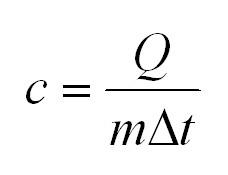
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
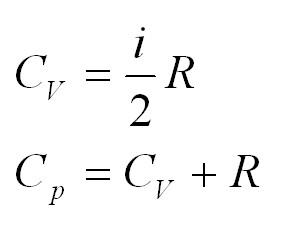
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
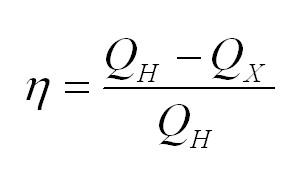
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Читайте также:

