Механизм реакции замещения на примере предельных углеводородов кратко
Обновлено: 06.07.2024
Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Видеоопыт "Отношение метана к раствору перманганата калия и бромной воде"
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
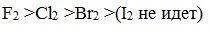
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400 о C.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
(hv — формула кванта света)
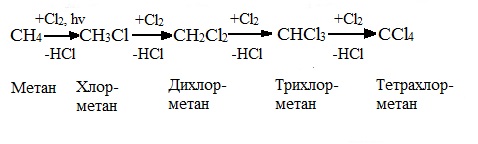
Тривиальное название трихлорметана – хлороформ.
Механизм реакции
Реакция осуществляется в три стадии:
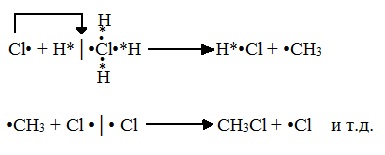
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:

Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
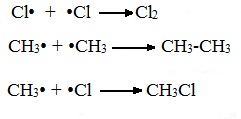
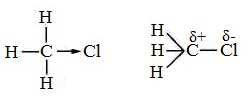
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
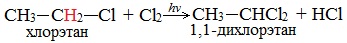
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Видеоопыт "Взаимодействие алканов с бромом при нагревании"
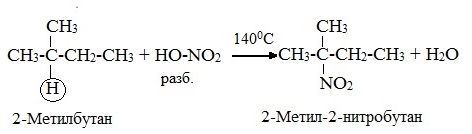
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 140 0 С и при повышенном или нормальном давлении - реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
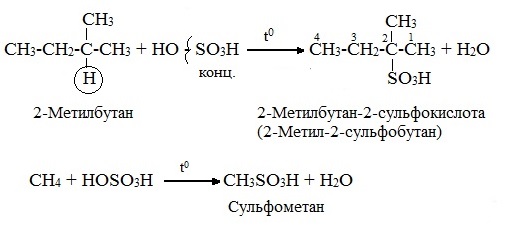
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
Реакции окисления

Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
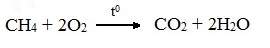
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Видеоопыт "Горение жидких алканов"
Видеоопыт "Горение твердых углеводородов (на примере парафина)"
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
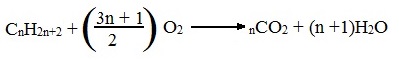
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
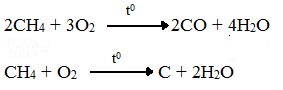
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
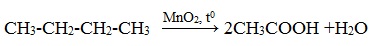
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты:
Этим способом в промышленности получают уксусную кислоту.
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
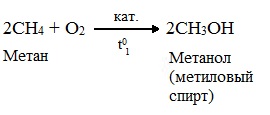
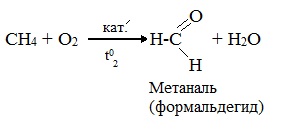
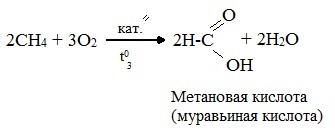
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Термические превращения алканов (реакции разложения)
1. Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 700 0 С:
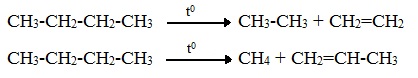
Крекинг н-гексана (работа Литвишко Алексея, г. Самара)
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования.
Крекинг октана (работа Литвишко Алексея, г. Самара)
2.При нагревании метана или этана до температуры 1000 0 С начинается пиролиз – разложение на простые вещества:
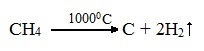
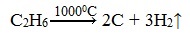
Полученный этим способом углерод является достаточно чистым, в технике называется сажей и используется, например, при производстве автомобильных покрышек.
3. Конверсия метана с образованием синтез – газа (СО + Н2)

Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Реакции отщепления
1.Дегидрирование (отщепление водорода; происходит в результате разрыва связей С ─ Н; осуществляется в присутствии катализатора при повышенных температурах).
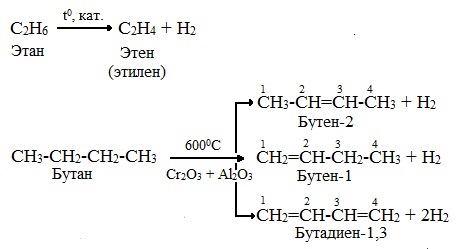
В ходе пропускания алканов над катализатором (Pt, Pd, Ni, А1203, Сг203) при высокой температуре (400 — 600°С) происходит отщепление молекулы водорода и образование алкена:
2. Если метан нагреть до более высокой температуры (1500 0 С) и быстро охладить, то происходит межмолекулярное дегидрирование и образуется этин (ацетилен):
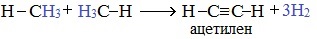
3.Дегидроциклизация (ароматизация) - реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
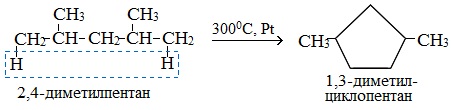
Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при температуре 300 0 С над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи и образуется пятичленный цикл (циклопентан или его производные):
Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола м его производных:

Реакции перегруппировки (изомеризация)
1.Изомеризация (превращение химического соединения в его изомер):
Нормальные алканы под влиянием катализаторов и при нагревании способны превращаться в алканы с разветвленной цепью без изменения состава молекул. В этих случаях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов:

Эта реакция является важной для производства бензина, поскольку наличие в его составе разветвленных углеводородов повышает октановое число, т.е. качество топлива.
Видеоопыт "Установление качественного состава предельных углеводородов"
Рубрики: Алканы Теги: Алканы
В реакции дегидрирлвания, приполучении бутадиена-1,3 неверно указано число атомов водорода у 4 атома углерода
Володя, спасибо за внимательность)
Разве при реакция дегидрирования используется платина? Она же при реакция гидротации используется
Сергей, платина, как катализатор, используется во многих химических реакциях)
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:

Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:

Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:


Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:

- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.

4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Галогенирование -- это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно -- за один этап замещается не более одного атома водорода:
1. CH4 + Cl2 > CH3Cl + HCl (хлорметан)
2. CH3Cl + Cl2 > CH2Cl2 + HCl (дихлорметан)
3. CH2Cl2 + Cl2 > CHCl3 + HCl (трихлорметан)
4. CHCl3 + Cl2 > CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Нитрование (реакция Коновалова)
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных. Реакция также подчиняется правилу Марковникова.
RH + HNO3 = RNO2 + H2O
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
1) метанв составе природного газа находит все более широкое применение в быту и на производстве;
3) жидкие углеводороды используются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4) метанкак доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7) метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана
Непредельные углеводороды ряда этилена, общая формула и химические свойства. Применение этиленовых углеводородов в медицине.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4)
СH2=CH-CH3 + H2 → CH3-CH2-CH3
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 - качественная реакция на алкены — обесцвечивание бромной воды.
Присоединение по правилу Марковникову:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
СH2=CH-CH3 + HCl = CH3-CHCl-CH3
1)В нейтральной (или слабощелочной среде:
СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение
2)В кислой среде — идет разрыв двойной связи:
R-СH2=CH2-R → 2R-COOH — схематичное уравнение
полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O
Реакция полимеризации: n СH2=CH2 → n(-CH2-CH2-)
При взаимодействии этилена с хлороводородом образуется этилхлорид, который используют в медицине для проведения местной анестезии. Применение алкенов также связано с их способностью реагировать с водой, образуя при этом спирты. Так, из этилена в процессе реакции гидратации получается этиловый спирт. Нашли свое применение в качестве сырья для производства органических соединений, лаков, пластических масс, средств косметической промышленности и окиси алкенов.
Механизм реакции присоединения на примере непредельных углеводородов ряда этилена. Правило Марковникова. Применение этиленовых углеводородов в органическом синтезе.
Рассмотрим этот механизм на примере реакции присоединения бромоводорода к молекуле этилена.

Несмотря на то, что реакция гидробромирования описывается очень простым равнением, ее механизм включает несколько стадий.

Стадия 2. Связь водород-галоген разрывается с образованием электрофильной частицы Н+, и нуклеофильной частицы Br-. Освободившийся электрофил Н+ присоединяется к алкену за счет электронной пары двойной связи, образуя σ-комплекс – карбокатион.

Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный нуклеофил с образованием конечного продукта реакции.

Правило Марковникова — в органической химии правило, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году

.
Реакция протекает в две стадии. На первой, медленной стадии происходит присоединение протона H+ к двойной связи: при этом протон может связываться с одним из двух атомов углерода, образующих двойную связь. Образующиеся карбокатионы И1 и И2 имеют различную энергию (устойчивость), поскольку положительный заряд в них делокализуется с разной эффективностью. По этой причине вторичный карбокатион И2 является более устойчивым, и соответствующий ему бромид П2 образуется в большем количестве.

При более строгом рассмотрении необходимо сравнивать устойчивости не интермедиатов, а двух альтернативных переходных состояний на стадии образования карбокатионов, то есть энергии активации двух параллельных процессов. Для некоторых реакций различие этих величин достигает 25—30 кДж/моль.
Благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ.
Вопрос 42
Ацетилен — непредельный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства:
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах . Малорастворим в воде, хорошо растворяется в ацетоне. Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном [5] .
Химические свойства:
Для ацетилена (этина) характерны реакции присоединения:
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения .
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов - эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации)
В лаборатории ацетилен получают действием воды на карбид кальция ,а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Ацетилен используют:
1)для сварки и резки металлов,
2)как источник очень яркого, белого света в автономных светильниках, где он получается реакцией
3)карбида кальция и воды (см. карбидная лампа),
4)в производстве взрывчатых веществ (см. ацетилениды),
5)для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука,ароматических углеводородов.
6)для получения технического углерода
7)в атомно-абсорбционной спектрофотометрии при пламенной атомизации
8)в ракетных двигателях
Вопрос 43
Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
а)в присутствии катализатора – Солей железа (III) –бензол вступает в реакцию замещения, так же он реагирует и с хлором.
Б)взаимодействие с азотной кислотой
А)при действии солнечного света или ультрафиолетовых лучей. На свету присоединяется хлор и образуется гексахлорциклогексан (гексахлоран). Эта реакция используется и в промышленности, т.к. гексахлоран применяют для борьбы с насекомыми (инсектицид):
3. реакции окисления
А) при действии энергичных окислителей на гамологи бензола окислению подвергаются только боковые цепи
Б)бензол и его гомологи на солнце горят коптящем пламенем
Продукт для получения красителей, медикоментов, взрывчатых веществ, инсектицидов, пластмасс и синтетических волокон. Хороший растворитель многих органических веществ.
Получение. Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании). Сухая перегонка производится на коксохимических и газовых заводах
Вопрос 46
Этиленгликоль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
· Как компонент автомобильных антифризов и тормозных жидкостей
· В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
· В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
· Как растворитель красящих веществ;
· В органическом синтезе:
· в качестве высокотемпературного растворителя.
· для защиты карбонильной группы путём получения 1,3-диоксолана
· В качестве криопротектора
· Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
· Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
· при производстве конденсаторов
· при производстве 1,4-диоксана
· компонент в составе систем жидкостного охлаждения компьютеров
· как теплоноситель в системах чиллер-фанкойл
· в качестве компонента крема для обуви (1—2 %)
· в составе для мытья стёкол вместе с изопропиловым спиртом
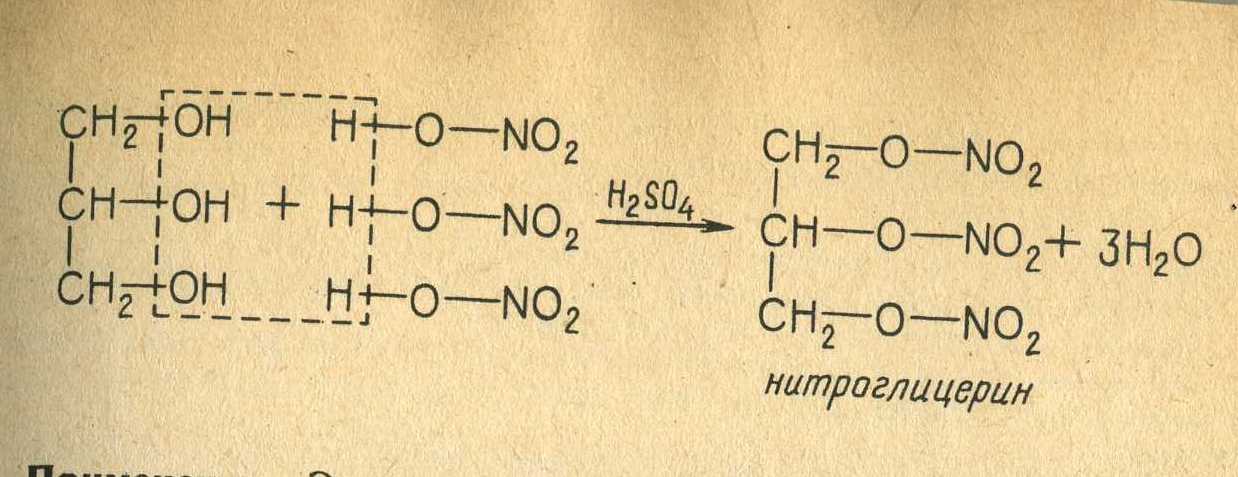
Глицерин (1,2,3-триоксипропан, пропантриол-1,2,3) — простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость. Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Поскольку глицерин хорошо поддается желированию, в отличие например от этанола, и как и этанол горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей.
Технический глицерин используется для заполнения виброустойчивых манометров типа ДМ8008ВУ, заполнения торцевых уплотнений мешалок и др.
Также глицерин используется при изготовлении динамита.

Вопрос 47
Фенол (гидроксибензол, устаревшее карболовая кислота) C6H5OH — простейший представитель классафенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом (таким, как запах гуаши, т. к. в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, вацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства.:
Обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия - C6H5ONa):C6H5OH + NaOH = C6H5ONa + H2O
· Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.

· Взаимодействие с металлическим натрием:
· Взаимодействие с бромной водой (качественная реакция на фенол):
C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6-трибромфенол
· Взаимодействие с концентрированной азотной кислотой:
· Взаимодействие с хлоридом железа(III) (качественная реакция на фенол):
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Фенол весьма ядовит. При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуютПопадая на кожу, фенол очень быстро всасывается даже через неповрежденные участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Фенол является канцерогенным химическим веществом и способен вызвать рак. Смертельная доза для человека при попадании внутрь 1-10 г, для детей 0,05-0,5 г. [5] В лагерях смерти фашистской германии применялся для преднамеренной, активной, недобровольной эвтаназии, как правило в виде инъекции в сердце.
53)

Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом . На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Основной способ получения анилина — восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350 °С на никелевом или медном катализаторе.
В лаборатории для этой цели используют цинк в кислой среде:
С6Н5NО2 + 3Zn + 7HCl → C6H5NH3Cl + 3ZnCl2 + 2Н2О
или алюминий в щелочной среде:
C6H5NO2 + 2Al + 2NaOH + 4Н2О → C6H5NH2 + 2Na[Al(OH)4].
60)

Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.
Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина):
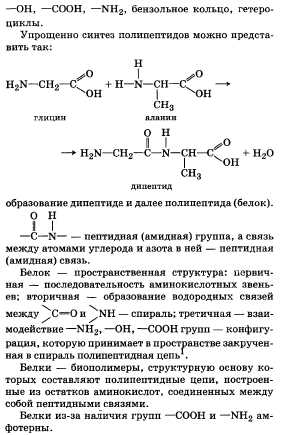
(OH)C6H4CH(NH2)COOH + HNO3 —-H2SO4——> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O — выпадает осадок желтого цвета.
(OH)C6H3(NO2)CH(NH2)COOH + 2NaOH ——-> (ONa)C6H3(NO2)CH(NH2)COONa + H2O — раствор становится оранжевым.

Реакции замещения. В этих реакциях замещение водорода легче происходит при третичном углеродном атоме, труднее — при вторичном и совсем плохо — при первичном.
1. Галогепирование (замещение галогеном) - важнейшая реакция алканов. Она протекает при освещении УФ-светом или в темноте при сильном нагревании, а также в присутствии катализаторов. Сравнительно легко алканы вступают в реакцию замещения с хлором и бромом, очень трудно — с иодом. С фтором реакция протекает со взрывом (поэтому обычно фтор разбавляют азотом или используют растворители). В результате замещения водорода галогеном образуются галогено-производные алканов. Например, хлорирование метана протекает с последовательным замещением в его молекуле всех атомов водорода на хлор:
Реакция галогенирования имеет цепной свободно-радикальный характер (Н.Н.Семенов). На первой стадии этого процесса под влиянием УФ-облучения (или высокой температуры) происходит распад молекулы хлора на два свободных радикала. Такой процесс называется инициированием:
Сl : Сl ® С1Ч + С1Ч
Затем начинается рост цепи. Свободный радикал взаимодействует с молекулой метана:
СН4 + С1Ч ® СН3Ч + НС1
Эта реакция обрывается, если исчезнут свободные радикалы. Поэтому обрыв цепи часто связан с взаимодействием свободных радикалов друг с другом:
С1Ч + С1Ч ® С1:С1
СН3Ч + С1Ч ® СН3:С1
2. Нитрование (замещение нитрогруппой NO2). Впервые эту реакцию открыл русский ученый М.И.Коновалов в 1888 г. (с тех пор она названа его именем). Алканы взаимодействуют с разбавленной азотной кислотой при нагревании, образуя нитропроизводные алканов:
В промышленности реакцию нитрования проводят, нагревая алканы с парами азотной кислоты при 250—500 °С и давлении (парофазное нитрование). Реакция нитрования, как и галогенирования, идет по цепному радикальному механизму. Нитрующим агентом является радикалоподобный оксид азота NO2, который, взаимодействуя с алканом, образует свободный радикал — алкил RЧ:
R—H + NO2Ч ® RЧ + HNO2
Взаимодействие этих радикалов приводит к образованию нитросоединений:
3. Сульфирование. Дымящая серная кислота (содержащая растворенный в ней SO3) с высшими алканами дает сульфокислоты. Например:
В результате таких реакций атом водорода в молекуле алкана замещается на сульфогруппу - SO3Н.
Соли сульфокислот (алкилсульфонаты) с C12-18 широко используются в качестве моющих средств. Эти соли можно получить и реакцией сульфохлорирования — действием на алканы смесью диоксида серы и хлора:
При взаимодействии сульфохлорида со щелочью образуется алкилсульфонат:
Алканы (также насыщенные алифатические углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулойCnH2n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp 3 -гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4).

Алканы называют также парафиновыми углеводородами или парафинами (от лат. parum affinis — не обладающие сродством). Это название отражает низкую химическую активность алканов при комнатной температуре. Причина невысокой реакционной способности кроется в специфике строения молекул парафиновых углеводородов.
В молекулах алканов орбитали всех атомов углерода находятся в состоянии sр3-гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в вершины равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109°28'.

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму. Молекулы имеют зигзагообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109°28'), например в молекуле н-пентана.
Все связи в молекулах алканов одинарные. Перекрывание происходит по линии, соединяющей ядра атомов, т. е. это σ-связи. Связи углерод—углерод являются неполярными и мало поляризуемыми. Длина С—С-связи в алканах равна 0,154 нм (1,54 • 10 - 10 м). Связи С—Н несколько короче. Электронная плотность лишь немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.

Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованиемхлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:




Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфохлорирование (реакция Рида)

При облучении УФ-излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Инициирование цепного процесса:

Развитие цепного процесса:



Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование (реакция Коновалова).
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:

Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:



Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:

Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:

· метанол:

· формальдегид:

· муравьиная кислота:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
Реакция окисления алканов диметилдиоксираном:

Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:

Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.


При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.

1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3, например, образование этилена из этана:

2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов, например, бутадиена-1,3 и бутадиена-1,2 из бутана:


3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:

В присутствии никелевого катализатора протекает реакция:

Реакции электрофильного замещения
Изомеризация:
Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
С марганцовокислым калием (KMnO4) и бромной водой (Br2) алканы не взаимодействуют.
Метан CH₄ относится к предельным углеводородам. Для предельных углеводородов характерна реакция замещения. Эта реакция идет по свободно радикальному механизму. Реакция с бромом Br₂ происходит на свету, в броме происходит разрыв связи Br··Br ⇒ 2Br· Образуется 2 атома брома с одним неспаренным электроном. Один атом брома отрывает атом водорода от метана, образуется бромистый водород и метил радикал. Дальше идет цепная реакция:
CH₄ + Br· ⇒ CH₃· + HBr
CH₃· + Br··Br ⇒ CH₃Br + Br·
CH₃Br + Br·⇒ CH₂Br· + HBr
CH₂Br· + Br··Br ⇒ CH₂Br₂ + Br·
CH₂Br₂ + Br· ⇒ CHBr₂· + HBr
CHBr₂ + Br··Br ⇒ CHBr₃ + Br·
CHBr₃ + Br· ⇒ CBr₃· + HBr
CBr₃· + Br··Br ⇒ CBr₄ + Br·
CBr₄ четырехбромистый углерод


ЧТО ТАКОЕ УВЕРЕННОЕ ПОВЕДЕНИЕ В МЕЖЛИЧНОСТНЫХ ОТНОШЕНИЯХ? Исторически существует три основных модели различий, существующих между.

Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор.


Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем.
Читайте также:

