Кислотно основные свойства веществ кратко
Обновлено: 05.07.2024
Оксидами называются сложные вещества, состоящие из двух элементов, одним из которых является кислород.
По числу атомов кислорода в молекуле оксиды иногда называют: PbO2 – диоксид свинца, SO3 – триоксид серы.
Особую группу составляют пероксиды, которые содержат пероксидную группу –О–О–: Н2О2 – пероксид водорода, Na2О2 - пероксид натрия.
Оксиды делятся на несолеобразующие и солеобразующие.
Несолеобразующие оксиды (безразличные или индифферентные) – это оксиды, которым в качестве гидроксидов не соответствуют ни основания, ни кислоты. Например: СО, NO, N2O.
Солеобразующие оксиды делятся на основные, кислотные и амфотерные. Солеобразующие оксиды обладают способностью образовывать соли.
Основные оксиды
Основными называются оксиды, которым в качестве гидроксидов соответствуют основания:
Основные оксиды обычно образованы типичными металлами со степенями окисления:
+2: CaO, BaO, SrO, MnO, FeO, MgO, NiO, TiO;
Способы получения основных оксидов:
- разложением оснований и солей при нагревании
- оксиды серебра и ртути получают разложением их гидроксидов в момент образования:
Химические свойства основных оксидов:
- взаимодействие с водой оксидов щелочных (Li, Na, K, Rb, Cs) и щелочноземельных металлов (Ca, Sr, Ba) с образованием щелочей:
- взаимодействие с кислотами
- взаимодействие с кислотными оксидами
Кислотные оксиды
Кислотными называются оксиды, которым в качестве гидроксидов соответствуют кислоты:
Кислотные оксиды – это оксиды неметаллов (P2O5, B2O3, Cl2O7) и некоторых металлов, проявляющих высокие степени окисления:
Способы получения кислотных оксидов:
- окислением неметаллов и сложных веществ:
- разложением кислот и солей:
Химические свойства кислотных оксидов:
- взаимодействие с водой
Некоторые кислотные оксиды с водой не взаимодействуют, например, SiO2;
- взаимодействие со щелочами
- взаимодействие с основными оксидами
Амфотерные оксиды
Амфотерными называются оксиды, которым в качестве гидроксидов соответствуют и основания, и кислоты, например
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в "строки и столбцы" - периоды и группы.
Период - ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 - называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов ("→" слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде "←" справа налево.
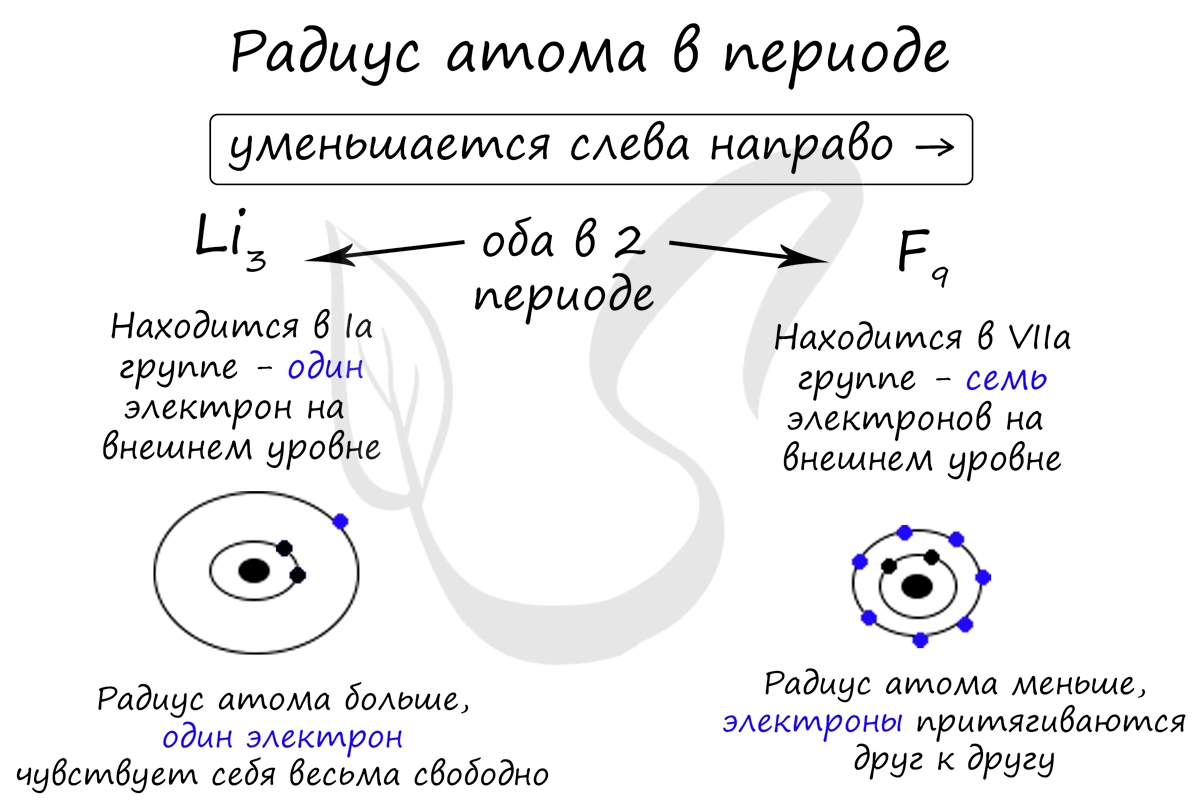
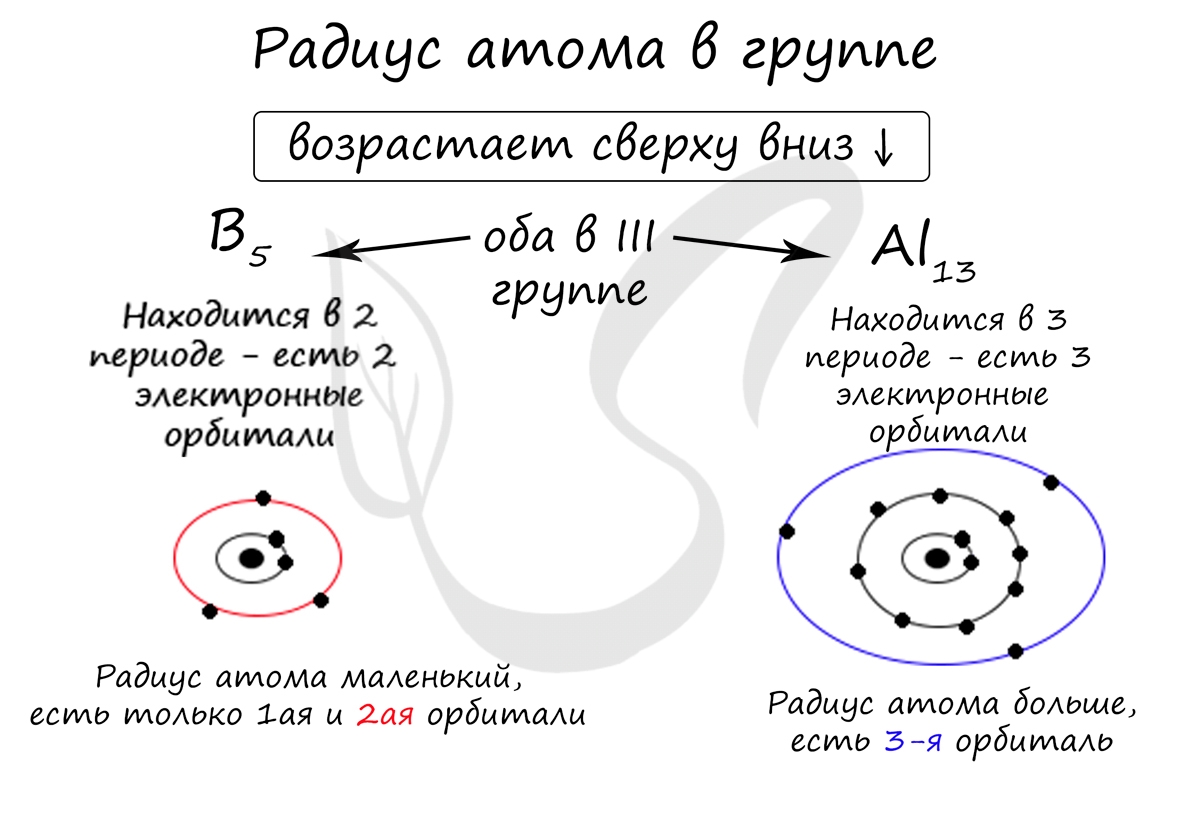
В группе радиус атома увеличивается с увеличением заряда атомных ядер - сверху вниз "↓". Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается - снизу вверх "↑". Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия - тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует - там нужно считать электроны "вручную", располагая их на электронных орбиталях.
- B5 - 1s 2 2s 2 2p 1
- Al13 - 1s 2 2s 2 2p 6 3s 2 3p 1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns 2 np 1 . Это будет работать для бора, внешний уровень которого 2s 2 2p 1 , алюминия - 3s 2 3p 1 , галия - 4s 2 4p 1 , индия - 5s 2 5p 1 и таллия - 6s 2 6p 1 . За "n" мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода - и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже :)

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных - только "вручную".
Длина связи
Длина связи - расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
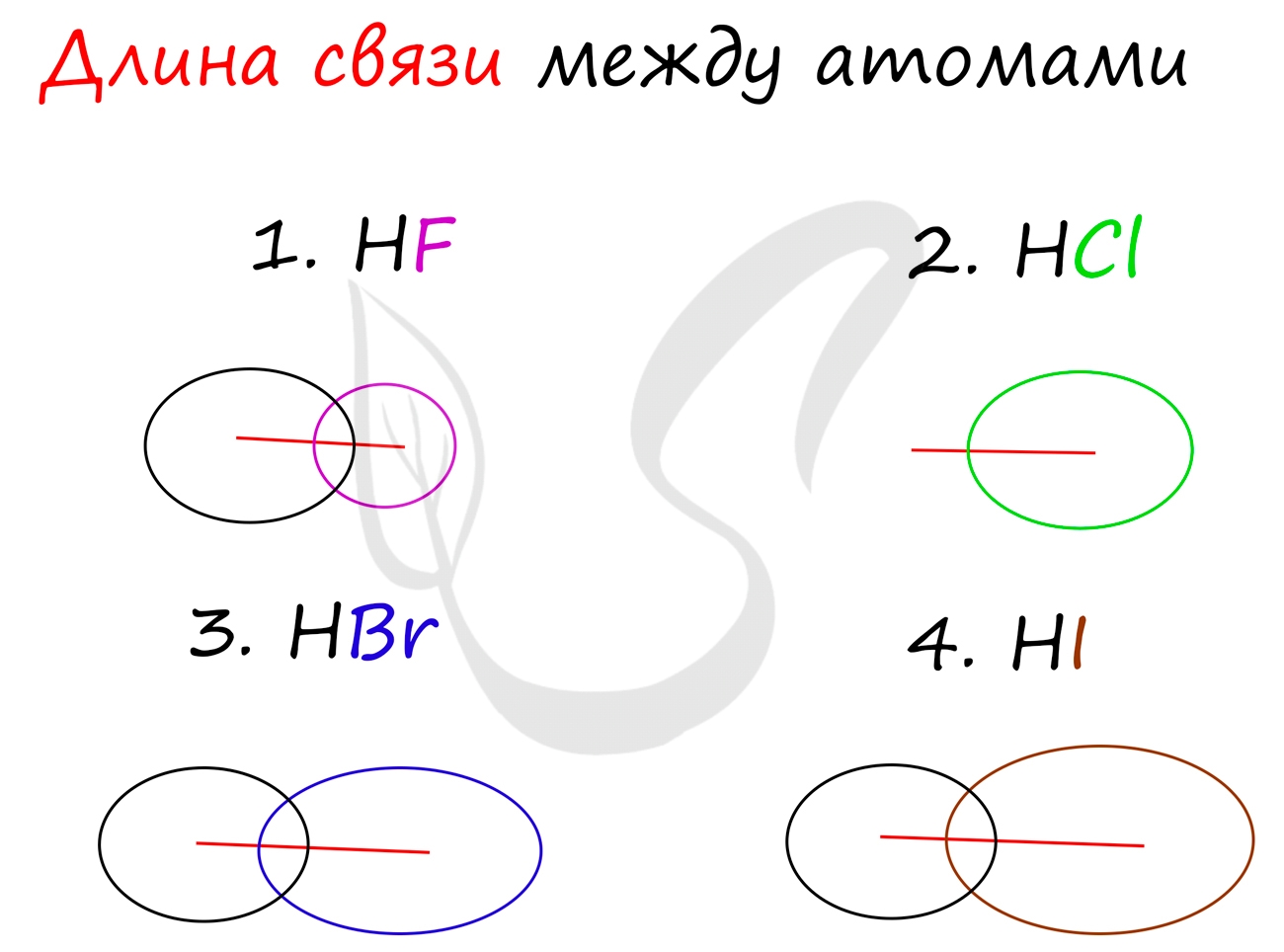
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические - усиливаются (слева направо "→"). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические - ослабевают (сверху вниз "↓").

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны - у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера - самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева - металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные - возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные - ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые - убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF - самая слабая из этих кислот, а HI - самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные - усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные - ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные - с неметаллическими и кислотными. Так гораздо проще запомнить ;-)

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность - способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус "-".
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева - это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости "синонимичны" также понятия сродства к электрону - энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации - количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы - R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми "высшими" оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в "-" отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы - 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
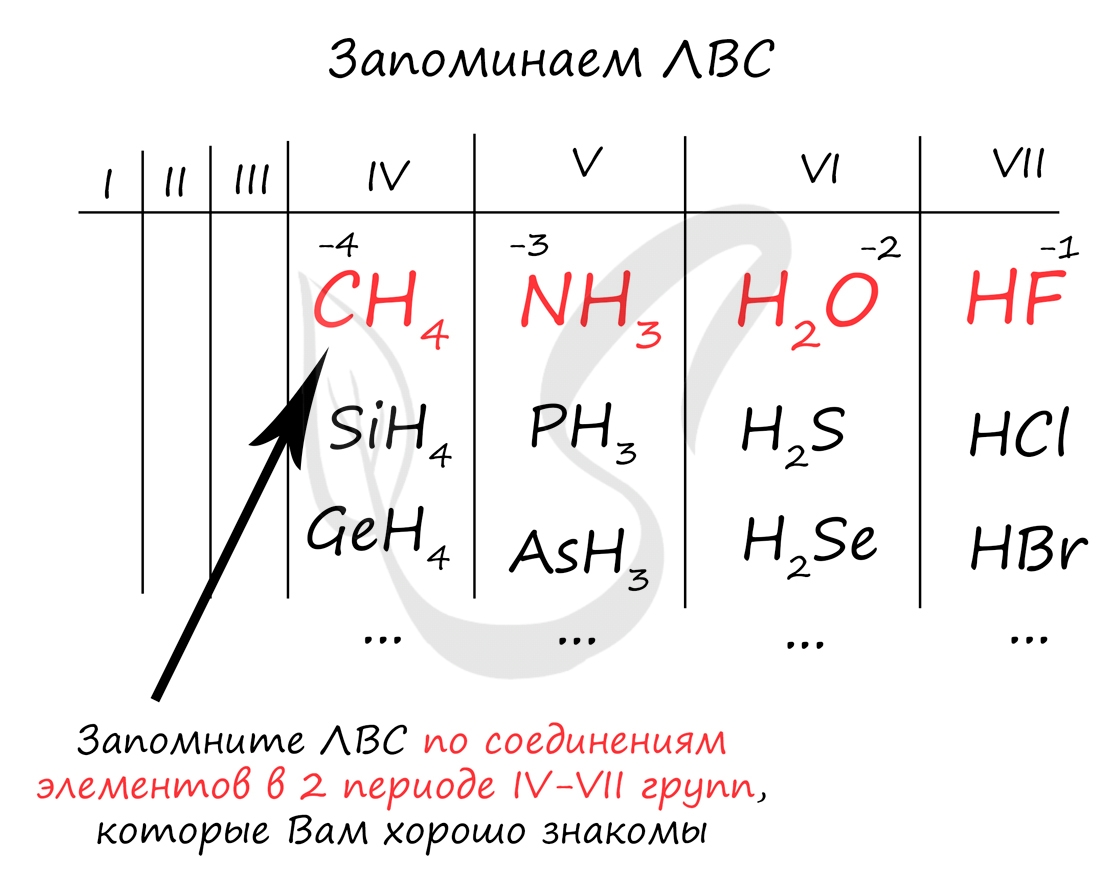
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы - H2S, H2Se, H2Te, H2Po.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Задание 1. Для реакции MgCO3(K) = MgO(K) + CO2(Г) определите возможное направление самопроизвольного течения реакции при стандартных условиях и при температуре t =627 0 C, если тепловой эффект до заданной температуры не изменится.
Укажите: а) выделяется или поглощается энергия в ходе реакции; б) причину найденного изменения энтропии. Рассчитайте температуру, при которой устанавливается равновесие и происходит смена знака DG.
Решение:
В приложении 3 находим стандартные значения DH o f и DS o для всех реагирующих веществ:
| Вещество | DНf 0 , кДж/моль | S 0 , Дж/моль×К |
| MgCO3 | -1096,21 | 65,69 |
| MgO | -601,24 | 26,94 |
| CO2 | -393,51 | 213,6 |
По следствию из закона Гесса вычисляем DH o r реакции:
DH o r = -601,24-393,51-(-1096,21) = 101,46 кДж
DH o r > 0 - значит реакция является эндотермической, т.е. идет с поглощением теплоты.
По следствию из закона Гесса вычисляем DS o реакции:
DS o r = 26,94+213,6-65,69 = 174,85 Дж/К
DS o > 0 – энтропия возрастает, т. к. в ходе реакции образуются газообразные вещества.
Вычисляем энергию Гиббса при стандартных условиях, т.е. при температуре 298 К:
DG o = DH o - TDS o = 101,46-298*0,17485 = 49,36 кДж.
DG o > 0, следовательно реакция при Т=298 К невозможна.
Вычисляем энергию Гиббса при температуре t =627 0 C
DG = DH o - TDS o = 101,46 - (627 + 273)*0,17485 = -55,91 кДж.
DG o 0 C протекание реакции возможно.
Температура, при которой наступает равновесие:

Задание 2. Вычислите тепловой эффект реакции 4FeS2(K) + 11O2(Г) = 2Fe2O3(K) + 8SO2(Г) пользуясь стандартными энтальпиями образования реагирующих веществ (приложение 3). Сколько теплоты выделится (поглотится) при образовании вещества SO2 в количестве 89,6 л.?
Решение:
В приложении 3 находим стандартные значения DH o f для всех реагирующих веществ:
n, моль 4 11 2 8
| Вещество | DНf 0 , кДж/моль |
| FeS2 (к) | -174,0 |
| O2 (г) | 0 |
| Fe2O3 (к) | -821,32 |
| SO2 (г) | -296,9 |
По второму следствию из закона Гесса рассчитываем тепловой эффект реакции образования 2 моль Cr:
DH o f = 3321.84*4/8 = 1660.92 кДж
Тема 4.
Химическая кинетика и химическое равновесие

Задание 1. Определите, как изменится скорость реакции 2СО(г) + О2(г) = 2СО2(г), когда прореагирует 40 % кислорода, если начальные концентрации реагирующих веществ равны, моль/л: С о (СO)=0,8, =0,6.
Решение:
Запишем выражение закона действия масс для данной реакции:

.
1. Найдем скорость реакции в начальный момент времени

.
2. Найдем количество прореагировавшего кислорода

.
3. Найдем текущую концентрацию кислорода, т.е. в момент, когда прореагирует 40% О2

.
4. Найдем количество прореагировавшего CO. В соответствии со стехиометрией реакции

5. Найдем текущую концентрацию CO
6. Найдем текущую скорость реакции
n = k • 0.32 2 • 0.36 = 0,036864k.
7. Найдем, во сколько раз уменьшится скорость реакции, когда прореагирует 40% кислорода

Задание 2. Для обратимой реакции N2O4(г) = 2NO2(г) запишите выражение константы равновесия ΔН°, кДж = + 57. Предложите способы увеличения концентрации продуктов реакции
Решение:
Запишем уравнение для константы равновесия:

.
а) увеличением температуры, так как тепловой эффект реакции ∆H>0, т.е. реакция эндотермическая;
б) уменьшением давления, т.к. мольное количество газов в процессе реакции увеличивается
в) увеличением концентрации N2O4, а также снижением концентрации NO2.

Тема 5. Растворы
Задание 1. Вычислите молярную, нормальную концентрации и титр 10%-го раствора сульфата магния. Плотность раствора 1,103 г/мл.
Решение:
В 100 г раствора содержится 10 г соли, рассчитаем массу раствора:
Молярная концентрация раствора:

Так как эквивалент MgSO4 ½ , то нормальная концентрация:
Т=m/V=10/90.7 = 0.1103 г/мл
Задание 2. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между следующими веществами:
сульфатом меди (II) и соляной кислотой;
гидроксидом алюминия и гидроксидом калия;
сульфатом магния и карбонатом калия;
ацетатом свинца (II) и серной кислотой;
Задание . Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения
Решение:
Тема 3.
Химическая термодинамика
Задание 1. Для реакции MgCO3(K) = MgO(K) + CO2(Г) определите возможное направление самопроизвольного течения реакции при стандартных условиях и при температуре t =627 0 C, если тепловой эффект до заданной температуры не изменится.
Укажите: а) выделяется или поглощается энергия в ходе реакции; б) причину найденного изменения энтропии. Рассчитайте температуру, при которой устанавливается равновесие и происходит смена знака DG.
Решение:
В приложении 3 находим стандартные значения DH o f и DS o для всех реагирующих веществ:
| Вещество | DНf 0 , кДж/моль | S 0 , Дж/моль×К |
| MgCO3 | -1096,21 | 65,69 |
| MgO | -601,24 | 26,94 |
| CO2 | -393,51 | 213,6 |
По следствию из закона Гесса вычисляем DH o r реакции:
DH o r = -601,24-393,51-(-1096,21) = 101,46 кДж
DH o r > 0 - значит реакция является эндотермической, т.е. идет с поглощением теплоты.
По следствию из закона Гесса вычисляем DS o реакции:
DS o r = 26,94+213,6-65,69 = 174,85 Дж/К
DS o > 0 – энтропия возрастает, т. к. в ходе реакции образуются газообразные вещества.
Вычисляем энергию Гиббса при стандартных условиях, т.е. при температуре 298 К:
DG o = DH o - TDS o = 101,46-298*0,17485 = 49,36 кДж.
DG o > 0, следовательно реакция при Т=298 К невозможна.
Вычисляем энергию Гиббса при температуре t =627 0 C
DG = DH o - TDS o = 101,46 - (627 + 273)*0,17485 = -55,91 кДж.
DG o 0 C протекание реакции возможно.
Температура, при которой наступает равновесие:

Задание 2. Вычислите тепловой эффект реакции 4FeS2(K) + 11O2(Г) = 2Fe2O3(K) + 8SO2(Г) пользуясь стандартными энтальпиями образования реагирующих веществ (приложение 3). Сколько теплоты выделится (поглотится) при образовании вещества SO2 в количестве 89,6 л.?
Решение:
В приложении 3 находим стандартные значения DH o f для всех реагирующих веществ:
n, моль 4 11 2 8
| Вещество | DНf 0 , кДж/моль |
| FeS2 (к) | -174,0 |
| O2 (г) | 0 |
| Fe2O3 (к) | -821,32 |
| SO2 (г) | -296,9 |
По второму следствию из закона Гесса рассчитываем тепловой эффект реакции образования 2 моль Cr:
DH o f o f = 3321.84*4/8 = 1660.92 кДж
Тема 4.
Химическая кинетика и химическое равновесие

Задание 1. Определите, как изменится скорость реакции 2СО(г) + О2(г) = 2СО2(г), когда прореагирует 40 % кислорода, если начальные концентрации реагирующих веществ равны, моль/л: С о (СO)=0,8, =0,6.
Решение:
Запишем выражение закона действия масс для данной реакции:

.
1. Найдем скорость реакции в начальный момент времени

.
2. Найдем количество прореагировавшего кислорода

.
3. Найдем текущую концентрацию кислорода, т.е. в момент, когда прореагирует 40% О2

.
4. Найдем количество прореагировавшего CO. В соответствии со стехиометрией реакции

5. Найдем текущую концентрацию CO
6. Найдем текущую скорость реакции
n = k • 0.32 2 • 0.36 = 0,036864k.
7. Найдем, во сколько раз уменьшится скорость реакции, когда прореагирует 40% кислорода

Задание 2. Для обратимой реакции N2O4(г) = 2NO2(г) запишите выражение константы равновесия ΔН°, кДж = + 57. Предложите способы увеличения концентрации продуктов реакции
Решение:
Запишем уравнение для константы равновесия:

.
а) увеличением температуры, так как тепловой эффект реакции ∆H>0, т.е. реакция эндотермическая;
б) уменьшением давления, т.к. мольное количество газов в процессе реакции увеличивается
в) увеличением концентрации N2O4, а также снижением концентрации NO2.
Тема 5. Растворы
Задание 1. Вычислите молярную, нормальную концентрации и титр 10%-го раствора сульфата магния. Плотность раствора 1,103 г/мл.
Решение:
В 100 г раствора содержится 10 г соли, рассчитаем массу раствора:
Молярная концентрация раствора:

Так как эквивалент MgSO4 ½ , то нормальная концентрация:
Т=m/V=10/90.7 = 0.1103 г/мл
Задание 2. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между следующими веществами:
Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель.
Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением
Перемножив константы сопряженных кислот и оснований, получим
Заменив активности и на равновесные концентрации, получим
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным Kk(Kосн) можно легко найти значения сопряженных KВ.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары :NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
K1 : K2 : K3 = 1 : 10–5 : 10–10.
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
и для этой реакции
Прибавление к раствору уксусной кислоты ее соли (CH3COONa → CH3COO– + Na+) резко увеличивает концентрацию ионов CH3COO– и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [CH3COOH] = [кислота], и [CH3COO–] = [соль] концентрация H+ равна
Следовательно, концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Рассуждая аналогичным образом, можно вывести уравнения для раствора слабого основания и его соли (NH4OH и NH4Cl):
Из предыдущих уравнений видно, что концентрация ионов водорода при разбавлении сохраняется, ибо отношения [кислота]:[соль], [соль]:[основание] остаются постоянными. Добавление к такой смеси кислоты или щелочи приводит к связыванию избыточных ионов H+ анионами, а OH– – катионами. Это смещает равновесие диссоциации слабого электролита, в результате чего концентрация H+ практически не меняется. Растворы, содержащие смесь слабого электролита и его соли, сохраняющие характерные для него значения pH при разбавлении, добавлении сильных кислот или щелочей, называются буферными
Если к одному литру ацетатного буфера, содержащего по 0,1 моля уксусной кислоты (K = 1,86 · 10–5) и ее соли, имеющего [H+] = 1,86 ∙ 10–5, pH 4,73, добавить 10 мл HCl (0,01 моля), то в результате реакции
концентрация кислоты увеличится, а соли уменьшится на 0,01 моля; тогда
Добавление такого же количества щелочи приведет к увеличению [CH3COO–]:
Следовательно, и в том, и в другом случае pH буферного раствора изменится на 0,09. Легко подсчитать, что добавление к 1 л воды 0,01 моля HCl или NaOH изменит pH на 5 единиц. Действительно, если в воде pH равно 7, то концентрация [H+]HCl с CM(HCl) = 0,01 моль∙л–1, то есть pH = 2; в NaOH с CM(HCl) = 0,01 моль∙л–1 pOH = 2, pH = 12.
Буферная емкость определяется количеством эквивалентов сильной кислоты или основания, которые необходимо добавить к 1 л буферного раствора, чтобы изменить его pH на единицу.
Очевидно, чем более концентрированный буферный раствор, тем больше его буферная емкость.
Читайте также:
- Дистанционные мероприятия ко дню матери в школе
- Фотоэффект и его законы уравнение эйнштейна для фотоэффекта применение фотоэффекта в технике кратко
- Адаптация в 1 младшей группе детского сада
- Приведите 3 4 примера ориентиров расположенных около здания вашей школы
- Научные основы содержания образования в начальной школе

