Какова роль растворителя в процессе электролитической диссоциации кратко
Обновлено: 05.07.2024
Электролитическая диссоциация
Электролит и ческая диссоци а ция, распад вещества на ионы при растворении. Электролитическая диссоциация происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер (см. Сольватация). Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 80-х гг. 19 в. Она основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации а, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается действующих масс законом. Например, электролитическая диссоциация бинарного электролита КА выражается уравнением типа КА Û К + + А - . Константа диссоциации Кд определяется активностями катионов аК+, анионов аА- и недиссоциированных молекул аКА следующим образом:
Значение Кд зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации ее может быть рассчитана при любой концентрации a электролита с помощью соотношения:
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Лит.: Измайлов Н. А., Электрохимия растворов, 3 изд., М.,1976; Monk C. В., Electrclytic dissociation, L. — N. Y., 1961.
От природы растворителя, концентрации раствора и температуры зависит степень электролитической диссоциации . При разбавлении раствора она увеличивается, так как увеличивается число молекул воды, приходящееся на молекулу электролита; происходит более интенсивный распад молекул электролита на ионы. Повышение температуры раствора увеличивает энергию полярных молекул воды, вызывающих распад молекул электролита на ионы. Оба эти фактора вызывают увеличение концентрации ионов электролита в растворе. Чем более полярен растворитель, тем лучше диссоциирует в нем данный электролит, и тем больше степень диссоциации последнего.
Растворы состоят из растворителя и одного (или более) растворенных веществ. Наиболее распространенными являются водные растворы (растворитель вода). В неводных растворах, которые в последнее время находят все большее применение, могут быть использованы другие растворители (бензол, спирт, жидкий аммиак и т.д.).
Растворенное вещество в растворах находится в виде изолированных молекул или ионов. В процессе образования раствора большую роль играет взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя, т.е. сольватация (гидратация, если растворителем является вода). Энергетический эффект, наблюдаемый при растворении 1 моля вещества, называется энтальпией растворения (кДж/моль). Процесс растворения может быть экзотермическим (например, КОН) или эндотермическим (например, КNO3). Сольватация (гидратация) играет решающую роль и в процессах электролитической диссоциации молекул растворенного вещества на ионы.
В соответствии с теорией электролитической диссоциации в растворах некоторых веществ происходит обратимый распад молекул на ионы. Поэтому в растворах таких веществ одновременно присутствуют молекулы и ионы. Количественно способность молекул вещества к электролитической диссоциации описывается степенью электролитической диссоциации a (a % = a × 100 %) и константой электролитической диссоциации Kдис., т.е. константой равновесия, записанной для обратимого процесса электролитической диссоциации. Способность к электролитической диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, концентрации раствора и наличия в растворе одноименных ионов. Закон разбавления (разведения) Оствальда устанавливает взаимосвязь между a, Kдис и молярной концентрацией растворенного вещества в растворе СМ
По величине степени диссоциации a электролиты условно делят на слабые (a 30 %) и средней силы (a = 3-30 %).
| Классы | Электролиты | ||
| сильные | слабые | средние | |
| Кислоты | HCl, HNO3, HI, H2SO4 | HF, HCN, CH3COOH, H2S, H2CO3, H2SO3 | H3PO4 |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2, | Zn(OH)2, Al(OH)3 | - |
| Соли | большинство | - | - |
В растворах сильных электролитов (особенно при малых концентрациях См -16 ). Произведение [Н + ] × [ОН - ] = 10 -14 при t = 22 o C постоянно для чистой воды и водных растворов различных веществ. Возможность и скорость протекания реакций в водных растворах в большей степени зависит от концентрации [Н + ], поэтому эта величина имеет большое значение. Для удобства используют не величину [Н + ], а водородный показатель рН = -lg[Н + ].
Растворы состоят из растворителя и одного (или более) растворенных веществ. Наиболее распространенными являются водные растворы (растворитель вода). В неводных растворах, которые в последнее время находят все большее применение, могут быть использованы другие растворители (бензол, спирт, жидкий аммиак и т.д.).
Растворенное вещество в растворах находится в виде изолированных молекул или ионов. В процессе образования раствора большую роль играет взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя, т.е. сольватация (гидратация, если растворителем является вода). Энергетический эффект, наблюдаемый при растворении 1 моля вещества, называется энтальпией растворения (кДж/моль). Процесс растворения может быть экзотермическим (например, КОН) или эндотермическим (например, КNO3). Сольватация (гидратация) играет решающую роль и в процессах электролитической диссоциации молекул растворенного вещества на ионы.
В соответствии с теорией электролитической диссоциации в растворах некоторых веществ происходит обратимый распад молекул на ионы. Поэтому в растворах таких веществ одновременно присутствуют молекулы и ионы. Количественно способность молекул вещества к электролитической диссоциации описывается степенью электролитической диссоциации a (a % = a × 100 %) и константой электролитической диссоциации Kдис., т.е. константой равновесия, записанной для обратимого процесса электролитической диссоциации. Способность к электролитической диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, концентрации раствора и наличия в растворе одноименных ионов. Закон разбавления (разведения) Оствальда устанавливает взаимосвязь между a, Kдис и молярной концентрацией растворенного вещества в растворе СМ

По величине степени диссоциации a электролиты условно делят на слабые (a 30 %) и средней силы (a = 3-30 %).
| Классы | Электролиты | ||
| сильные | слабые | средние | |
| Кислоты | HCl, HNO3, HI, H2SO4 | HF, HCN, CH3COOH, H2S, H2CO3, H2SO3 | H3PO4 |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2, | Zn(OH)2, Al(OH)3 | - |
| Соли | большинство | - | - |
В растворах сильных электролитов (особенно при малых концентрациях См -16 ). Произведение [Н + ] × [ОН - ] = 10 -14 при t = 22 o C постоянно для чистой воды и водных растворов различных веществ. Возможность и скорость протекания реакций в водных растворах в большей степени зависит от концентрации [Н + ], поэтому эта величина имеет большое значение. Для удобства используют не величину [Н + ], а водородный показатель рН = -lg[Н + ].
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A - (анион)
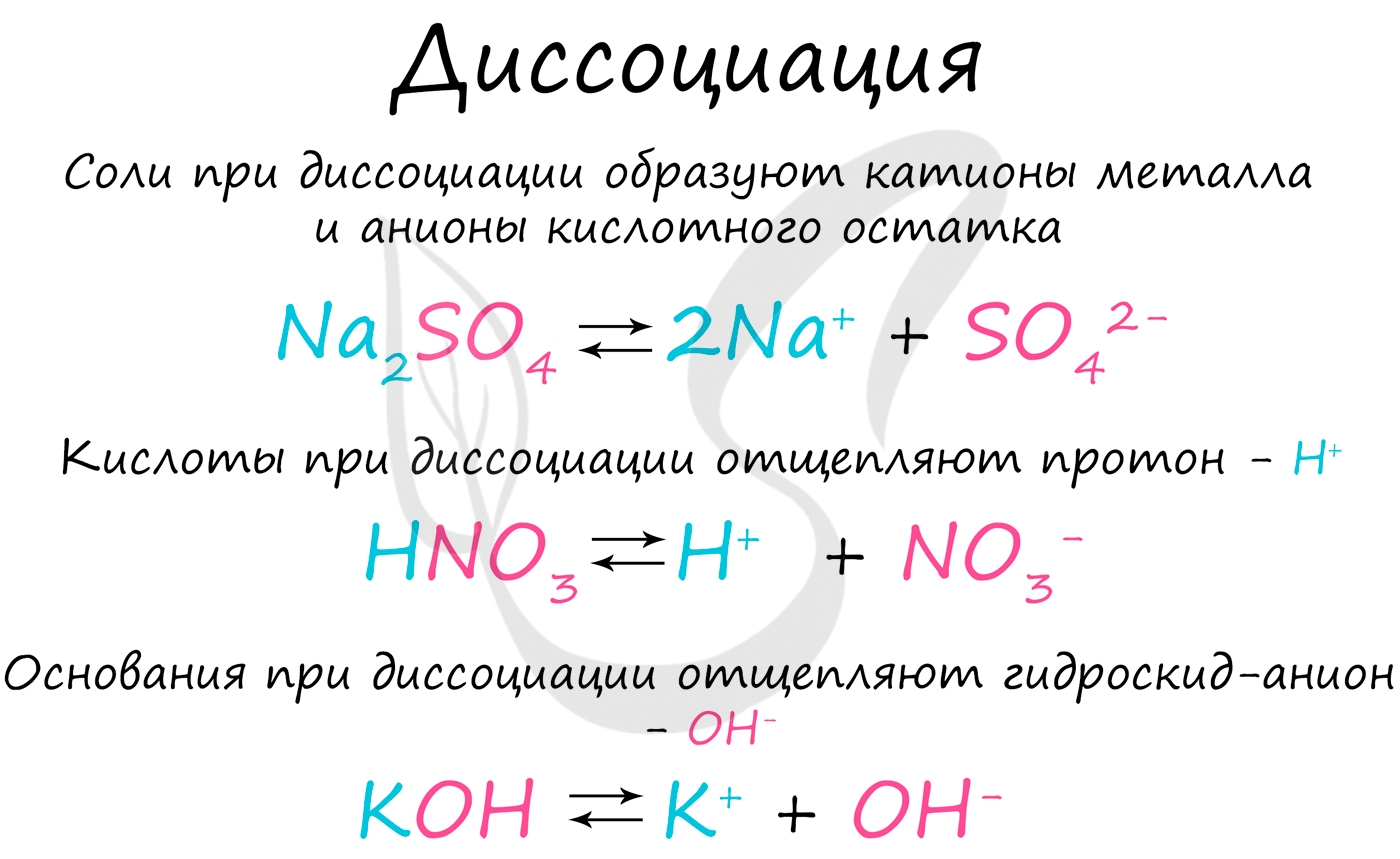
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
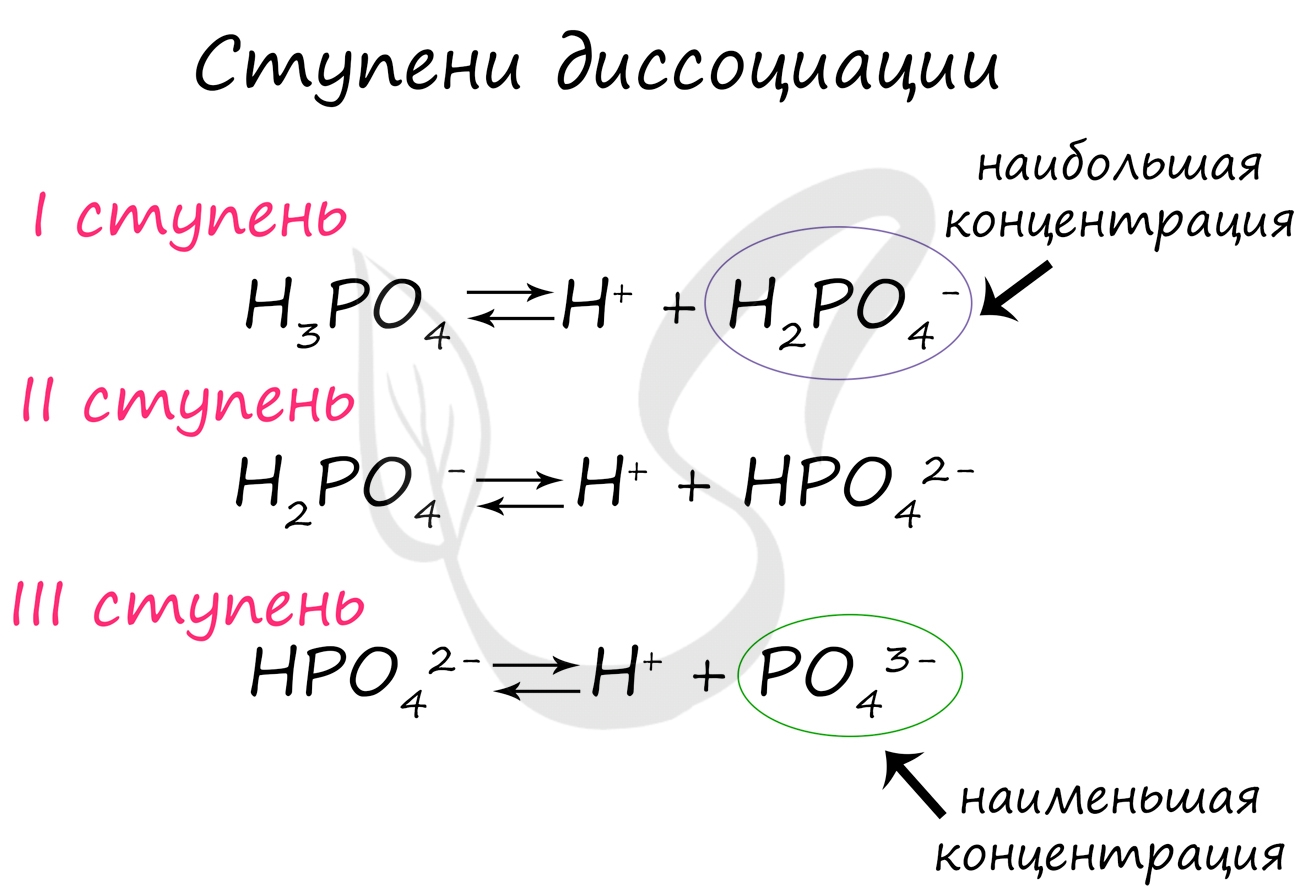
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
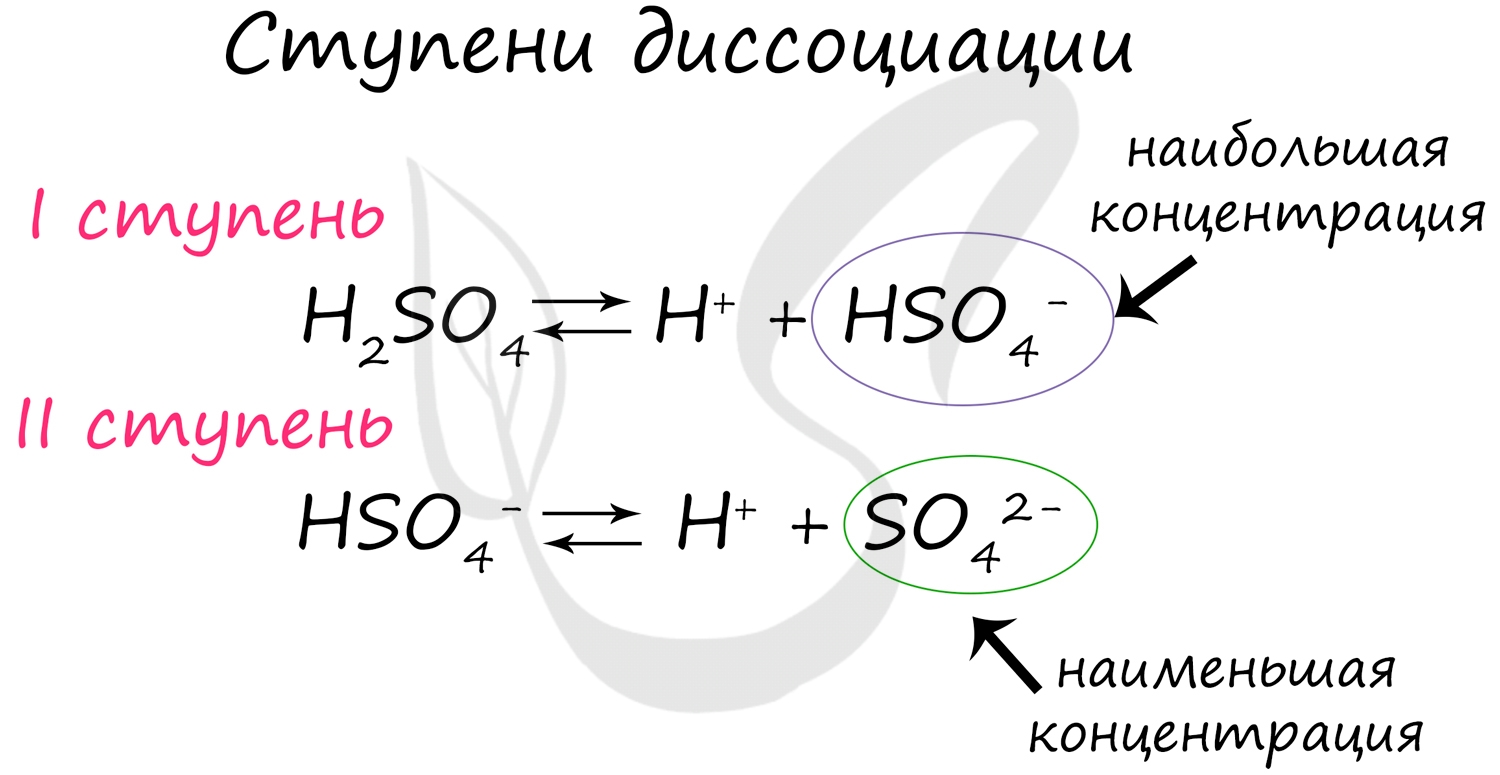
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

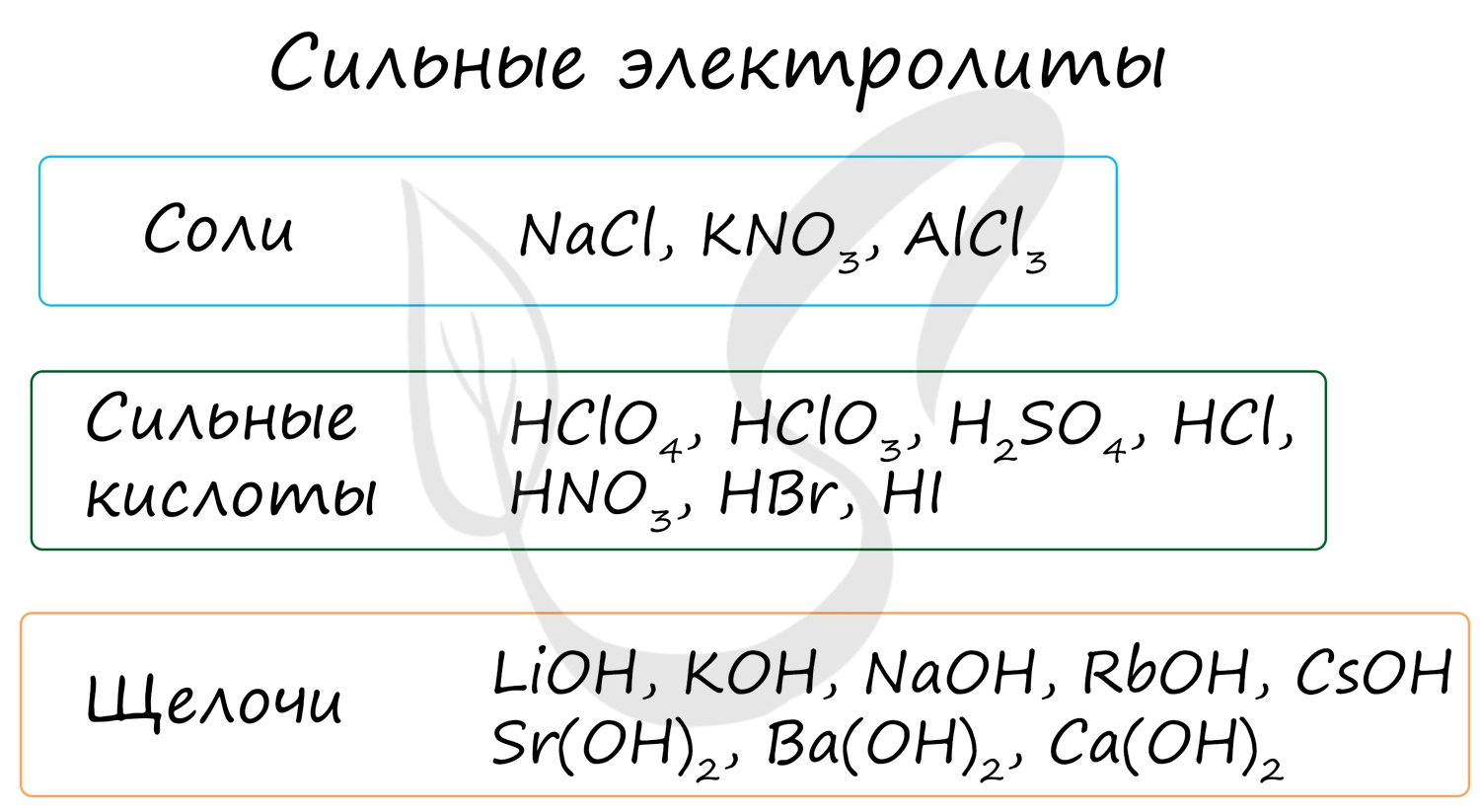
Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты - вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
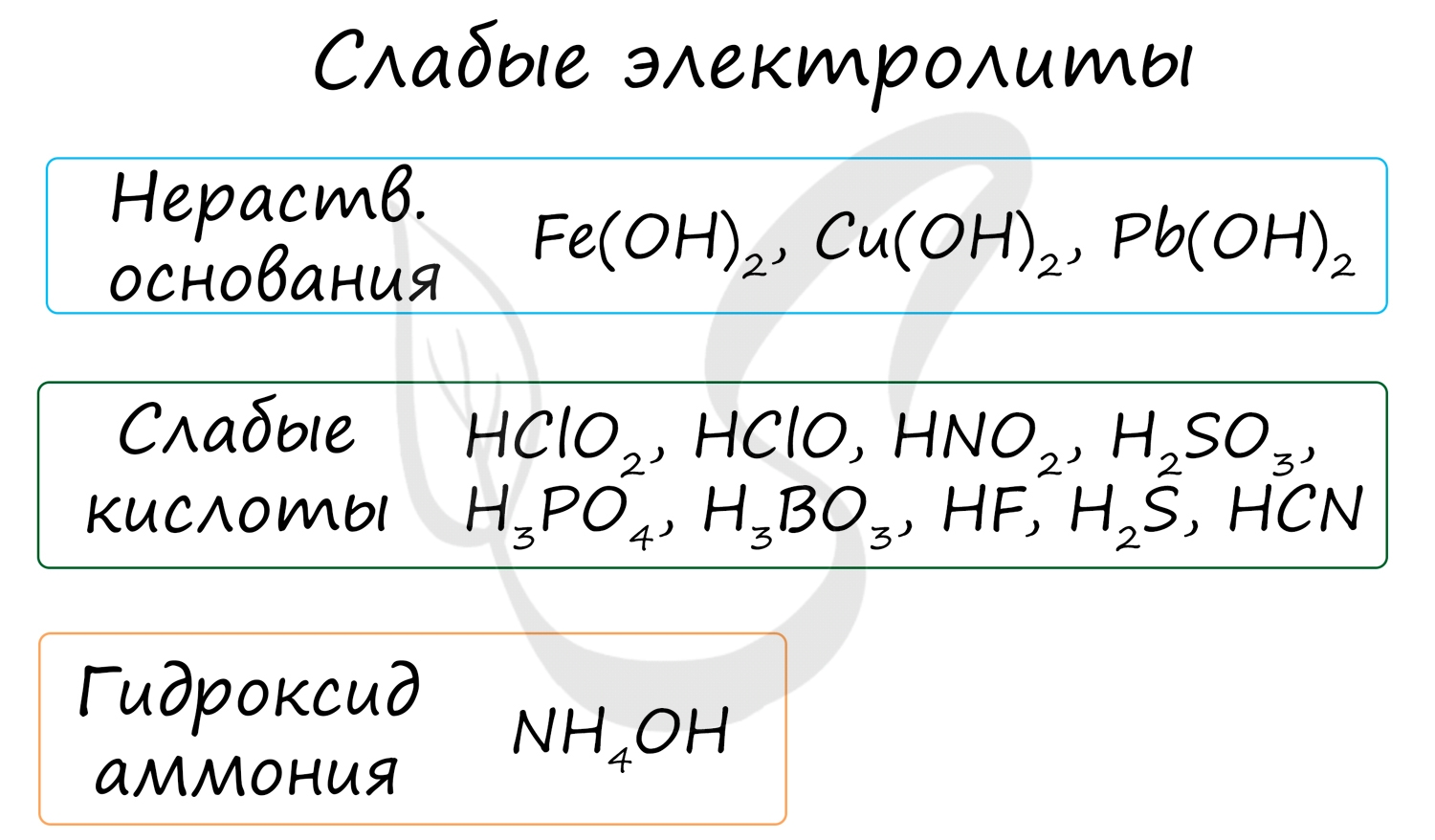
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
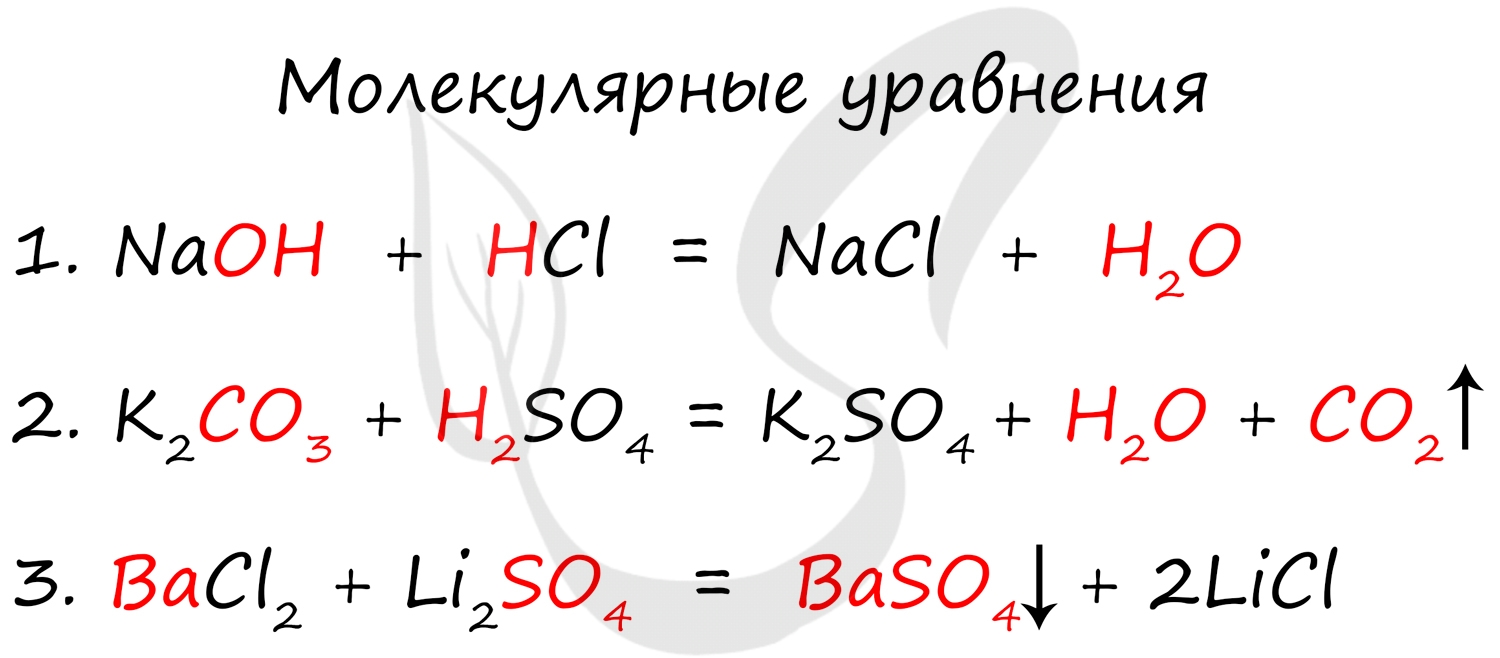
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике - остается только то, что сократить нельзя.
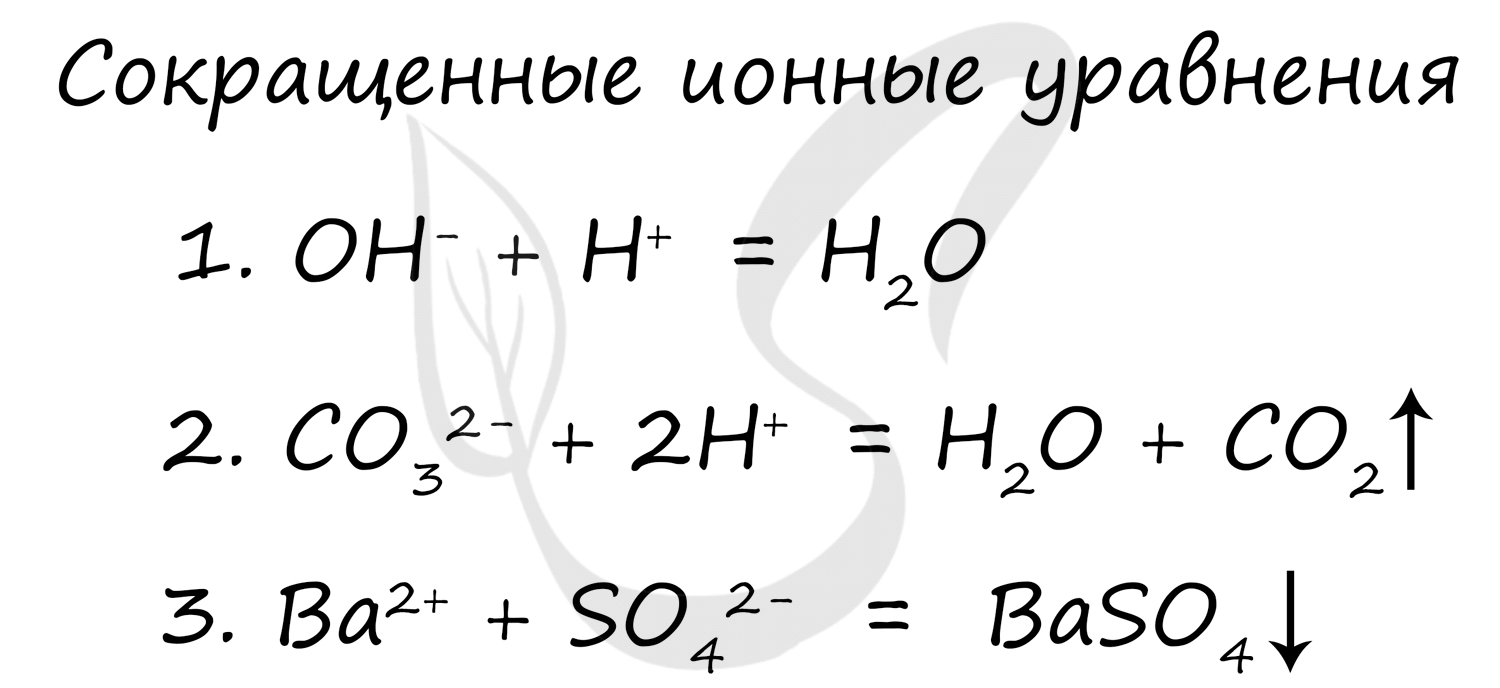
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

