Инозитолфосфатная система биохимия кратко
Обновлено: 29.06.2024
Функционирование инозитолфосфатной системы трансмембранной передачи сигнала (рис. 5-42) обеспечивают: R (рецептор), фосфолипаза С, Gрlс — белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля.
Рис. 5-42. Инозитолфосфатная система
- связывание сигнальной молекулы, например гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Срlс-белку.
- образование комплекса [Г][Н][Срlс-ГДФ] приводит к снижению сродства α-протомера Срlс-белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ.
- это вызывает диссоциацию комплекса; отделившаяся a-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С.
- α-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфолипазы-С происходит гидролиз липида мембраны фосфатидилинозигол-4,5-бисфосфата(ФИФ2).
- в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС).
- инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са 2+ -канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала — Са 2+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
Участие белка кальмодулина в инозитолфосфатной передаче сигнала
В клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са 2+ , он имеет 4 центра для связывания Са 2+ . Комплекс [кальмодулин] -[4 Са 2+ ] не обладает ферментативной активностью, но взаимодействие комплекса с различными белками и ферментами приводит к их активации.
Саморегуляция системы
Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАГ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилировани-ем протеинкиназой С.
Концентрация Са 2+ в клетке снижается до исходного уровня при действии Са 2+ -АТФ-аз цитоплазматической мембраны и ЭР, а также Na + /Ca 2+ -и Н + /Са 2+ -транслоказ (активный антипорт) клеточной и митохондриальной мембран.
- комплексом [кальмодулин] [4 Са 2+ ];
- протеинкиназой А (фосфорилированием);
- протеинкиназой С (фосфорилированием).
Понижение концентрации Са 2+ в клетке и диацил глицерола в мембране приводит к изменению конформации протеинкиназы С, снижению её сродства к фосфатидилсерину, фермент диссоциирует в цитозоль (неактивная форма).
Фосфорилированные протеинкиназой С ферменты и белки под действием фосфопротеин-фосфатазы переходят в дефосфорилированную форму.
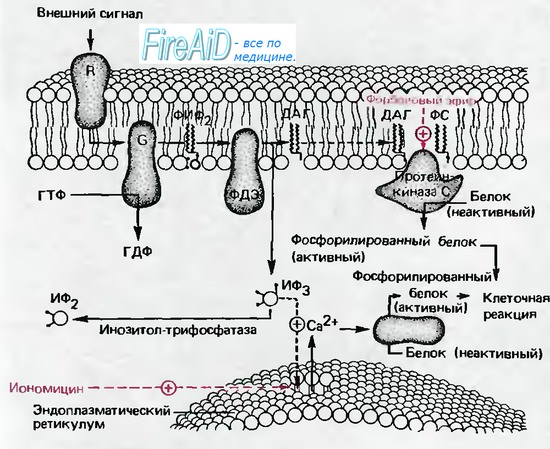
Рис. 1.16. Цепь реакций с участием внутриклеточного посредника ИФ3 (инозитолтрифосфата). Как и в системе цАМФ, внеклеточный сигнал опосредован через белок G, который в данном случае активирует фосфодиэстеразу (ФДЭ). Этот фермент расщепляет фосфати-дилинозиндифосфат (ФИФ2) в плазматической мембране до ИФ3 и диацилглицерола (ДАГ); ИФ3 диффундирует в цитоплазму. Здесь он вызывает выброс кальция (Ca) из зндоплазматического ретикулума; повышение концентрации кальция (Ca) в цитоплазме (кальция (Ca),) активирует протеин-киназу, которая фосфорилирует и, следовательно, активирует ферменты. Другой продукт, ДАГ, остается в мембране и активирует протеинкиназу С (кофактор-фосфатидилсерин, ФС). Протеинкиназа С также фосфорилирует ферменты, опосредующие специфическое действие, связанное со стимуляцией внешнего рецептора R. Ветви цепи реакций с участием ИФ3 и ДАГ могут быть активированы независимо иономицином и форбо-ловым эфиром соответственно (по [8, 9] с изменениями)
Внутриклеточная система второго посредника- инозитолфосфата - была открыта лишь недавно (рис. 1.16). В данном случае ингибиторный путь отсутствует, однако имеется сходство с системой цАМФ, в которой эффект стимуляции рецептора R переносится на ГТФ-активируемый G-белок на внутренней поверхности мембраны. На следующем этапе обычный мембранный липид фосфатидилинозитол (ФИ), предварительно получив две дополнительные фосфатные группы, превращается в ФИ-дифосфат (ФИФ2), который расщепляется активированной фосфодиэстеразой (ФДЭ) на инозитолтрифосфат (ИФ3) и липид диацилглицерол (ДАГ).
Инозитолтрифосфат - это водорастворимый второй посредник, диффундирующий в цитозоль. Он действует в первую очередь путем высвобождения кальция ( Ca ) из эндоплазматического рети-кулума. кальция ( Ca ) в свою очередь действует в качестве посредника, как было описано выше; например, он активирует кальция ( Ca ) -зависимую фосфокиназу, фосфо-рилирующую ферменты. Липидная субъединица ДАГ (рис. 1.16) также переносит сигнал, диффундируя в липидной фазе плазматической мембраны к расположенной на ее внутренней поверхности С-киназе, которая и активируется с участием фосфа-тидилсерина в качестве кофактора. Затем С-киназа запускает фосфорилирование белков, переводя их в активную форму.
Внутриклеточная система второго посредника ИФ3 также может управляться множеством внешних медиаторов и гормонов, в том числе ацетилхо-лином, серотонином, вазопрессином и тиреотроп-ным гормоном; как и система цАМФ, она характеризуется разнообразными внутриклеточными эффектами. Возможно, эта система активируется и светом в зрительном рецепторе глаза, и играет центральную роль в фототрансдукции. Впервые в индивидуальном развитии организма рецептор системы ИФ3 активируется спермием, вследствие чего ИФ3 принимает участие в регуляторных реакциях, сопровождающих оплодотворение яйцеклетки.
Системы цАМФ и ИФ3-ДАГ являются высокоэффективными биологическими усилителями. Они преобразуют реакцию между медиатором и наружным мембранным рецептором в фосфорилирование множества внутриклеточных белков, которые затем могут влиять на различные функции клетки. Один из существенных аспектов проблемы состоит в том, что, насколько известно на сегодняшний день, существуют только эти две тесно связанные регуля-торные системы такого типа, используемые многочисленными внешними посредниками для регуляции разнообразных внутриклеточных процессов. Вместе с тем, эти регуляторные системы, в том числе и кальция ( Ca ) , тесно взаимодействуют друг с другом, что позволяет им осуществлять тонкую регуляцию клеточных функций.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Кроме аденилат-циклазной или гуанилатциклазной систем существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция и инозитолтрифосфата.
Инозитолтрифосфат -это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы “С”, который активируется в результате конформационных изменений мембранного белка-рецептора. Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.

Образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона.
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок, состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са +2 . Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са +2 происходят конформационные изменения молекулы кальмодулина и комплекс “Са +2 -кальмодулин” становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са +2 ,Мg +2 -АТФазу и различные протеинкиназы.
В разных клетках при воздействии комплекса “Са +2 -кальмодулин” на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са +2 -кальмодулин будет отличаться.
Механизмы передачи информации от гормонов внутри клеток-мишеней с помощью перечисленных посредников имеют общие черты:
1. одним из этапов передачи сигнала является фосфорилирование белков
2. прекращение активации происходит в результате специальных механизмов, инициируемых самими участниками процессов, - существуют механизмы отрицательной обратной связи.
Внутриклеточный механизм.
Отсюда следует, что биологическое действие гормона зависит не только от его содержания в крови, и от количества и функционального состояния рецепторов, но и от уровня функционирования пострецепторного механизма.
По этому механизму, который получил название кальций-фосфолипидный механизм , действуют вазопрессин (через V1-рецепторы), адреналин (через α1-адренорецепторы), ангиотензин II.
Принцип работы этого механизма совпадает с аденилатциклазным, но мишеневым ферментом для α-субъединицы G-белка служит фосфолипаза С (ФЛ С). Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитолдифосфат (ФИФ2) до вторичных мессенджеров инозитолтрифосфата (ИФ3) и диацилглицерола (ДАГ). (посмотреть реакцию)
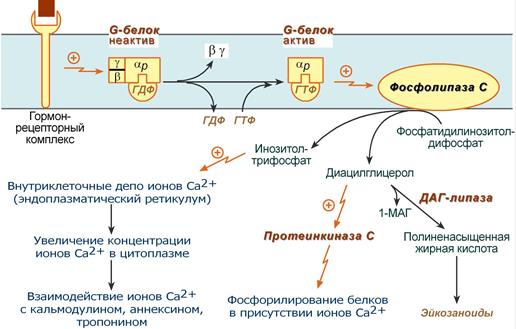
Общая схема кальций-фосфолипидного механизма действия гормонов
Этапы передачи сигнала
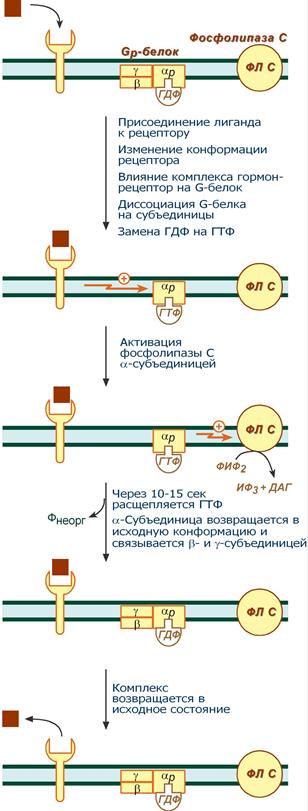
Этапы передачи сигнала выглядят следующим образом:
- Взаимодействие гормона с рецептором приводит к изменению конформации последнего.
- Это изменение передается на G-белок (GTP, ГТФ-зависимый) который состоит из трех субъединиц (αP, β и γ), α-субъединица связана с ГДФ.
- В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на αP-субъединице ГДФ заменяется на ГТФ.
- Активированная таким образом αP-субъединица стимулирует фосфолипазу С, которая начинает расщепление ФИФ2 до двух вторичных мессенджеров – ИФ3 и ДАГ.
- Инозитолтрифосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа 2+ . Диацилглицерол совместно с ионами Са 2+ активирует протеинкиназу С. Кроме этого, диацилглицерол имеет и другую сигнальную функцию: он может распадаться на 1-моноацил-глицерол и полиеновую жирную кислоту (например, арахидоновую), из которой образуются эйкозаноиды.
- Протеинкиназа С фосфорилирует ряд ферментов и в целом участвует в процессах клеточной пролиферации. Накопление ионов Са 2+ в цитоплазме вызывает активацию определенных кальций-связывающих белков (например, кальмодулина, аннексина, тропонина С).
- Гидролиз ФИФ2 продолжается некоторое время, пока αP-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
- Как только ГТФ превратился в ГДФ, то αP-субъединица инактивируется, теряет свое влияние на фосфолипазу C, обратно соединяется с β- и γ-субъединицами.
Все возвращается в исходное положение. - Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск механизма произойдет быстро – в клетке активируются соответствующие процессы.
- если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет.
Аннексины – семейство Ca 2+ -зависимых фосфолипид-связывающих белков на внутренней поверхности плазматической мембраны, связаны с цитоскелетом. Они участвуют в разнообразных процессах внутри и вне клеток: ингибирование свертывания крови, снижение активности фосфолипазы A2 и синтеза эйкозаноидов, регуляция функции лейкоцитов и др. Также играют роль в эндо- и экзоцитозе, пролиферации и дифференцировке клеток, регуляции тока ионов через мембрану и др.
Читайте также:
- Вербальное и невербальное общение в психическом развитии ребенка кратко
- Возникновение интроспективной психологии плотин и августин кратко
- Каковы основные результаты войн с османской империи в 18 веке кратко
- Политика мягкой экспансии великого княжества литовского кратко
- Изложение на тему летняя гроза

