Хлор история открытия кратко презентация
Обновлено: 07.07.2024
Презентация по теме "Хлор". Содержит материал, иллюстрирующий способы получения хлора, его химические свойства, применение.
| Вложение | Размер |
|---|---|
| hlor.pptx | 2.84 МБ |
Предварительный просмотр:
Подписи к слайдам:
Хлор Презентация по химии Ученицы 11 класса Каримовой Юлии Учитель химии Столяренко С.Ю.
Положение в таблице Строение атома Физические свойства История открытия Минералы Получение Химические свойства Применение
Положение в таблице Х лор - химический элемент седьмой группы, главной подгруппы, третьего периода периодической системы элементов Д. И. Менделеева, порядковый номер 17, относительная атомная масса 35,4527, относится к галогенам. О бщее название элементов VIIA группы – галогены – происходит от греческих слов – "галс" – соль и " генес " – рождающий, т. е. "солероды". У галогенов наиболее ярко по сравнению с остальными элементами выражены свойства неметаллов. Говорят, галогены – типичные неметаллы.
Возбуждения В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном (переход электронов на вакантные d -облака) увеличивается число неспаренных электронов до 7. Следовательно, валентность галогенов может быть 3; 5; 7 (исключение атом фтора).
Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р- облаков двух атомов хлора. Кроме того, в молекуле хлора имеет место донорно-акцепторное взаимодействие, упрочняющие связь. Молекула хлора
Физические свойства С возрастанием молекулярной массы температуры плавления и кипения веществ, состоящих из молекул одинакового строения, повышаются. Все галогены окрашены: фтор – светло-желтый, хлор – желтовато-зеленый, бром – красно-коричневый, йод – серо-фиолетовый. З а исключением фтора, который бурно реагирует с водой, галогены мало растворимы в воде. Чтобы приготовить концентрированный раствор, используют другие растворители. Водные растворы галогенов называются соответственно хлорной, бромной и йодной водой, в них галогены сохраняют в значительной мере свои свойства.
Физические свойства Х лор – ядовитый газ желто-зеленого цвета с резким запахом. Это первое химическое оружие. Во время Первой мировой войны 1914–1918 гг. его применяли в качестве боевого отравляющего вещества. Хлор тяжелее воздуха в 2,5 раза, поэтому стелется по земле и в виде газового облака переносится ветром на значительные расстояния. Хлор вызывает раздражение дыхательных путей, а вдыхание большого его количества вызывает смерть от удушья. При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение 5 минут.
История открытия П ервым из галогенов был открыт хлор (К. Шееле , 1774 год). Полученный желто-зеленый газ шведский ученый принял за сложное вещество. Лавуазье и Бертолле считали, что этот газ является оксидом неизвестного элемента " мурия ". В 1807 году английский химик Гемфри Дэви получил тот же газ, что и Шееле . Три года пытался Дэви выделить из него " мурий ", но безуспешно. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от " хлорос " – желто-зеленый). Через пять лет Гей-Люсак дал газу название хлор. В жидком виде хлор был впервые получен в 1823 году М. Фарадеем.
В природе встречается два стабильных изотопа хлора: 35 Cl (75,77%) и 37 Cl (24,23%). Содержание хлора в земной коре составляет 1,7% (по массе). Важнейшие минералы: галит NaCl , сильвин KCl , бишофит MgCl 2 ·H 2 O, сильвинит KCl · NaCl , карналлит KCl ·MgCl 2 ·6H 2 O. Кроме того, он содержится в виде соединений в морской, речной, озерной водах. Важнейший биоэлемент, необходим для нормальной жизнедеятельности организма. В живом организме содержится 0,15 % от массы тела, входит в состав клеточной и других биологических жидкостей (желудочный сок, плазма). Распространение в природе
Минералы Каменная соль = поваренная соль = галит Карналлит Сильвин
Получение О сновной промышленный способ получения хлора – электролиз хлоридов щелочных металлов ( NaCl , KCl ). Также его получают окислением HCl кислородом воздуха в присутствии катализаторов – хлорида меди (II) и хлорида железа (III): 4HCl + O 2 = 2Cl 2 + 2H 2 O В лаборатории молекулярный хлор получают взаимодействием HCl с перманганатом калия, оксидом марганца (IV), бихроматом калия и др.: 2KMnO 4 +16HCl ( конц .) = 2KCl+2MnCl 2 +8H 2 O+5Cl 2 П ри нагревании : MnO 2 + 4 HCl = MnCl 2 + Cl 2 + 2 H 2 O 6HCl + KClO 3 = 3Cl 2 + KCl + 3H 2 O
Получение 2KMnO 4 +16HCl ( конц .)= 2KCl + 2MnCl 2 + 8H 2 O + 5Cl 2
Химические свойства Х лор – активный окислитель. Энергично реагирует с металлами и большинством неметаллов (за исключением O 2 , N 2 и благородных газов). Вступает также в реакции диспропорционирования , для протекания которых наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов.
Х лор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью ( Fe , Cr ) в отличие от соляной кислоты заставляет их проявлять большую степень окисления: С Металлами 2Al + 3Cl 2 = 2AlCl 3 2 K + Cl 2 = 2 КCl 2 Fe + 3Cl 2 = 2 FeCl 3 Cu + Cl 2 = CuCl 2
Cu+Cl 2 =CuCl 2 2Fe+3Cl 2 = 2FeCl 3
H 2 + Cl 2 = 2 HCl (на свету) С Неметаллами 2 Cl 2 + C = C Cl 4 3Cl 2 + 2P ( крист .) = 2PCl 3 5 Cl 2 + 2 P = 2PCl 5
О бразует соединения с другими галогенами : Cl 2 + F 2 = 2ClF Cl 2 + 3F 2 = 2ClF 3 , t = 200–400 °C Cl 2 + 5F 2 = 2ClF 5 5Cl 2 + 2Sb = 2SbCl 5
Х лор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием "хлорной воды": Cl 2 + H 2 O = HCl + HClO С Водой Со щелочами Cl 2 + 2KOH( хол ) = KCl + KClO (гипохлорит ) + H 2 O Cl 2 + 6KOH( гор ) = 5KCl + KClO 3 (хлорат ) + 3H 2 O
С Бескислородными Кислотами Cl 2 + HBr = 2 H Cl + Br 2 Cl 2 + HI = 2 H Cl + I 2 Cl 2 + 2NaI = 2NaCl + I 2 Cl 2 + FeCl 2 = 2 FeCl 3 С Солями
Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул соединений, относящихся к различным классам органических веществ. C n H 2n+2 + Cl 2 ( на свету ) = C n H 2n+1 Cl + HCl [ р. Семенова ] C n H 2n + Cl 2 = C n H 2n Cl 2 C n H 2n-2 + Cl 2 – в несколько стадий C 6 H 6 + Cl 2 ( AlCl 3 ) = C 6 H 5 Cl + HCl C 6 H 6 + Cl 2 (на свету) = гексахлоран Гомологи бензола + Cl 2 (на свету) = замещение по радикальному механизму ( Cl к альфа- H ) 5. R-CH 2 -COOH + Cl 2 (PCl 5 ) = R- CHCl -COOH + HCl
Применение хлора Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является хлорная вода В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.
Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Использовался как оружие массового поражения и в производстве других отравляющих веществ массового поражения: иприт, фосген.
По теме: методические разработки, презентации и конспекты
Урок по теме: "Мультимедийные интерактивные презентации. Дизайн презентации и макеты слайдов. "

Презентация "Использование мультимедийных презентаций как универсального средства познания"
В презентации "Использование мультимедийных презентаций как универсального средства познания" даются советы по оформлению и наполнению презентаций.
Разработка урока и презентации "The Sightseeng Tours" London and Saint-Petersburg c презентацией
Цели: развитие речевого умения (монологическое высказывание); совершенствование грамматических навыков чтения и говорения (прошедшее неопределенное время, определенный артикль) Задачи: учи.
Презентация "Рекомендации по созданию мультимедийных презентаций"
§Предложить рекомендации по подготовке презентаций; §научить профессиональному оформлению слайдов. .

Презентация к уроку "Обобщение по теме презентации"
Презентация "Лица Победы". Данную презентацию можно использовать на уроках литературы в день памяти о тех, кто сражался и погиб в годы Великой Отечественной войны.
Данная презентация посвящена событиям Великой Отечественной войны и может быть использована в средних и старших классах как на уроках литературы, так и на внеклассных мероприятиях для пров.
Проектная деятельность на уроках литературы. 7 класс. Стихи Н.А.Некрасова .Презентация. презентация
Презентация к уроку"Проектная деятельность на уроках литературы.Стихи Н.А.Некрасова.7класс".
3 История открытия. Впервые хлор был получен в 1772 г. ученым Карлом Шееле. Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
4 Распространение в природе. Два изотопа Cl 35 Cl 37 Cl
5 Соединения в природе в составе минералов. Галит NaCIСильвин KCl Каинит KCl · MgSO4 · 3Н2О Сильвинит KCl· NaCl Бишофит MgCl2·6Н2O Карналлит KCl · MgCl2 · 6Н2O
6 Большая часть хлора содержится в морях и океанах.
7 Хлор содержится в земной коре.
8 В человеческом организме также содержится хлор. В состав нейрона входит хлор. В крови содержание хлора составляет 2,89 г/л
9 Мышечная ткань человека содержит 0,20-0,52 % Костная ткань человека содержит 0,09 %
10 Растения не могут существовать без хлора. Хлор необходим для образования кислорода в процессе фотосинтеза.
11 Соляные насыпи на солончаке Уюни, Боливия.
12 Морские марши. Растения-галофиты.
13 Галобактерии. Вид на северную часть озера Чокрак. Розоватая окраска воды обусловлена галобактериями, обитающими в рассоле.
14 Физические и химические свойства. Хлор очень сильный окислитель Cl 2 + H 2 S 2HCl + S
15 Применение. Хлор применяют во многих отраслях промышленности, науки и бытовых нужд. Оконный профиль изготовленный из хлорсодержащих полимеров Основным компонентом отбеливателей является хлорная вода
16 Девушка в топе и юбке из поливинилхлорида на тканевой основе. Поливинилхлорид Поливинилхлорид
24 Химическая промышленность. Бертолетовая соль. Хлорная известь.
25 Хлорид лекарств. Соляная кислота.
26 Хлорид металлов. Хлорид ядов.
29 Металлургия. Титан. Олово. Тантал. Ниобий.
31 Меры предосторожности. Хлор токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора).
32 Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну.
33 Противогаз. Перчатки. Спецкостюм.
34 Спасибо за внимание!
Похожие презентации

Хлор Тема урока:. История открытия Хлор был получен шведским химиком и фармацевтом К. Шееле в 1774 г. Название дано по окраске газообразного хлора ( от.

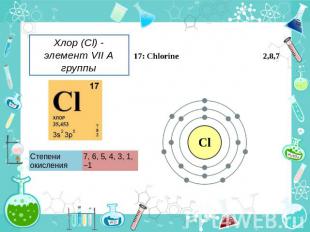
Хлор (Cl) - элемент VII A группы Степени окисления 7, 6, 5, 4, 3, 1, 1.

Галогены МОУ гимназия 32 учитель химии Кудравец Елена Александровна.

Портнова Дарья Гаджиева Кристина 8М ХЛОР - химический элемент VII группы периодической системы, относится к галогенам. Порядковый номер 17, относительная.

Работу выполнила ученица 8а класса школы 612 Чертилина Диана.

Суд над галогенами. Цели урока-суда: 1) дать сравнительную характеристику галогенов, 2) рассмотреть нахождение в природе и применение. 1) дать сравнительную.

Общая характеристика элементов V-а подгруппы Азот Аммиак Оксид азота (I) Оксид азота (II) Оксид азота (III) Оксид азота (IV) Оксид азота (V) Азотистая.

Общая характеристика галогенов Содержание Задачи и цели урока Познакомить с положением в П.системе Выяснить распространение в природе,физические свойства,отношение.

Подготовила ученица 10-Б класса Тупальская Яна. Соляная кислота (хлоридная) Хлоридная (или соляная) кислота (хлористоводоро́дная кислота) (Hydrochloric.

ГАЛОГЕНЫ Элементы главной подгруппы 7 группы Периодической системы Менделеева.

Презентация к уроку (9 класс) по теме: Презентация по теме "Хлор".

АЗОТ И ЕГО СОЕДИНЕНИЯ.. Азот. Порядковый номер 7. 2 период 5 группа, главная подгруппа.

Кислород Кислород самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4.

№ слайда 1
№ слайда 2
Хлор (Cl) - элемент VII A группы

№ слайда 3
История открытия Впервые хлор был получен в 1772 г. Шееле: 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O Однако Шееле предположил, что хлор представляет собой оксид соляной кислоты. И только Дэви удалось электролизом разложить поваренную соль на натрий и хлор.

№ слайда 4
Распространение в природе Хлор – активный элемент В природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов. В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.

№ слайда 5

№ слайда 6
Физические свойства При н.у. хлор -ядовитый газ желтовато-зелёного цвета, с резким, удушающим запахом. По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.

№ слайда 7

№ слайда 8
Химические свойства В колбу с хлором капнули несколько капель концентрированного раствора аммиака. В результате взаимодействия хлора с аммиаком образуется NСl3 (хлористый азот, взрывчатая желтая маслянистая жидкость) по уравнению: 4NН3 + ЗСl2 = NСl3 + ЗNН4Сl В условиях нашего опыта хлористый азот моментально разлагается, чем и объясняется треск и маленькие вспышки в колбе

№ слайда 9
Хлор очень сильный окислитель Cl2+2Na=2NaCl

№ слайда 10

№ слайда 11
Оконный профиль изготовленный из хлорсодержащих полимеров Основным компонентом отбеливателей является хлорная вода

№ слайда 12
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. Н а короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.

Помогите другим пользователям — будьте первым, кто поделится своим мнением об этой презентации.
Аннотация к презентации
Смотреть презентацию онлайн с анимацией на тему "Хлор" по химии. Презентация состоит из 11 слайдов. Для студентов. Материал добавлен в 2017 году. Средняя оценка: 2.9 балла из 5.. Возможность скчачать презентацию powerpoint бесплатно и без регистрации. Размер файла 0.43 Мб.
Содержание

Студента группы КМС-11 Башкирского строительного колледжа Горбунова Романа Александровича

Слайд 2

Слайд 3
Оглавление
История открытия хлора Химические свойства Особенности работы и меры предосторожности Распространение в природе Применение Способы получения Хранение хлора

Слайд 4
История открытия хлора
Соединение с хлором — газообразный хлороводород — было впервые получено Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите: 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор

Слайд 5
Распространение в природе
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток

Слайд 6
Особенности работы и меры предосторожности
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3. ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.

Слайд 7
Химические свойства
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие валентности. Схема образования возбуждённых состояний атома:

Слайд 8
Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): 2Na + Cl2 → 2NaCl 2Sb + 3Cl2 → 2SbCl3 2Fe + 3Cl2 → 2FeCl3 Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C. Cl2 + H2 → 2HCl 5Cl2 + 2P → 2PCl5 2S + Cl2 → S2Cl2

Слайд 9
Способы получения
Химические методы Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение. Может быть получен при взаимодействии перманганата калия с соляной кислотой: 16HCl + 2KMnO4 → 2MnCl2 + 5Cl2↑ + 2KCl + 8H2O Метод Шееле Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой: MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O Электрохимические методы Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой: 2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH Метод Дикона В 1867 году Диконом был разработан метод получения хлора каталитическим окислениемхлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений. 4HCl + O2 → 2H2O + 2Cl2

Слайд 10
Хранение хлора

Слайд 11
Применение
Читайте также:

