Химия это 3 класс окружающий мир определение кратко и понятно
Обновлено: 05.07.2024
— формирование целостной картины мира и осознание места в нём человека на основе единства рационально-научного познания и эмоционально-ценностного осмысления ребёнком личного опыта общения с людьми и природой;
какие вещества наиболее распространены в быту?
познакомить с наиболее распространенными в быту веществами: поваренной солью, сахаром, крахмалом, кислотой, их свойствами, научить ставить опыты.
Предметные результаты
-определять свойства соли, сахара, крахмала, кислоты;
- различать сахар, соль, крахмал по характерным признакам
Универсально учебные действия (УУД)
Регулятивные: научатся ставить опыты, используя лабораторное оборудование.
Познавательные: контролировать и оценивать процесс и результат деятельности; овладение логическими действиями сравнения, анализа.
Коммуникативные: умение работать в паре, вести диалог, излагать свое мнение; осуществлять взаимный контроль в совместной деятельности.
Личностные результаты
Формирование целостного взгляда на мир. Развитие мотивов учебной деятельности
Основные понятия и определения
Химия-наука о веществах. Вещества: соль, крахмал, сахар, кислота. Наиболее распространенные в быту вещества – соль, сахар, крахмал, кислоты.
Проверка готовности к усвоению нового материала
На свете очень много различных веществ. Сейчас их известно несколько миллионов. Одни из них существуют в природе, а другие созданы искусственно (например, пластмассы). Приведи примеры веществ.
Изучение нового материала
Разнообразие веществ
Вещества изучает наука химия.
Познакомимся с некоторыми из веществ. Для этого отправимся. на кухню.
Вот на столе солонка, а в ней поваренная соль. Мы привыкли, что это вещество имеет вид белых крупинок. Но в природе, под землёй, оно встречается в виде камня. Самое важное для человека свойство поваренной соли — то, что она солёная на вкус. Поэтому её используют в пищу.

В природе поваренная соль встречается не только под землёй. Очень много её содержится в морской воде, а также в воде солёных озёр. Есть она и в почве, и в телах живых организмов.
Поваренная соль — это одна из минеральных солей, встречающихся в природе. Некоторые из них люди добывают и используют как удобрение для растений
Сахар — ещё одно вещество, с которым мы обязательно встретимся на кухне. По внешнему виду его можно спутать с солью. Зато их не спутаешь по вкусу. Сладкий вкус — главное свойство сахара, поэтому его добавляют во многие продукты. Получают сахар из растений — сахарного тростника (в жарких странах) и сахарной свёклы.

Сахарная свёкла и сахарный тростник
Обыкновенный сахар не единственное сладкое вещество в природе. Многим детям знакомы большие сладкие таблетки — витамин С с глюкозой. Глюкоза — ещё одна разновидность сахара. В природе она содержится в различных частях растений. Особенно богаты глюкозой плоды винограда и виноградный сок. Поэтому глюкозу также называют виноградным сахаром.
Крахмал — одно из важнейших питательных веществ, необходимых человеку. Он содержится во многих продуктах растительного происхождения.
Учёные-химики подсказали, как узнать, есть ли крахмал в том или ином продукте. Для этого нужна разбавленная водой настойка йода. Если капнуть ею на продукт, в котором содержится крахмал, настойка йода приобретёт сине-фиоле- товый цвет. Таким способом можно установить, что крахмал содержится, например, в белом хлебе, рисовой каше, клубнях картофеля.
Большая группа веществ, с некоторыми из которых мы наверняка встретимся на кухне, — кислоты. Каждому знаком кислый вкус лимона. Такой вкус ему придаёт содержащаяся в нём лимонная кислота. В яблоках содержится яблочная кислота, а в листьях щавеля — щавелевая кислота. Когда прокисает молоко, в нём образуется молочная кислота.

Общее свойство этих веществ — кислый вкус. Но это не значит, что любую кислоту можно пробовать на вкус. Многие кислоты очень едкие — они разрушают кожу человека, одежду, бумагу, древесину. Поэтому обращаться с ними надо осторожно. На кухне мы встретим одну из таких опасных кислот — это уксусная кислота, или уксус. Ты уже знаешь, что к бутылочке с уксусом нельзя прикасаться. Это вещество используют только в разбавленном виде.
Из-за загрязнения окружающей среды кислоты стали образовываться высоко в небе. Нередко они выпадают на землю вместе с дождём. Это так называемые кислотные дожди. От них страдают растения и всё живое, портятся многие постройки, в том числе старинные памятники.
Где и как добывают соль. Добыча соли в России
Никогда не понимала пользы таких заданий. Еще в школе протестовала против них всей силой: ну зачем, зачем нужно переписывать определения в тетрадочку, если для этого уже придуманы словари. В общем, постараюсь дать для вас определения всех этих понятий и еще что-то интересное рассказать.

Что такое химия
У этого слова есть несколько определений. Перечислю их всех, как и в настоящем толковом словаре.
Химия – это важнейшая наука, которая изучает:
В чем интерес ее изучать
Химик с легкостью объяснит вам, как делать секретные послания. Достаточно просто написать его молоком на бумажке и передать другу. Если он тоже знает секрет вашего письма, то подержит его над пламенем свечки.

И случится чудо – написанные вами буквы станут светло-коричневыми. Ведь маленькие частички молока, оставленные вами, пригорают быстрее, чем начинает возгораться бумага. Главное в этом маленьком шпионском эксперименте – очень аккуратно держать бумагу над открытым огнем, не спуская слишком низко под языки пламени. Иначе бумага все-таки может успеть загореться.

Также химией называют школьный предмет, который помогает школьникам освоить азы данной науки. Там вы точно узнаете, как получить соль из морской воды – это, по-моему, самый первый эксперимент, которым занимаются все.

Остальные определения
Но хватит о химии и соли, остальные определения тоже ждут своего часа.
Крахмал – это полимер, который производится растениями и используется человеком в кулинарных целях. Его встретить просто – замочите картошку в воде, через какое-то время на ее поверхности появятся белые разводы – это и будет крахмал.

А кислотой называют вещество, одним из составляющих которого непременно будет атом водорода. При химической реакции оно может отдать этот водород, приняв к себе атом металла.
Автор: Быкова Елена Юрьевна
Организация: МБОУ Школа №49 г.Уфа РБ
Населенный пункт: Республика Башкортостан, г. Уфа
Глава 1. Знакомство с химией
Из истории химии с.3
Что такое химия с.4
Химические явления в природе и жизни человека с.4
Глава 2 Химия вокруг нас
2.1. Химия и вещества с.6
2.2 Химия на кухне и в быту с.7
2.3 Интересные факты с.8
Глава 3. Практическая часть. Опыты дома
3.1. Шутки и фокусы с.9
3.2. Опыт " Извержение вулкана" с. 9
3.3. Опыт "Самонадувающийся шарик" с.10
3.4. Опыт "Секретное послание" с.10
3.5. Опыт "Йод - индикатор содержания крахмала" с.10
3.6. Опыт "Фараоновы змеи" с.11
3.7. Опыт "Лавовая лампа" с.11
3.8. Опыт "Седой шоколад" с. 11
Список литературы с.13
Все мы читали сказки о добрых феях и волшебниках, но в жизни нет ни тех, ни других. А вот чудеса – они и в самом деле бывают, хотя совершают их вовсе не джинны, а люди, вооружённые знаниями. Наука вот истинная волшебница. Химия – наука старая и вместе с тем молодая. Старая потому, что ещё в Древнем Египте люди умели осуществлять разные превращения веществ. Ведь уже тогда они научились добывать огонь, лепить и обжигать посуду из глины, окрашивать ткани, печь хлеб… А ведь всё это – химические явления. Химия – наука молодая, потому что, в подлинном смысле наукой, со своими законами, она стала всего два с лишним века назад, правда, за эти два столетия она достигла значительных успехов, чем в предыдущие тысячелетия. С помощью химии человек раскрыл немало природных тайн.
Актуальность: химия – наука чудес и превращений. Она интересна как сама наша жизнь, ведь всё что происходит с нами можно рассматривать с точки зрения химии.
Цель работы: Познакомить детей младшего школьного возраста с химией, доказать, что химия доступна всем и каждому. Привить интерес к этой науке.
Задачи:
Изучить литературу по теме исследования.
Собрать материал о химических явлениях в природе и в жизни.
Исследовать, как и в каких целях используются продукты химической промышленности.
Составить текст исследовательской работы.
Проделать опыты и доказать, что в домашних условиях реально можно творить чудеса.
Гипотеза: предполагается, что в условиях высокого уровня развития цивилизации, человек не может обходиться без химии.
Объект исследования: связь человека с химическими продуктами и явлениями.
Предмет исследования: химические опыты.
Методы исследования: изучение научной литературы, эксперимент, наблюдение, анализ полученных результатов.
Практическая значимость заключается в том что, повсюду, куда бы ни обратили свой взор, нас окружают предметы и изделия, изготовленные из веществ и материалов, которые получены на химических заводах и фабриках. Кроме того, в повседневной жизни, сами того не подозревая, каждый человек осуществляет химические реакции. Например, умывание с мылом, стирка с использованием моющих средств и многое другое.
Глава 1. Знакомство с химией
1.1 История химии
Химия – очень древняя наука. Химическое производство существовало уже за 3-4 тыс. лет до н.э. В древнем Египте умели выплавлять из руд металлы, применяли золото, серебро, производили стекло, керамику, краски, духи. Первыми учеными-химиками были египетские жрецы (бальзамирование и изготовление стойких красок).
Развитие химии в России связано с работами М .В. Ломоносова. В 1748 г. он сформулировал важнейший закон химии – закон сохранения массы. Значительный вклад в развитие химии внесли выдающиеся русские ученые – А.М. Бутлеров и Д.И. Менделеев. А.М. Бутлеров в 1861 г. создал теорию строения органических веществ. Д. И. Менделеев в 1869 г. открыл Периодический закон и на его основе создал Периодическую систему.
Учение Аристотеля явилось идейной основой развития отдельной эпохи в истории химии – АЛХИМИИ. Алхимия – это темная, дьявольская наука. В средние века жили люди, которые много времени проводили в небольших лабораториях, получая различные вещества. Это были алхимики. Алхимики пытались превратить металлы в золото. Цари и короли держали их при своих дворах. Но им не повезло - они не научились превращать металлы в золото и алхимию запретили, а алхимиков обвиняли в колдовстве и сжигали на кострах.
Развитие химии продолжается и в настоящее время.
1.2. Что такое химия.
Химия – одна из наук о природе, об изменениях, происходящих в ней. Она изучает из каких веществ состоит тот или иной предмет. Химия – наука удивительная! Как только человек рождается, он попадает в мир химических веществ.
Первый вздох и вот уже в лёгких смесь газов, первый глоток материнского молока и самый главный шедевр биохимической эволюции – белок начинает работать в организме малыша.
1.3. Химические явления в природе и в жизни человека
Окружающий нас мир состоит из химических элементов: мебель, одежда, книги, краски. О некоторых химических элементах мы уже слышали: железо, золото, серебро, йод, водород, кислород, кальций и другие.
На нашей планете больше всего кислорода (О). Одних элементов в природе очень много, других совсем мало. Больше всего на свете водорода (Н) и гелия (Не). Из этих химических элементов почти целиком состоит Солнце, далёкие звёзды, кометы…
А почему трава зелёная? Потому, что в каждой травинке есть химическое соединение – хлорофилл, благодаря которому растения дышат и растут.
Почему соль солёная? Потому, что в ней есть натрий (Na) и хлор (Cl), который попадая на слюну образуют раствор с особым привкусом.
А химический элемент железо (Fе) есть не только в гвозде или машине, но и в воде, в земле, в деревьях и даже в организме человека. В крови человека есть частички железа (Fе), но они так малы, что увидеть их можно при помощи микроскопа.
А если хочется скорее вырасти – потреблять нужно химический элемент кальций (Са). Его много в молоке и в молочных продуктах. Даже настроение человека, его здоровье, во многом зависят от присутствия некоторых химических элементов в организме. Химический элемент магний (Mg) влияет на работу сердца. Он содержится в абрикосах и персиках.
Химическое явление в природе – это процесс, в результате которого из одних веществ образуются другие. При химических реакциях исходные вещества превращаются в другие вещества, обладающие другими свойствами.
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
На кухне можно рассмотреть еще несколько любопытных химических явлений например,образование накипи в чайнике. А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Свечение ночного моря. Голубой свет газовой горелки. Слабое белесое свечение гнилого дерева в лесу. Светящийся фосфор. Во всех этих случаях свечение возникает за счет энергии химической реакции. Отсюда — название явления: хемилюминесценция, т. е. химическое свечение.
Глава 2. Химия вокруг нас.
2.1. Химия и вещества
Что такое вещество? Любой предмет, существо или явление состоят из маленьких частиц -молекул. А множество молекул образуют вещество.
В твердом веществе молекулы плотно прижаты друг к другу, между ними существует сильное притяжение.
Жидкость - это состояние вещества, при котором молекулы чувствуют себя более свободными, могут двигаться с места на место.
Газообразное вещество - это вещество, в котором частицы движутся свободно, хаотично.
Вокруг нас громадное количество полезных и вредных веществ! Например, в природе есть природные вещества, то есть те, которые были созданы без участия человека. Это – вода, кислород, углекислый газ, камень, древесина и другие.
Есть вещества, созданные человеком. Они называются искусственными веществами. Это – пластмасса, резина, стекло и другие.
Хотя я ещё не изучаю химию в школе, но мне уже известно такое распространённое вещество в природе, как вода (H2O). Это вещество может иметь три агрегатных состояния – жидкое, твёрдое, газообразное. На кухне я и проследила за всеми ее состояниями.
Разобраться с бесчисленными полезными и вредными веществами, узнать их строение, свойства, роль в природе – одна из задач химии. Она нужна всем людям – строителю, фермеру, врачу, домохозяйке, повару и врачу.
2.2 Химия на кухне и в быту
У нас дома химические препараты и вещества! Эти препараты и вещества есть и в большом количестве в каждом доме. Они выпускаются нашей промышленностью в твёрдом, жидком, порошкообразном и других видах. Без них современный человек не представляет своей жизни, так как они помогают ему.
Химия на кухне необходима, прежде всего, для здоровья человека т.к. именно на кухне мы проводим половину жизни.
На кухне все нужно содержать в чистоте и порядке, потому что в антисанитарных условиях можно получить кожные заболевания и даже привести к отравлению. Поэтому здесь нужно постоянно наводить порядок:
· Кухонный стол нужно протирать перед и после каждого приема пищи;
· Протирать поверхность стола лучше всего тряпкой, предварительно смоченной в мыльной воде с добавлением уксусной кислоты;
· Для мытья посуды наиболее эффективны жидкие средства для мытья посуды, такие как AOS, Sorti и т.д., обладающие высокой мылкостью;
Химия в ванной тоже подразумевает чистоту т.к. в ванне мы наводим гигиену тела.
Для того чтобы отчистить ванную необходимо использовать хлорсодержащие вещества, очищающие порошки (Пемо-люкс, Сода эффект и т.д.). Для того чтобы навести гигиену тела, человек использует множество химических веществ — это всевозможные шампуни, гели для душа, туалетные мыла, крема для тела, всевозможные лосьоны и т.д. Для стирки также используются химические вещества, это порошки (Тайд, Ариэль, Миф и т.д.).
Особое внимание хотелось бы обратить на косметику. Ведь косметика – это тоже химия, которой люди пользуются ежедневно. К химической косметике относят помады, пудру, тени, туши, карандаши для подвода глаз, губ, тональный крем и многое другое.
Раскрыв кухонный шкаф, мы увидим уксус, пищевую соду, растительное масло, сахар, муку, соль, молоко, крахмал.
Ничего химического, скажите вы, здесь нет. Обычные продукты питания.
Но не тут – было! Это настоящие химические вещества, с помощью которых на нашем столе появляются вкусные, питательные и полезные блюда. У этих веществ даже есть химические названия.
соль – это хлорид натрия;
пищевая сода – гидрокарбонат натрия;
уксус – уксусная кислота;
А также к химическим препаратам можно отнести: кислоты ( щавелевая, лимонная и т. д.), щелочи (гашеная известь, нашатырный спирт), соли (поваренная, питьевая сода, марганцево-кислый калий), растворы и растворители (бензин, ацетон, глицерин), минералы (мел, гипс, известняк), полимерные материалы (пластмассы, полиэтилен, полипропилен), волокнистые материалы (капрон; лавсан).
Таким образом, химия повсюду. И в предметах, которые нас окружают, и в производимых в повседневной жизни действиях (например, приготовление пищи или мытье волос), и, наконец, внутри самих людей.
2.3 Интересные факты
Порох был изобретен в Китае и долгое время использовался только в мирных целях — для салютов и фейерверков. Спички были созданы случайно: в 1827 году аптекарь Джон Уокер забыл палочку, покрытую химической смесью, которая засохла. Пытаясь отчистить палочку, английский химик провел ей по полу, в результате вспыхнул огонь. Практичный англичанин тут же понял, как можно применить свое изобретение. К случайным открытиям также можно отнести: антибиотики (Александр Флеминг), небьющееся стекло (Эдуард Бенедиктус), фосфор (алхимик Бранд Хенниг пытался получить золото из… человеческой мочи). Также случайно были открыты: вулканизированная резина (Чарлзом Гудьиром), йод (кот фармацевта Бернара Куртуа разбил приготовленные для опыта бутылки, в результате реакции на полу остался кристаллизованный йод). Заменитель сахара сукралоза: студент Шашикант Пхаднис плохо понял команду профессора и попробовал вещество, приготовленное для опыта (анг. test и taste звучат почти одинаково, но имеют абсолютно разные значения). И таких примеров немало.
Глава 3. Опыты дома
3.1. Шутки и фокусы
Даже маленькие дети знают, что если втянуть воздух из шара с гелием, то изменится голос.
Существует металл, очень похожий на алюминий – галлий. Но только при температуре ниже 28 градусов – иначе он начинает плавиться. Химики часто шутят над своими друзьями с помощью растворяющихся ложек. Такая ложка сделана из галлия, и, попадая в горячий чай, она начинает плавиться.
Чтобы создать большое количество пены, можно в водный раствор соды добавить хлорной извести.
Цвет лепестков белых роз можно изменить при помощи нашатыря: нужно опустить в него стебли.
Провести фокус можно и с мармеладными червячками. Если их пропитать содовым раствором, а затем опустить в уксус, червячки начнут дергаться и шевелиться.
3.2. Опыт "Извержение вулкана"
Нам понадобится: сода, красная или оранжевая краска, вода, моющее средство, уксус.
3.3.Опыт "Самонадувающийся шарик"
Нам понадобится: воздушный шарик, пластиковая бутылка, бытовая воронка, уксус, пищевая сода.
Заполняем бутылку уксусом на 1/3. Ставим воронку и засыпаем в бутылку 3-4 чайных ложки пищевой соды. Теперь быстро натягиваем воздушный шарик на горлышко и наблюдаем, как он надувается без чьей-либо помощи! После того, как шарик надуется, снимаем его с бутылки, завязываем и потираем о синтетическую ткань. Благодаря этому шарик поднимется к потолку и держится там несколько часов! (приложение рис.2)
3.4. Опыт "Секретное послание"
Нам понадобится: молоко, ватные палочки, лист бумаги.
Наливаем молоко в небольшую мисочку, мокаем в него ватную палочку и пишем ею на листе бумаги. Молоко высохнет и на бумаге ничего не будет видно, но с помощью духовки или утюга ее можно будет проявить! Для этого достаточно прогладить лист или подержать в тепле некоторое время. (приложение рис.3)
3.5. Опыт "Йод - индикатор содержания крахмала"
Нам понадобится: свежая картошка, кусочки, яблока, хлеба, стакан с разведенным крахмалом, стакан с разведённым йодом, пипетка.
Разрезаем картофель на две части и капаем на него разведенный йод – картошка синеет. Затем капаем несколько капель йода в стакан с разведенным крахмалом. Жидкость тоже синеет. Капаем с помощью пипетки растворенный в воде йод на яблоко, хлеб, по очереди.
Наблюдаем: Яблоко — не посинело вообще. Хлеб – посинел очень сильно. Эта часть опыта показывает наличие крахмала в различных продуктах.Крахмал, вступая в реакцию с йодом, дает синюю окраску. Это свойство дает нам возможность выявить наличие крахмала в различных продуктах. (приложение рис.4,5)
3.6 Опыт "Фараоновы змеи"
Для опыта понадобятся: таблетки глюконата кальция, пламя свечи.
Подносим таблетку глюконата кальция к пламени свечи, нагреваем. . Из таблетки поползет серая змея. (приложение рис.6)
3.7. Опыт "Лавовая лампа"
Нам понадобится: соль (или шипучая таблетка), водопроводная вода, растительное масло, несколько пищевых красителей, большой прозрачный стакан.
Заполняем на 2/3 стакан водой. Выливаем масло в стакан. Масло будет плавать на поверхности воды. Добавляем несколько капель различных красителей к воде и маслу. Медленно высыпаем 1 чайную ложку соли (или шипучую таблетку) в стакан с водой и маслом. Наблюдаем, что происходит с масляной и водной смесью. (приложение рис.7,8,9)
3.8. Опыт "Седой шоколад"
Нам понадобится: стакан с водой, кисточка, плитка шоколада.
Кистью наносим на шоколад воду. Затем заворачиваем шоколад в фольгу и помещаем в холодильник. Через неделю достаем шоколад из холодильника. На поверхности шоколада появился седой налет. Это выступили кристаллики сахарозы, т.к. вода их притягивает. (приложение рис.10,11)
Заключение.
Изучив литературу, проделав опыты, мы убедились в том, что химия очень интересная наука о веществах, которую необходимо знать каждому. Многие процессы, происходящие на нашей кухне и в быту – это химические явления. Химические опыты разнообразны и интересны и можно сразу увидеть химическую реакцию. Но нужно всегда помнить, что все опыты с химическими веществами должны проводиться в присутствии взрослых и с соблюдением правил безопасности. Понимание того, какие вещества опасны, а какие безопасны, поможет в обычной жизни.
Знание основ химии полезны и в начальной школе. Они помогают понять взаимосвязь веществ в природе. А знакомство с яркими, эффективными химическими опытами имеет важное познавательное значение и оказывает большое эмоциональное воздействие на нас, во многом способствует формированию у нас интереса к химии – очень интересной и важной науки.
Таким образом, гипотеза подтвердилась – в условиях современного развития цивилизации, человек не может обходиться без химии. Химия действительно важный помощник и друг человека, за нею будущее.
В процессе данного проекта, с поставленными целями и задачами мы успешно справились.
И в заключении, хотелось бы сказать: верьте в чудеса, знайте, что весь мир состоит из чудес и всё живое – уже великое чудо. В своём проекте нам удалось познать малую часть того, что может совершать наука, но жизнь непременно ещё много раз будет сталкивать нас с такими волшебными явлениями как химия.
Химия действительно удивительная наука!
Список литературы
1). В.А. Крицман , В.В. Станцо Энциклопедический словарь юного химика., испр. М: Педагогика 1990г.
2). О.Ольгин Давайте похимичим! : Занимательные опыты по химии. М.: Дет. Лит. 2002 – 175 с.: ил.-(Знай и умей).

Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
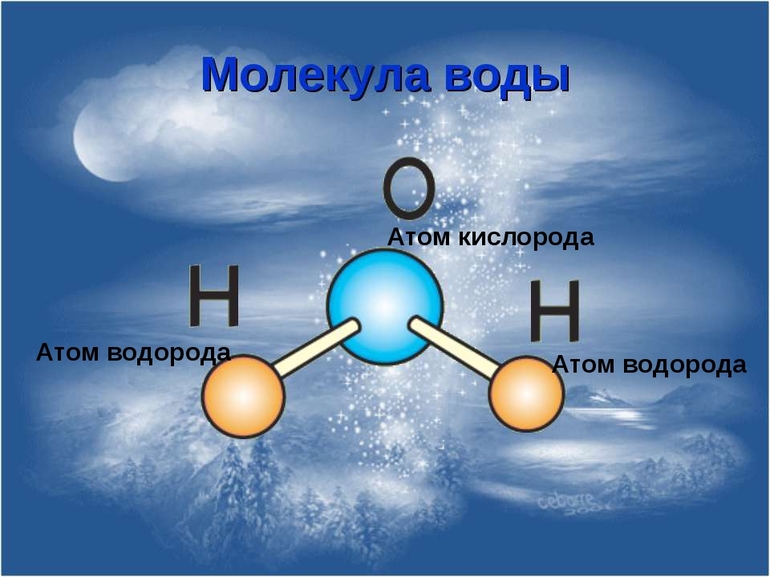
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:

- О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:

Аналогично изображают число молекул:
- 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:

В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).


Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
Вопрос. А чем отличаются химические формулы веществ:

Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.

Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:


- Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;

- Графит — атомы углерода находятся в одной плоскости;

Молекулы сложных веществ состоят из атомов разных химических элементов:

Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.

Валентность атомов некоторых химических элементов постоянна (табл. 2).

Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.

Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):

2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:

3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:


Задание 1.2. Определите валентности элементов в соединениях:

Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):

Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
- Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:

- Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:


Задание 1.4. Составьте химические формулы соединений:


Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:

Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:

Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:

Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:

Теперь между правой и левой частями уравнения можно поставить знак равенства:

Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:

Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:

2. Перенесём эти числа в правую часть уравнения:

3. Составим химические формулы полученных веществ по валентностям составных частей:


5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:

Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:

Здесь из двух и более веществ образуется одно вещество:

2. Реакции разложения:

Здесь из одного вещества получаются два вещества и более веществ:

3. Реакции замещения:

Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:

4. Реакции обмена:

Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:

Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:


Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.

Общее описание
Вода состоит из водорода и кислорода. Она выступает основой жизни на Земле. О ней написано много рассказов и научных работ. Это вещество необходимо для существования человека, животных и растений. Даже в поисках жизни на других планетах люди сначала пытаются найти воду, необходимую животным, людям и всем живым существам.
При изучении свойств воды по окружающему миру в 3 классе уже можно понять, почему она часто встречается в природе. Разнообразие полезных характеристик объясняет ее большой объём на Земле. Вода может формироваться в разных состояниях. Дети обычно воспринимают её как текучее вещество. В жидком виде она может течь и принимать форму ёмкостей, в которые её наливают. Это обусловлено свойством текучести, которое характерно для пластичных веществ.
Люди с детства знают, каковы основные признаки воды в жидком состоянии. Их можно отразить в таблице.
| Свойство | Характеристика |
| Прозрачность | В чистом виде вещество полностью прозрачно. Например, в чистой реке можно увидеть дно с камнями, водной растительностью и проплывающими рыбками. Некоторые другие жидкости тоже могут сохранять прозрачность, например, чай. Но она теряет это свойство, когда в неё добавляют примеси, из-за которых она становится мутной. К примеру, чай уже не будет прозрачным, если в него добавить молоко или сливки, а поднятый песок со дна сделает реку мутной |
| Бесцветность | Вода не имеет цвета, однако в это сложно поверить после увиденных водоёмов в природе. Многие видели море, которое бывает синего, зеленоватого или лазоревого оттенка. Даже бассейн отличается сине-зелёным цветом. Наличие оттенка у естественных или искусственных водоёмов объясняется тем, что вода способна отражать окружающие ее предметы и природные явления |
| Отсутствие запаха | Чистая вода не имеет запаха. Если она течёт из крана, тогда обычно пахнет хлоркой, поскольку содержит дополнительные вещества |
Большое количество растворённого в жидкости кальция может сделать её жёсткой. Это можно определить по вещам, которые теряют мягкость после стирки.
Свойства растворителя и проводника
Вода в чистом виде практически не встречается в природе. В ней могут растворяться некоторые виды веществ, частицы которых соединяются с её компонентами и образуют различные соединения. Кроме того, жидкость может проникать в различные тела. Специалисты доказали, что в жидком состоянии она присутствует даже внутри некоторых камней.

Часто содержимое водопроводных труб вмещает в себя аргон, азот или углекислый газ. В нем находятся различные примеси, которые поступают в водоёмы из воздуха, растворённых солей в почве, железа из водопроводных труб, мельчайших частиц пыли и т. д.
В воде растворяются соль и сахар. Но в этом соединении способны разлагаться только некоторые твёрдые вещества. К примеру, в нём не могут растворяться масло и камень.
Также жидкость может выступать проводником тока, если в ней есть определённые частицы. Чтобы не ударило током, следует держать подальше от нее включенные электрические приборы. Нередко приходится напоминать даже взрослым людям, что нельзя лежать в ванне с телефоном, который подключён к зарядному устройству. Дистиллированная жидкость является диэлектриком и не проводит ток.
Агрегатные состояния
В окружающем мире вода может представлять собой не только реки, озёра, океаны и другие виды водоёмов. Она может принимать различные формы, изменяясь под воздействием внешних факторов. Известны три состояния воды:
- жидкое;
- твёрдое;
- газообразное.

Способность соединения переходить из одной формы в другую обуславливает его круговорот в природе. В учебной литературе переход вещества в разные состояния изображается в виде схематических рисунков. При комнатной температуре вода характеризуется жидким состоянием. Она может быть тёплой, горячей и холодной, не теряя свойства текучести.
При замерзании жидкость переходит в твёрдое состояние и превращается в лёд. В естественных условиях она встречается в виде ледников, айсбергов и снега. Плотность льда меньше, чем у нее, поэтому часть водоёма замерзает не снизу, а сверху. Сформированный ледяной кусок не даёт промерзать остальной жидкости. Такие образования помогают некоторым животным выживать рядом с большими водоёмами.
При температуре 100 °C часть жидкости смешивается с частицами воздуха и преобразуется в пар. В газообразном состоянии ее невозможно увидеть в тёплом помещении. Водяной пар прозрачен и не имеет цвета. В природе газообразное состояние можно наблюдать в виде облаков и тумана. В домашних условиях его можно увидеть в виде испарений при закипании.
Можно провести небольшой опыт с холодной водой. В холодильник помещают на некоторое время стакан с ней, потом его вытаскивают и ставят на стол. Через определённый период водяной пар в воздухе преобразуется в капли, оседающие на стенках посуды.
Нагревание и замерзание
С помощью экспериментов и проектов получится узнать о свойствах воды в её разных агрегатных состояниях. Следует отметить, что это соединение обладает многими признаками, которые характерны для других видов жидкостей:

- При нагревании вода расширяется. Чтобы это доказать, можно посмотреть видеоурок или провести простой опыт. Необходимо взять колбу и стеклянную трубку с жидкостью. Трубку нужно опустить в большую ёмкость и отмерить в ней уровень вещества. Потом рабочую посуду помещают в ёмкость с тёплой водой. После нагревания снова отмеряют уровень жидкости в трубке, который поднимается из-за увеличения её объёма. Явление обусловлено тем, что с повышением температуры молекулы соединения движутся быстрее, сталкиваясь друг с другом и отталкиваясь от стенок ёмкости. Расстояние между частицами увеличивается, а жидкость занимает больший объём.
- При охлаждении вода сжимается. В этом случае колбу с трубкой опускают в ёмкость со льдом. После охлаждения уровень жидкости в узком сосуде понижается. Поскольку молекулы соединения движутся медленнее, расстояние между ними уменьшается. Это способствует снижению объёма вещества в сосуде.
- При замерзании вода расширяется. Для опыта следует взять банку, наполнить её жидкостью до краёв, неплотно закрыть и поставить в морозильную камеру. Через какое-то время можно увидеть, что вещество постепенно преобразовывается в лёд. Он начинает приподнимать крышку и выходить за пределы ёмкости. Эту особенность соединения специалисты учитывают при использовании водопроводных труб, которые обязательно утепляют, чтобы замёрзшее содержимое их не разорвало.
В природных условиях замерзающая вода может разрушать горы. Обычно осенью она скапливается в трещинах скал, замерзает и занимает большой объём в пустотах. Из-за этого горные породы разрушаются. Кроме того, вода может попадать в трещины асфальта, деформируя его при замерзании.
Вода является незаменимым источником жизни на Земле, ее используют не только для питья, но и для других нужд человечества. Учёные считают, что изучены не все свойства этого вещества, поэтому не исключено, что впереди нас ждет еще немало открытий.
Читайте также:

