Физические основы пэт кратко
Обновлено: 04.07.2024

Интересное о КТ
ПЭТ/КТ относится к высокотехнологичному методу ядерной медицины, который используют для изучения функций, структурных и морфологических особенностей органов и тканей.
Метод основывается на последовательном применении компьютерной и позитронно-эмиссионной томографии, объединенных в одно устройство.
Для визуализации патологических очагов и получения изображений пользуются радиоактивными изотопами, которые обладают способностью накапливаться в пораженных клетках.
Описание технологии
В основе методики ПЭТ (двухфотонная эмиссионная томография) лежит регистрация равных по энергии гамма-квантов, возникающих при распаде радионуклида из введенного радиофармацевтического препарата.
Позитрон, образованный при позитронной эмиссии изотопа, взаимодействует с электроном с последующей аннигиляцией.
Источник излучения улавливается детекторами и передается на регистрирующую систему томографа, которая определяет точные координаты сигнала.
С помощью комплекса преобразователей, свечение от взаимодействия гамма-квантов с детекторами трансформируется в электромагнитный импульс.

Далее проводится запись полученных импульсов в виде графика, или синограммы. Компьютерная обработка синограммы завершается выполнением трехмерной реконструкции распределения изотопа в исследуемой зоне.
Компьютерная томография позволяет получить изображение исследуемых органов и выявить локализация патологического очага.
Совмещенные аппараты ПЭТ/КТ проводят последовательное сканирование, затем программное обеспечение создает анатомическую картинку органов с наложенным на них изображением метаболических процессов.
Аббревиатура ПЭТ/КТ отображает объединение двух методов рентгеновской томографии для получения диагностической информации.
Преимущества и недостатки метода
ПЭТ обладает массой преимуществ перед другими методами ионизирующего излучения. Для клиницистов наиболее ценные из них следующие:
- 100% достоверность результатов;
- простота использования за счет четких протоколов и автоматизированной системы;
- высокая пропускная способность благодаря одновременному сбору и обработке данных, реконструкции картинок, анализу результатов;
- наглядные результаты диагностики;
- отсутствие болезненных ощущений и дискомфорта при прохождении диагностики;
- отсутствие необходимости применения дополнительных методов диагностики, в том числе инвазивных;
- короткие сроки для оценки эффективности проведенной терапии (1-2 недели).
Из недостатков отмечается высокая стоимость, необходимость нахождения Циклотрона вблизи диагностического центра, длительность подготовки и процедуры.
При несоблюдении сроков проведения диагностики после введения радионуклида, увеличивается риск ложных результатов.
Какие изменения показывает ПЭТ
Изображения, полученные при ПЭТ, оценивают по 4-уровневой шкале интенсивности накопления изотопа. При интерпретации данных учитываются физиологические очаги накопления радионуклидов.
- уровни 1-2 указывают на очаги воспалительного характера;
- уровень 3 — к вероятной природе патологических изменений относят опухоли, либо метастатические поражения;
- уровень 4 — служит признаком первичной опухоли, метастазов.
Метод показывает наличие атипичных очагов в органах и тканях, обнаруживает дегенеративные, дистрофические и посттравматические изменения.
ПЭТ с контрастом выявляет патологическую активность очагов, на основании ускоренного метаболизма. В головном мозге ПЭТ прослеживает распределение потока крови, от которого зависят все аспекты мозговой деятельности.
ПЭТ в диагностике злокачественных новообразований
Первое применение ПЭТ в онкологии относят к 1991 году. На сегодняшний день 70% всех процедур ПЭТ, которые проводят в мире, направлены на выявление злокачественных образований.

Центральный рак правого лёгкого
Метод позволяет определить точную локализацию опухоли, выявить рецидив, стадию процесса, дифференцировать злокачественные образования от доброкачественных, найти регионарные и отдаленные метастазы.
Стандартная диагностика ПЭТ определяет метаболическую активность очага на основании поглощения введенного изотопа.
Метод способен выявить патологические очаги опухолевого характера при размере не менее 7 мм. В случаях, когда опухоль интенсивно поглощает радиофармацевтический препарат, выявляются образования размером от 3 мм.
На основании ПЭТ проводят прогнозирование течения заболевания, составляют план лучевой терапии, оценивают эффективность проведенного лечения, радикальность удаления новообразований при оперативных вмешательствах.
Виды радиоактивных препаратов для ПЭТ
Радиофармацевтические препараты позволяют изучить биологические процессы, протекающие в организме человека.
На основании полученных данных оценивается метаболизм глюкозы, кислорода, вторично-активный транспорт аминокислот, биосинтез белков. Выявляется тканевая гипоксия, определяется скорость разрастания опухолевых клеток.
Виды изотопов для томографии:
- 18 F-фтордезоксиглюкоза – используется для диагностики злокачественных новообразований, определения стадии и распространенности процесса. В кардиологической практике препарат с глюкозой назначается пациентам для оценки жизнеспособности миокарда перед оперативным вмешательством. У больных эпилепсией выявляет очаги гипометаболизма в головном мозге;
- 11 С-метионин – назначается для выявления рака головного мозга, множественной миеломы, опухолей лимфатической системы. Диагностирует патологию паращитовидных желез: аденому, карциному;
- 11 С-холин – применяют для диагностики заболеваний простаты: аденомы, раковой опухоли и ее метастазов. Выявляет гепатоцеллюлярный рак, проводит дифференцировку с доброкачественными образованиями;
- 18 F-фторид натрия – используют для выявления патологии костной системы в онкологии. Назначают для диагностики доброкачественных и злокачественных образований костей, посттравматических изменений, воспалительных и дегенеративно-дистрофических процессов.

Когда показано проведение ПЭТ
Метод ПЭТ, совмещенный с КТ, используют для поиска очагов патологического накопления изотопа, указывающего на развитие заболевания.
Процедуру проводят при отсутствии клинических симптомов, для отслеживания процесса в динамике и оценки лечебных мероприятий.
ПЭТ КТ показания к проведению диагностики:
- образования головы шеи: диагностика характера опухоли;
- новообразования щитовидной железы: выявление дифференцированной и медуллярной карциномы со стадией процесса;
- злокачественные образования легкого: крупноклеточный рак, плоскоклеточный рак, аденокарцинома;
- рак верхних отделов ЖКТ – поражение пищевода и желудка;
- рак нижних отделов ЖКТ – поражение толстой кишки;
- рак поджелудочной железы;
- опухолевые заболевания лимфатической ткани: лимфогранулематоз, неходжкинские лимфомы;
- злокачественное новообразование молочной железы;
- злокачественные опухоли кожи – меланома;
- образования костей и мягких тканей;
- новообразования мочеполового тракта;
- опухоли головного мозга;
- неврологические заболевания, вызванные возникновением патологических очагов в веществе головного мозга (височная и вневисочная эпилепсия);
- заболевания головного мозга, связанные с поражением и тромбозом сосудов: ишемический и геморрагический инсульт, стеноз сонной артерии;
- травматические повреждения головного мозга: оценка объема и степени поражения мозгового вещества в ранний и поздний посттравматический период;
- дегенеративные и дистрофические заболевания головного мозга: болезни Альцгеймера, Хантингтона, Паркинсона.
Противопоказания к исследованию
При направлении на диагностику, с помощью анамнеза и дополнительных клинических исследований выявляют состояния пациента, которые служат абсолютным либо относительным противопоказанием к томографии.
К ПЭТ не допускаются лица:
- дети до 18 лет;
- беременные женщины вне зависимости от срока гестации;
- пациенты, страдающие сахарным диабетом в субкомпенсированной или декомпенсированной форме;
- с выраженным болевым синдромом, затрудняющим неподвижное положение во время процедуры;
- больные с ожирением, масса тела которых превышает допустимые технические нормы томографа;
- с эмфиземой легких.
В индивидуальном порядке рассматривается вопрос о пользе и целесообразности диагностики пациентов в тяжелом, бессознательном состоянии.
Лица с психическими и двигательными расстройствами, с фобией ограниченного пространства проходят томографию после введения седативных средств.
Женщины в период лактации воздерживаются от грудного вскармливания на 3 дня после процедуры. Ребенка переводят на молочные адаптированные смеси, молоко сцеживается.
Ограничения к диагностике:
- томография проводится не ранее чем через 30-90 дней после хирургических вмешательств. Исключение составляют случаи, когда требуется выявление отдаленных метастазов из первичного опухолевого очага;
- больным, которым назначена химиотерапия, процедуру проводят до лечения, либо через 30 дней после завершения курса;
- если имеются результаты ПЭТ-КТ, проведенного до начала химиотерапии, повторную диагностику, для оценки действия препаратов на опухолевый процесс проводят через 7 дней после окончания введения химиотерапевтических средств;
- пациентам, прошедшим курс лучевой терапии, процедуру назначают через 90 дней.
Подготовка пациента к процедуре
К проведению томографии с радиофармпрепаратами пациент готовится за 6-12 часов до диагностики. Исключается прием пищи, газированных напитков, сладких соков.
Отменяются лекарства, содержащие глюкозу. Больной отказывается от физических нагрузок, избегает переутомления и стрессовые факторы.
Больного укладывают на кушетку в положении лежа на спине. Радиофармпрепарат вводят с помощью шприца либо автоматического дозатора.
Затем инфузионно вливают 500 мл 0,9% NaCl, при томографии головного мозга – 20 мл 0,9% NaCl. После введения препарата пациента оставляют в неподвижном положении с закрытыми глазами в затемненном помещении на 30-60 минут. За это время происходит распределение средства и уравнивание концентрации в органах и тканях.
Запрещается пользоваться мобильным телефоном, разговаривать, жевать жевательную резинку, напрягать мышцы. Перед сканированием пациента просят помочиться, либо катетеризируют мочевой пузырь.
Прохождение диагностики
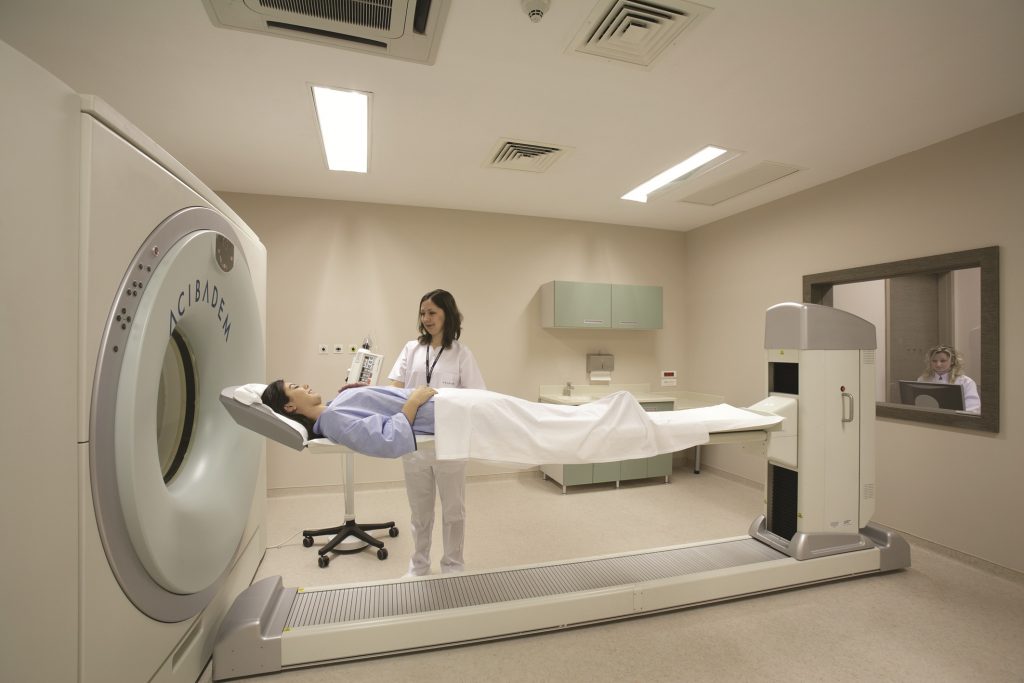
Пациент располагается на выдвижном столе и погружается внутрь томографа. Положение – лежа на спине с отведенными за голову руками.
На первом этапе проводится низкодозовое КТ-сканирование запланированной области либо всего тела. Затем приступают к ПЭТ-диагностике.
Сначала сканируют область таза, чтобы избежать появления артефактов от мочевого пузыря, наполняющегося мочой.
Длительность процедуры колеблется от 10 минут для диагностики головного мозга, до 70 минут для полного обследования тела.
При изучении головного мозга через 180 минут после введения радиофармпрепарата проводят повторную отсроченную диагностику.
По окончании томографии пациент помещается в комнату отдыха на 40-60 минут для снижения уровня излучения.
После процедуры врач дает рекомендации по употреблению жидкости в объеме 1500-2000 мл в сутки и соблюдению мер радиационной безопасности.
Заключение и результаты прохождения томографии
Информация, полученная при томографии, поступает на рабочую станцию, где проходит обработку. Врач радиоизотопной диагностики описывает снимки, фиксирует данные на диск, составляет протокол и заключение.
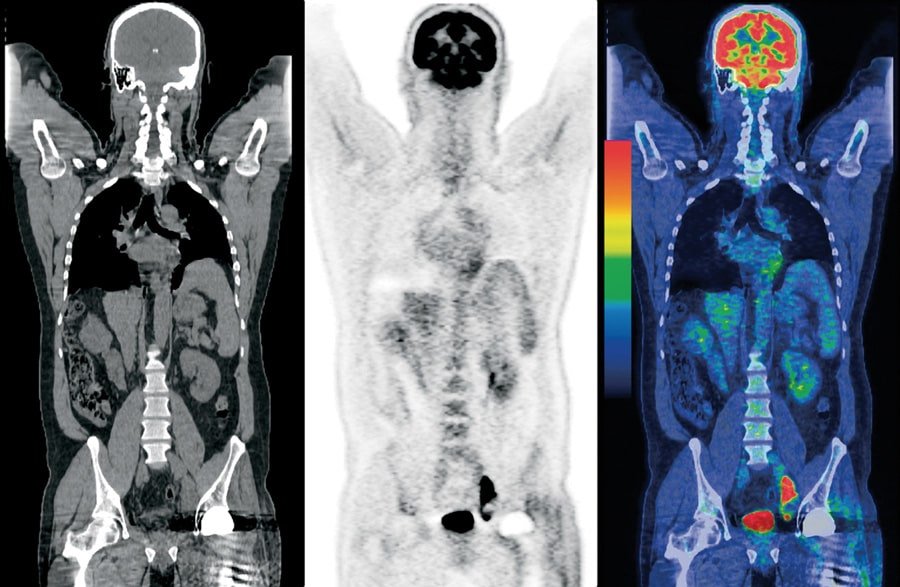

Расшифровка и анализ диагностических изображений занимает от трех до десяти дней. Пациент получает результаты ПЭТ и КТ на диске, флеш-карте, либо в виде файла, отправленного на электронную почту.
Осложнения и побочные эффекты
Нежелательные явления, которые могут возникнуть при проведении ПЭТ, связаны с введением контрастного радиофармацевтического препарата.
Отмечаются в 10-20% случаев. Больным с аллергическими реакциями в анамнезе, делают премедикацию перед томографией.
При развитии последствий в виде тяжелых системных осложнений проводят неотложную интенсивную терапию.
· повреждение кожи, сосудистой стенки, гематомы;
· абсцесс, некроз подлежащих тканей;
· коллапс, потеря сознания, кардиогенный шок;
· острая почечная недостаточность;
· отек легких, астматический статус;
Учитывая радиоактивное излучение, исходящее от исследуемого, пациентам рекомендуется после процедуры избегать беременных и кормящих женщин, детей, места скопления людей. В течение двух часов к указанной категории лиц запрещено приближаться более чем на 1 метр.
Лучевая нагрузка на пациента
Совокупность облучения, полученного от рентгеновских лучей при КТ и от введенного радиофармацевтического препарата, составляет величину лучевой нагрузки на пациента.
Без учета отсроченных сканирований, доза облучения при полной диагностике тела не превышает 10-13 мЗв. Такая дозировка считается не безопасной и наносит вред организму.
| Эффективные дозы облучения при введении 1 МБк радиофармацевтического препарата (ФДГ) | |
| Дети 0-12 мес. | 0,13 мЗв |
| Дети 1-5 лет | 0,073 мЗв |
| Дети 5-10 лет | 0,047 мЗв |
| Дети 10-15 лет | 0,032 мЗв |
| Взрослые | 0,027 мЗв |
Примечание: Для полной диагностики тела требуется 370-400 МБк РФП.
Цена диагностики
Процедура ПЭТ, совмещенная с КТ, относится к дорогостоящим методам диагностики. Пациент выплачивает стоимость радиоактивного препарата, томографии, отсроченное ПЭТ-сканирование, диск и снимки с изображениями.
Средняя цена за процедуру составляет 60-80 тыс. руб. Отдельные клиники предлагают программу скидок 10-25% на второй и последующий сеансы диагностики.
Информативность ПЭТ, приближенная к 100% и чувствительность 97-98% позволяет за одну процедуру выяснить характер заболевания.
Правильный подход к методике определяет верный выбор ведения больных и плана лечения, от которых зависит здоровье и жизнь пациента.
Дороговизна ПЭТ оправдывает набор и ценность диагностической информации, которую невозможно получить любым другим известным способом.
Видео
В медицинской диагностике проходит много времени, прежде чем новая технология визуализации становится пригодной для клинической практики. Для правильной интерпретации изображения необходимо немало дополнительных исследований. На этом этапе сейчас находится позитронно-эмиссионная томография (ПЭТ). В клинической практике ПЭТ используется с начала 1990-ых и в отличие от классических методов (таких как компьютерная и магнитно-резонансная томография), позволяющих получать только изображения анатомических структур и изменений в них, ПЭТ позволяет проводить количественный анализ биохимических или физиологических функций. Эта информация часто позволяет выявить функциональные изменения, вызванные заболеванием, задолго до появления каких-либо морфологических изменений. В частности ПЭТ – единственный аппарат, позволяющий диагностировать опухоль на "нулевой" стадии.
2. Историческая справка
Методика ПЭТ отображения является комбинацией двух изобретений, представленных к Нобелевской премии – радиоактивного индикатора и принципов томографии. В период с середины 40-х до начала 1950-х интерес к радиоактивным индикаторам был небольшим. Возможно, причиной стало открытие в 1940 Каменом и Рубеном , более универсального и эффективного атома, чем . История ПЭТ началась в 1950-ых, когда появилась возможность отображения позитрона, испускающего нуклиды: фотоны с высокой энергией, произведенные при уничтожении позитрона, можно использовать для описания физиологического 3D распределения химического состава. В середине 1950-ых, Терпогосян выдвинул идею, что, несмотря на короткое время полураспада этих радионуклидов, они пригодны для изучения регионального метаболизма.
Первый прототип ПЭТ сканера появился в 1952 году Массачусетском госпитале после 6 месяцев разработки конструкции. Он имел всего лишь два детектора на основе йодистого натрия расположенных друг напротив друга и позволял получать изображения, основанные как на обнаружении совпадения событий, так и на дисбалансе. Дисбаланс одноканальных детекторов использовался для создания изображения на основе регистрации любого дисбаланса между каналами детекторов. Разрешение было низким, но чувствительность устройства все же позволяла обнаружить опухоль и ее пространственное положение относительно срединной линии мозга. С середины 1950-ых до начала 1970-ых радионуклиды использовались мало. С начала 1970-ых испускающие позитрон радионуклиды стали популярны и интерес к ПЭТ исследованиям возрос. Были созданы сложные алгоритмы реконструкции и усовершенствованы датчики. В 1980х ПЭТ стал использоваться для динамических исследований метаболизма человека. На развитие технологии ПЭТ повлияли три фактора:
1) большинство метаболических процессов в теле происходят достаточно быстро, чтобы следить за ними с помощью короткоживущих радионуклидов;
2) несмотря на короткое время жизни изотопов, стала возможна быстрая радиоактивная маркировка сложных молекул;
3) проникающее излучение, возникающее при уничтожении позитронов, показало, что можно локализовать эти позитроны.
Первые ПЭТ сканеры с множеством детекторов были созданы в начале1960-ых в нескольких исследовательских центрах и представляли собой системы с кольцом из 32 датчиков и разрешением более 2 см, позволяющие получать единичные срезы. Это позволило повысить чувствительность метода и получить двумерное изображение. В следующем поколении ПЭТ сканеров, появившемся в 1968 году был уменьшен размер датчика и добавлены дополнительные кольца, позволяющие одновременно получать несколько срезов с разрешением менее 1 см.Такие сканеры позволяли получать двумерные изображения срезов головного мозга; третья координата обнаруженных опухолей определялась по положению соответствующего среза.
В 1970 году для обработки полученных данных было предложено использовать алгоритм обратного проецирования. В конце 1970-ых ПЭТ сканеры стали использоваться для проведения коммерческих исследований. Разрабатывались новые сканеры с большим числом датчиков для увеличения чувствительности и разрешения. После многих лет исследований, в Университете штата Пенсильвания было создано устройство, названное PENN-ПЭТ. Оно состояло из множества позитронных датчиков, расположенных вокруг отверстия для пациента в виде шестиугольника диаметром 50 см. PENN – ПЭТ давал высокую чувствительность и разрешение 5,5 мм и был менее сложен и дорог, чем системы с кольцом детекторов.
Дальнейшее усовершенствование ПЭТ-сканеров состоит в повышении пространственного разрешения, чувствительности детекторов, увеличении числа одновременно получаемых срезов, коррекции аттенюации и разработке новых алгоритмов реконструкции изображений. Хотя в последние 20 лет ПЭТ использовалась преимущественно для научных исследований, ее роль как метода диагностики находится на стадии становления. В настоящее время основными областями клинического применения ПЭТ являются онкология, кардиология, неврология.
3. Этапы исследования и основные блоки сканера
Любое ПЭТ исследование состоит из нескольких основных этапов:
1. производство радиоизотопа;
2. маркировка выбранного состава испускающим позитроны радионуклидом и подготовка состава в форме, пригодной для воздействия на людей;
3. транспортировка состава из лаборатории к месту проведения исследования;
4. воздействие радиоактивного индикатора и получение данных ПЭТ;
5. отображение распределения активности позитрона как функции времени, обработка данных;
6. интерпретация результата.
Система производства радиоизотопов состоит из трех основных частей:
- циклотрона (ускорителя частиц);
- биологического синтезатора, присоединяющего радиоизотопы к
- компьютера, контролирующего процесс.
До начала исследования в циклотроне производится радиоактивное вещество, входящее в естественный химический состав тела (атомы кислорода, углерода, азота) и распадающееся с испусканием позитронов.
Циклотрон (циклический ускоритель) состоит из двух полых полукруглых металлических электродов (дуантов), расположенных между полюсами электромагнита и разделенных узким зазором. Вблизи от центра дуантов располагается источник ионов (как правило электрическая дуга в газе), который служит генератором заряженных частиц. В момент работы, частицы импульсно генерируются источником ионов. Нить накала, расположенная в источнике ионов создает отрицательный заряд путем присоединения электронов к атому.
Схема движения частиц в циклотроне:
1 – источник тяжелых заряженных частиц (протонов, ионов); 2 – орбита ускоряемой частицы; 3 – ускоряющие электроды (дуанты); 4 – генератор ускоряющего поля
Магнитное поле направлено перпендикулярно плоскости рисунка.
При попадании отрицательных ионов в вакуумную камеру они приобретают энергию благодаря высокочастотному переменному электрическому полю, индуцированному на дуантах. Ионы подвергаются воздействию электрического поля и сильного магнитного поля, генерируемого электромагнитом. Когда отрицательные ионы долетают до края дуанта и влетают в зазор, РЧ-осциллятор меняет полярность на дуантах и ионы отталкиваются по мере входа в ранее положительно, а теперь отрицательно заряженный дуант. С каждым проходом зазора, энергия и радиус орбиты частиц возрастают и частицы двигаются по спирали. При достижении максимальных значений на последнем витке спирали включается отклоняющее электрическое поле, выводящее пучок наружу. Поток отрицательных ионов направляется к первой карусели, расположенной между ускорителями и камерой мишени. Карусели состоят из тонких угольных пластин, которые отделяют оба электрона от ионов , которые становятся ионами или протонами. Протоны проходят через пластину, однако, несмотря на смену заряда на противоположный, они все еще находятся под влиянием магнитного поля, двигаются по циркулярной орбите, по касательной к своей прежней траектории, от центра циклотрона. Этот поток протонов направляется к камере мишени. Разделяющие пластины имеют толщину от 5 до 25 μм и имеют срок службы порядка 100 часов.
Протонный пучок из циклотрона влетает в камеру мишени и путем ядерной реакции преобразует стабильный материал мишени (стабильный химический изотоп) в радиоактивный изотоп.
Произведенные на циклотроне радиоизотопы переносятся в биосинтезатор, где они присоединяются к используемым в клинике химическим составам, за распределением которых в теле хотят проследить. Естественно встречающиеся в органических составах атомы заменяются маркированными (химически и биологически идентичными оригиналу). В ПЭТ маркируемы химические составы, ограничены воображением исследователей и временем полураспада. Чаще всего в роли маркируемого вещества выступает глюкоза.
Вся работа системы производства радиоизотопов, включая циклотрон и биосинтезатор, управляется компьютером. Оператор выбирает из меню на консоли управления требуемый для производства изотоп, а остальные процессы проводятся автоматически. Для проведения исследования малое количество радиоактивного препарата (радионуклида) внутривенно вводят пациенту, радионуклид поступает в клетки и распределяется в них. Спустя некоторое время его концентрация в тканях измеряется сканером, достаточно чувствительным для обнаружения даже небольшого количества радиоактивного состава.
При распаде радиоактивного вещества происходит выброс (эмиссия) положительных частиц (позитронов), стабилизирующая ядро за счет устранения положительного заряда путем превращения протона в нейтрон. Позитрон проходит короткое расстояние (зависящее от его энергии) перед столкновением с электроном окружающей среды (рис. 53). Происходит объединение позитрона с электроном среды (аннигиляция), частицы "уничтожают" друг друга, и их масса преобразуется в энергию, приводя к эмиссии двух противоположно направленных (180°±0,25°) гамма-лучей (фотонов высокой энергии) с энергией 511 кэВ каждый.
Эмиссия гамма лучей
Данные фотоны, испущенные в результате аннигиляции, выходят за пределы тела и регистрируются внешними детекторами. Регистрируемые после аннигиляции гамма -лучи называются линией совпадения и используются для определения локализации и концентрации эмитента позитрона, которая зависит от биохимической и физиологической реакции органа. Когда гамма-лучи взаимодействуют с кристаллами сцинтиллятора, фотоны света преобразуются электронными устройствами томографа в электрические сигналы. Процессы конвертации и регистрация происходят практически мгновенно друг за другом, для того чтобы можно было сравнивать события сцинтилляции с противоположных детекторов (вдоль большого количества линий совпадений).
Гентри ПЭТ сканера:
А - цилиндрический источник для коррекции аттенюации, В - септа, С - детекторные блоки
Основным блоком ПЭТ сканера является гентри, внутри которого расположены детекторы Множество детекторов образует кольцо диаметром 80-100 см и шириной 10-20 см. Для снижения влияния внешнего излучения, наружная поверхность кольца детекторов имеет свинцовый экран. Большинство сканеров может работать как в посрезовом режиме, когда аксиальная коллимация создается тонкими вольфрамовыми кольцами называемыми септами, так и в трехмерном режиме, когда септа втягивается и совпадение регистрируется между всеми возможными парами детекторов.
Детекторы являются самими важным компонентами ПЭТ сканера. В ряде случаев они похожи на используемые в однофотонном отображении: большие кристаллы йодистого натрия соединенные с фотоумножителями. В коммерческих томографах детекторы конструктивно представляют собой прямоугольную группу кристаллов (блок), т.к. более плотное расположение детекторов позволяет снизить потери пространственного разрешения и регистрации фотонов. Использование множества регистрирующих кристаллов предотвращает оптическую дисперсию света между отдельными элементами блока.
Сцинтилляционные детекторы (рис.), используемые в ПЭТ, состоят из сцинтиллятора, фотоэлектронного умножителя и электронной системы. Сцинтиллятором называют вещество, благодаря которому возникают флуоресцентные световые вспышки при испускании высокоэнергетического излучения (например, бета- или гамма-лучей).
Быстрые заряженные частицы, двигаясь в веществе, теряют свою энергию при столкновении с атомами, причем энергия частиц расходуется на ионизацию и возбуждение атомов среды. Возбуждение атомов снимается в основном путем испускания квантов света характерной для данного вещества частоты. Обычно излучение, возникающее при этом, поглощается в той же среде. Только в люминесцирующих средах часть высвеченной энергии может выйти за пределы среды.
Схема сцинтилляционного детектора:
1 – сцинтиллятор; 2 – фотокатод; 3 – диафрагма; 4 – корпус фотоумножителя; 5 – диноды; 6 – анод; 7 – делитель напряжения
Процесс люминесценции может осуществляться двумя путями. Если переходы из возбужденных энергетических состояний в основное разрешены, испускание света происходит в соответствии со средним временем жизни возбужденного состояния по обычным статистическим законам и называется флуоресценцией. Если переход из возбужденного состояния в основное запрещен, то возникает метастабильное состояние, среднее время жизни которого может быть значительно больше времени жизни обычного возбужденного состояния. В этом случае для испускания кванта света система должна перейти в более высокое энергетическое состояние, переход из которого в основное разрешен. Такой процесс называют фосфоресценцией.
Основными характеристиками сцинтилляторов являются конверсионная эффективность, спектр излучения и время высвечивания.
Конверсионная эффективность – это отношение энергии световой вспышки, к энергии, потерянной заряженной частицей в сцинтилляторе, зависящее от типа и качества сцинтиллятора. Количество света, испускаемое сцинтиллятором, характеризуется световым выходом – отношением энергии среднего числа фотонов люминесценции к энергии, потерянной ионизирую – щей частицей в сцинтилляторе.
Т.к. световая вспышка сцинтиллятора регистрируется при помощи фотоэлектронного умножителя, область спектральной чувствительности которого лежит в диапазоне длин волн видимого света, то спектр частот, излучаемых сцинтиллятором, должен укладываться в чувствительной области ФЭУ. В большинстве случаев интенсивность вспышки I с течением времени t спадает по экспоненциальному закону:
Величина τ – время, в течение которого интенсивность падает в е раз, характеризует длительность свечения и называется временем высвечивания сцинтиллятора. Основные свойства сцинтилляторов определяются механизмом возбуждения и высвечивания. С этой точки зрения удобно разделить все известные сцинтиллирующие вещества на три группы: кристаллофосфоры или неорганические кристаллы (например, ZnS, NaI), органические кристаллы (например, антрацен, стильбен), инертные газы. В медицине чаще всего используются сцинтилляторы в виде таллиевого кристалла, активированного йодидом натрия. В решетке такого кристалла при взаимодействии атомов и ионов происходит возмущение энергетических уровней внешних электронов, что приводит к образованию чередующихся разрешенных и запрещенных областей. В обычных условиях нижние энергетические зоны кристалла заняты полностью (валентная зона), а более высокие – целиком не заполнены и электроны в них могут свободно перемещаться (зона проводимости), не получая дополнительной энергии. Самая верхняя валентная зона отделена от наиболее низкой зоны проводимости интервалом в несколько эВ. При возбуждении электроны переходят из валентной зоны в зону проводимости, образуя в валентной зоне электронную вакансию – дырку. При обратном переходе электронов из зоны проводимости в валентную зону возникает излучение с характерным для данного кристалла спектром – собственное излучение.
Схема энергетических зон в неорганическом кристалле
При наличии в кристалле примесей, в запрещенной зоне могут возникать локальные энергетические уровни, лежащие вблизи валентной зоны. Если эти уровни не заняты, то на них могут попасть электроны, движущиеся в зоне проводимости. Если переход с этих уровней в валентную зону разрешен (люминесцентные центры), то возникает излучение, длина волны которого больше, чем в спектре поглощения. Таким образом, примеси сдвигают спектр излучения в сторону увеличения длин волн и к увеличению интенсивности свечения. Вместе с этим примеси создают дефекты в кристаллической решетке, и создают дополнительные метастабильные уровни, прямой переход с которых в валентную зону запрещен. Электроны с этих уровней могут перейти в зону проводимости при поглощении ими тепловой энергии колебаний решетки, а затем попасть в люминесцентные центры. Это приводит к замедленному испусканию фотонов (фосфоресценции).
Фотоэлектронный умножитель (ФЭУ) – это фотоэлемент с многократным усилением, основанным на явлении вторичной эмиссии. ФЭУ состоит из фотокатода, фокусирующего устройства, нескольких эмиттеров (динодов) и анода.
В фотоумножителях часто применяется сурьмяно-цезиевый фотокатод, активированный кислородом. Фотокатод нанесен в виде тонкого полупрозрачного слоя на внутреннюю сторону торцовой стенки стеклянного баллона ФЭУ, диаметром 15 мм. Эмиттеры и анод изготовлены из металла. Для увеличения коэффициента вторичной эмиссии σ (среднего числа вторичных электронов, выбиваемых одним первичным электроном) эмиттеры покрыты пленкой вещества с малой работой выхода электронов. В ФЭУ электроны ускоряются и фокусируются с помощью электростатического поля, определяемого конфигурацией электродов и распределением потенциалов в них. Для подачи напряжения на электроды используется делитель, состоящий из омических сопротивлений. К концам делителя приложено напряжение Uk (800-1500 В) от источника высокого напряжения.
Световые кванты, падающие на фотокатод, вызывают фотоэффект. Возникшие при этом фотоэлектроны попадают в электрическое поле, ускоряются и фокусируются на первом эмиттере(диноде). При ударах электронов о первый эмиттер происходит вторичная эмиссия. Выбитые электроны ускоряются в следующем межэлектродном промежутке и, попадая на второй эмиттер, вызывают в свою очередь вторичную эмиссию со второго и т.д.Таким образом, число электронов от эмиттера к эмиттеру лавинообразно нарастает. Электроны с последнего эмиттера собираются на аноде фотоумножителя. Если σ-коэффициент вторичной эмиссии на каждом эмиттере, то коэффициент усиления умножителя
В 1931 году Ворбург обнаружил, что злокачественные опухоли отличаются повышенным уровнем потребления глюкозы. В 1977 году Соколов предложил измерять локальный уровень метаболического потребления глюкозы в мозгу крыс с помощью дезоксиглюкозы меченой радиоактивным изотопом углерода. Фелпс в 1979 году предложил измерять тот же параметр у людей с помощью дезоксиглюкозы меченой радиоактивным изотопом фтора 18 F (фтородезоксиглюкозы). Фтородезоксиглюкоза (ФДГ) является аналогом глюкозы на нескольких этапах ее метаболизма, но, в отличие от глюкозы, метаболизм ФДГ прекращается преждевременно и ее продукт накапливается в тканях. Радиоактивный 18 F (T = 109 мин) распадается, испуская позитрон, b + . Эти работы и заложили основы позитронной эмиссионной томографии.
Позитроны (b + ) - положительно заряженные электроны. Они излучаются из ядра некоторых радиоизотопов, являющихся нестабильными, так как те имеют избыточное число протонов и несут положительный заряд.
Позитронная эмиссия стабилизирует ядро за счет устранения положительного заряда путем превращения протона в нейтрон. За счет этого, один элемент превращается в другой, атомное число последнего на единицу меньше, чем у исходного. Для изотопов, использующихся при позитронно-эмиссионной томографии, элемент, образующий в результате позитронного распада является стабильным (не радиоактивным). Все радиоизотопы, использующиеся в ПЭТ распадаются путем позитронной эмиссии. Позитрон (b + ), испущенный распадающимся ядром, проходит короткое расстояние прежде чем столкнуться с электроном близлежащего атома.
Аннигиляция позитрон-электронной пары в диагностической установке ПЭТ.
В процессе ПЭТ-исследования позитрон-эмиттирующий радиоизотоп вводится пациенту внутривенно или путем ингаляции. После этого, изотоп циркулирует в кровяном русле и достигает, например ткани головного мозга или сердечной мышцы. Как только происходит аннигиляция, томограф регистрирует локализацию изотопа и вычисляет его концентрацию. Линия, которая возникает после аннигиляции отражает собой эмиссию двух гамма-лучей, с энергией 511 кэВ направленных приблизительно на 180 градусов (противоположно) друг по отношению к другу. Работа томографа заключается в том, чтобы регистрировать эти лучи, означающие, что позитронная аннигиляция произошла где-то на данной линии совпадения.
Когда гамма-лучи с энергией 511 кэВ взаимодействуют с кристаллами сцинтиллятора они преобразуются в фотоны света.
Пространственное и временное распределение эмитирующего позитрон радиоизотопа зависит от того как сканируемый орган реагирует на него биохимически и физиологически. В данном случае отображаются события позитронной аннигиляции и происходящие следствие этого эмиссии гамма-лучей.

Кольцеобразное расположение детекторов вокруг анализируемого объекта.
Детекторы кольцеобразно располагаются вокруг исследуемого объект. Томограф быть оборудован пятнадцатью (а то и больше) такими кольцами для одновременной томографии нескольких поперечных срезов.
Каждый детектор может работать режиме регистрации совпадений со множеством расположенных напротив детекторов. Таким образом, существует возможность определения совпадений на нескольких углах (расходящийся пучок). Также, при любом заданном угле, может быть определено множество выборок, что приводит к увеличению "линейной выборки". Это все вносит вклад в качество изображений на выходе.
Линейная выборка в схеме совпадений.
При наличии объекта исследования гетерогенной структуры с неоднородным распределением источника позитронного излучения детекторы регистрируют радиационное поле, интенсивность которого изменяется в пространстве и/или времени.
Компьютер решает обратную задачу – переход от пространственного распределения интенсивности (скорости счета детекторов) гамма-поля к пространственному распределению источников излучения – молекул меченого радионуклидом зонда (сначала – в плоскости сканирования, а затем – во всем пространстве (по данным всех пятнадцати колец). При наличии центров повышенной абсорбции зонда (очагов поражения) осуществляется локализация таких центров (находятся все три пространственные координаты очагов), рассчитываются его размеры и форма и находится концентрация зонда в очаге (в динамических вариантах выдается зависимость количества зонда в очаге от времени). При наличии нескольких близкорасположенных очагов, заслоняющих друг друга, предпринимаются специальные меры по улучшения пространственного разрешения методики.
В ПЭТ используются соединения, меченые 11 С, Т = 20,4 мин.; 13 N, T = 10,0 мин.; 15 O, T = 2,1 мин.; 18 F, T = 109 мин.; 82 Rb, T = 1,25 мин. Все они короткоживущие и синтез на их основе меченых веществ представляет собой сложную задачу. Ввиду того, что радионуклид 18 F - один из наиболее удобных для клинического использования, то на его основе синтезируется самый обширный класс фармпрепаратов для ПЭТ, среди которых - самое используемое соединение.
Пространственное разрешение характеризует способность ПЭТ-сканера различать на малом расстоянии два точечных либо линейных радиоактивных источника. Оценку пространственного разрешения проводят по ширине пика функции чувствительности на половине его высоты (FWHM) в измерениях с использованием точечного радиоактивного источника малой активности на воздухе без рассеяния:

где: К - константа, зависящая от применяемого алгоритма реконструкции;
С, р, s, b - факторы, связанные соответственно с неколлинеарностью аннигиляционных фотонов (отклонения от угла 180°), длиной пробега позитрона от точки эмиссии до точки аннигиляции, размером индивидуального детектора и блоковой конструкцией детекторов, обусловливающей погрешность локализации совпадений из-за статистических флюктуаций сигналов фотоэлектронного умножителя, рассеяния излучения в детекторе и несовершенства схемы блокового декодирования.
Факторы С (неколлинеарность аннигиляционных фотонов) и p (длина пробега позитрона от точки эмиссии до точки аннигиляции), входящие в формулу , описывают физические ограничения пространственного разрешения индивидуального детектора. Так, если суммарный импульс системы электрон-позитрон в момент аннигиляции не равен нулю, аннигиляционные фотоны неколлинеарны, в соответствии с законом сохранения импульса. Погрешность в определении координаты из-за отклонения от угла в 180° при аннигиляции фотонов, описываемая фактором С, будет тем больше, чем больше диаметр детекторного кольца (d): С = 0,0022d. Так, при увеличении величины d от 80 до 90 см пространственное разрешение ухудшается с 1,5 мм до 2 мм.
Фактор р в свою очередь зависит от энергии позитронов и атомного номера вещества, с которым они взаимодействуют. Так для позитронов, излучаемых 18F и 82Rb с максимальной энергией соответственно 640 и 3350 кэВ, длина пробега в водноэквивалентном веществе составляет менее 1 мм и ~10 мм, а величина поправки на пробег позитронов 0,2 мм и 2,6 мм соответственно.

Различные методы сканирования в трансмиссионной КТ


В 1931 году Ворбург обнаружил, что злокачественные опухоли отличаются повышенным уровнем потребления глюкозы. В 1977 году Соколов предложил измерять локальный уровень метаболического потребления глюкозы в мозгу крыс с помощью дезоксиглюкозы меченой радиоактивным изотопом углерода. Фелпс в 1979 году предложил измерять тот же параметр у людей с помощью дезоксиглюкозы меченой радиоактивным изотопом фтора 18 F (фтородезоксиглюкозы). Фтородезоксиглюкоза (ФДГ) является аналогом глюкозы на нескольких этапах ее метаболизма, но, в отличие от глюкозы, метаболизм ФДГ прекращается преждевременно и ее продукт накапливается в тканях. Радиоактивный 18 F (T = 109 мин) распадается, испуская позитрон, b + . Эти работы и заложили основы позитронной эмиссионной томографии.
Позитроны (b + ) - положительно заряженные электроны. Они излучаются из ядра некоторых радиоизотопов, являющихся нестабильными, так как те имеют избыточное число протонов и несут положительный заряд.
Позитронная эмиссия стабилизирует ядро за счет устранения положительного заряда путем превращения протона в нейтрон. За счет этого, один элемент превращается в другой, атомное число последнего на единицу меньше, чем у исходного. Для изотопов, использующихся при позитронно-эмиссионной томографии, элемент, образующий в результате позитронного распада является стабильным (не радиоактивным). Все радиоизотопы, использующиеся в ПЭТ распадаются путем позитронной эмиссии. Позитрон (b + ), испущенный распадающимся ядром, проходит короткое расстояние прежде чем столкнуться с электроном близлежащего атома.
Аннигиляция позитрон-электронной пары в диагностической установке ПЭТ.
В процессе ПЭТ-исследования позитрон-эмиттирующий радиоизотоп вводится пациенту внутривенно или путем ингаляции. После этого, изотоп циркулирует в кровяном русле и достигает, например ткани головного мозга или сердечной мышцы. Как только происходит аннигиляция, томограф регистрирует локализацию изотопа и вычисляет его концентрацию. Линия, которая возникает после аннигиляции отражает собой эмиссию двух гамма-лучей, с энергией 511 кэВ направленных приблизительно на 180 градусов (противоположно) друг по отношению к другу. Работа томографа заключается в том, чтобы регистрировать эти лучи, означающие, что позитронная аннигиляция произошла где-то на данной линии совпадения.
Когда гамма-лучи с энергией 511 кэВ взаимодействуют с кристаллами сцинтиллятора они преобразуются в фотоны света.
Пространственное и временное распределение эмитирующего позитрон радиоизотопа зависит от того как сканируемый орган реагирует на него биохимически и физиологически. В данном случае отображаются события позитронной аннигиляции и происходящие следствие этого эмиссии гамма-лучей.
Кольцеобразное расположение детекторов вокруг анализируемого объекта.
Детекторы кольцеобразно располагаются вокруг исследуемого объект. Томограф быть оборудован пятнадцатью (а то и больше) такими кольцами для одновременной томографии нескольких поперечных срезов.
Каждый детектор может работать режиме регистрации совпадений со множеством расположенных напротив детекторов. Таким образом, существует возможность определения совпадений на нескольких углах (расходящийся пучок). Также, при любом заданном угле, может быть определено множество выборок, что приводит к увеличению "линейной выборки". Это все вносит вклад в качество изображений на выходе.
Линейная выборка в схеме совпадений.
При наличии объекта исследования гетерогенной структуры с неоднородным распределением источника позитронного излучения детекторы регистрируют радиационное поле, интенсивность которого изменяется в пространстве и/или времени.
Компьютер решает обратную задачу – переход от пространственного распределения интенсивности (скорости счета детекторов) гамма-поля к пространственному распределению источников излучения – молекул меченого радионуклидом зонда (сначала – в плоскости сканирования, а затем – во всем пространстве (по данным всех пятнадцати колец). При наличии центров повышенной абсорбции зонда (очагов поражения) осуществляется локализация таких центров (находятся все три пространственные координаты очагов), рассчитываются его размеры и форма и находится концентрация зонда в очаге (в динамических вариантах выдается зависимость количества зонда в очаге от времени). При наличии нескольких близкорасположенных очагов, заслоняющих друг друга, предпринимаются специальные меры по улучшения пространственного разрешения методики.
В ПЭТ используются соединения, меченые 11 С, Т = 20,4 мин.; 13 N, T = 10,0 мин.; 15 O, T = 2,1 мин.; 18 F, T = 109 мин.; 82 Rb, T = 1,25 мин. Все они короткоживущие и синтез на их основе меченых веществ представляет собой сложную задачу. Ввиду того, что радионуклид 18 F - один из наиболее удобных для клинического использования, то на его основе синтезируется самый обширный класс фармпрепаратов для ПЭТ, среди которых - самое используемое соединение.
Пространственное разрешение характеризует способность ПЭТ-сканера различать на малом расстоянии два точечных либо линейных радиоактивных источника. Оценку пространственного разрешения проводят по ширине пика функции чувствительности на половине его высоты (FWHM) в измерениях с использованием точечного радиоактивного источника малой активности на воздухе без рассеяния:

где: К - константа, зависящая от применяемого алгоритма реконструкции;
С, р, s, b - факторы, связанные соответственно с неколлинеарностью аннигиляционных фотонов (отклонения от угла 180°), длиной пробега позитрона от точки эмиссии до точки аннигиляции, размером индивидуального детектора и блоковой конструкцией детекторов, обусловливающей погрешность локализации совпадений из-за статистических флюктуаций сигналов фотоэлектронного умножителя, рассеяния излучения в детекторе и несовершенства схемы блокового декодирования.
Факторы С (неколлинеарность аннигиляционных фотонов) и p (длина пробега позитрона от точки эмиссии до точки аннигиляции), входящие в формулу , описывают физические ограничения пространственного разрешения индивидуального детектора. Так, если суммарный импульс системы электрон-позитрон в момент аннигиляции не равен нулю, аннигиляционные фотоны неколлинеарны, в соответствии с законом сохранения импульса. Погрешность в определении координаты из-за отклонения от угла в 180° при аннигиляции фотонов, описываемая фактором С, будет тем больше, чем больше диаметр детекторного кольца (d): С = 0,0022d. Так, при увеличении величины d от 80 до 90 см пространственное разрешение ухудшается с 1,5 мм до 2 мм.
Фактор р в свою очередь зависит от энергии позитронов и атомного номера вещества, с которым они взаимодействуют. Так для позитронов, излучаемых 18F и 82Rb с максимальной энергией соответственно 640 и 3350 кэВ, длина пробега в водноэквивалентном веществе составляет менее 1 мм и ~10 мм, а величина поправки на пробег позитронов 0,2 мм и 2,6 мм соответственно.

Различные методы сканирования в трансмиссионной КТ
К стандартным методам диагностики относится УЗИ, МРТ, КТ, которые широко используются в разных направлениях медицины, позволяют с высокой точностью провести оценку внутренних органов и систем, выявить малейшие изменения в их работе. Помимо основных методик, на практике часто назначается позитронно-эмиссионная томография (ПЭТ), которая обладает высокой информативностью, позволяет обнаружить даже те опухоли, которые только начинают свое развитие и не визуализируются другими исследованиями. Применяется в разных областях медицины, является основой для постановки заключительного диагноза, позволяет врачу составить план лечения.
Позитронно-эмиссионная томография, что это такое?
Позитронно эмиссионная томография (ПЭТ) – метод ядерной медицины с применением радионуклидных препаратов. Принцип работы томографа основан на использовании высокотехнологичного оборудования и радиоактивных частиц, которые входят в состав радиофармпрепаратов (РФП) используемых во время обследования имеющие определенную тропность (склонность) накапливаться в тех или иных тканях. Разные РФП проникают в те или иные ткани и органы, и позволяют получить четкую картинку исследуемых органов, выявить нормальные и патологические процессы.
Позитронный томограф проводит запись исследуемого органа, после чего сравнивает их с нормальными показателями. В процессе исследования аппарат определяет отклонения на уровне метаболизма, проводит цифровую съёмку больного органа, определяет степень изменения различных физиологических (обменных) процессов. Методика способна заменить ряд других обследований, но имеет достаточно высокую стоимость, а само оборудование присутствует не во всех клиниках и диагностических центрах.
ПЭТ томография относится к передовым методам, позволяет обнаружить болезнь даже тогда, когда человек не испытывает никаких симптомов, что позволяет вовремя провести лечение, повысить шансы на полное выздоровление.
В период обследования в организм вводят РФП с различными изотопами:
- 11С-холином;
- 18F-фтордезоксиглюкозой;
- 11С-метионином;
- 13N-аммонием.
После их проникновения в организм, излучают положительно-заряженную частицу (позитрон), который сталкивается с электроном. При их взаимодействии происходит аннигиляция (уничтожение) и формируются 2 разнонаправленных гамма кванта. Датчики томографа улавливают эти кванты, передают на компьютер, после чего проводится расшифровка данных и по разности скоростей определяют глубину залегания. Чем больше из одной точки исходит гамма квантов, тем более интенсивные биохимические процессы там протекают.
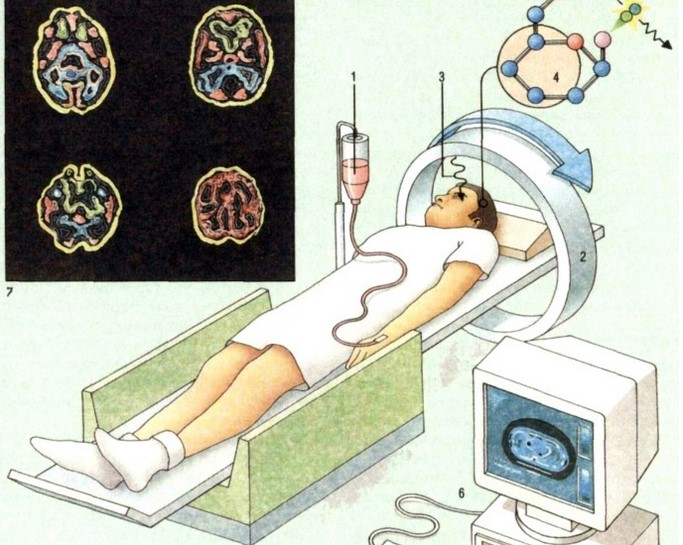
Что показывает ПЭТ?
Обследование ПЭТ позволяет распознать изменения в организме на клеточном уровне, провести оценку структур органа, получить подробную информацию о патологическом процессе, распознать опухоли от 5-6 мм и другие нарушения с наибольшей тщательностью. В зависимости от исследуемой области и направления медицины, данный вид исследования позволяет определить следующие клинические состояния:
- стадия злокачественности;
- размер и локализация опухоли;
- разновидность образования;
- метастазы и их распространение;
- оценка результатов химиотерапии или лучевой терапии.
- области с нарушенным кровообращением;
- тромбы, закупорки крупных и мелких сосудов;
- динамика после лечения инфаркта.
- расположение и злокачественность внутричерепных опухолей;
- эпилептические участки;
- изменения в сосудах.
Томографы фиксируют отклонения в клеточном строении внутренних органов, позволяют определить метастазы при раке, измеряют поток крови и множество других параметров, позволяющих оценить состояние здоровья.

Показания и противопоказания к ПЭТ
ПЭТ томография показана при подозрении на серьезные патологии. Применяется в разных отраслях медицины, но широкое распространение получило при следующих состояниях:
- Онкология – опухоли головного мозга в разных отделах, метастазы. Обнаруживает даже те образования, которые не видны на КТ или МРТ;
- кардиология – перед проведением операции шунтирования или стентирования сосудов сердца;
- гастроэнтерология – подозрение на болезни-опухоли печени, кишечника или поджелудочной железы;
- неврология – патологии позвоночника и головного мозга, определяет ишемию, контроль над кровотоком, выявление эпилептогенных очагов.
Позитронно-эмиссионная томография распознает метастазы на самых ранних стадиях, что позволяет вовремя провести лечение. Процедура незаменима в диагностике злокачественных опухолей головного мозга, часто используется при лимфоме, меланоме и других онкологических заболеваниях.
Медицинское обследование способно провести оценку любого органа. Показанием к назначению процедуры выступает подозрение на следующие состояния и заболевания:
- болезнь Альцгеймера;
- первичные или вторичные опухоли головного мозга;
- болезнь Паркинсона;
- нарушение функциональности органов ЖКТ;
- увеличение лимфатических узлов (для исключения метастазов);
- нарушение кровообращения;
- саркома;
- меланома;
- приступы эпилепсии.
Диагностика может назначаться и при других болезнях, чаще назначается после МРТ, КТ, УЗИ и других методов, когда врач не получил полную клинику болезни или у него остались сомнения по поводу постановки диагноза.
Не назначается обследование при следующих состояниях и заболеваниях:
- период беременности и лактации;
- опасные инфекционные болезни;
- биопсия, проведенная накануне;
- воспалительный процесс в организме.
Перед назначением обследования врач должен исключить противопоказания, подробно ознакомить пациента с техникой проведения и другими особенностями.

Подготовка к позитронно-эмиссионной томографии
Перед прохождением ПЭТ, врач дает рекомендации по подготовке, это поможет повысить результаты обследования, исключить искажение результатов:
- за 2-3 дня до процедуры исключить употребление алкоголя, сладкую газированную воду;
- пройти тест на чувствительность к контрасту;
- соблюдать низкоуглеводную диету с высоким содержанием клетчатки;
- отказаться от копченостей, жирной и острой пищи;
- уменьшить количество белковой пищи;
- за 1-2 дня исключить физические нагрузки.
Перед обследованием врач собирает анамнез, изучает историю болезни пациента. Если человек принимает какие-либо препараты, об этом нужно сообщить врачу, также больным с сахарным диабетом накануне обследования необходимо измерить уровень глюкозы в крови. Рекомендуют исключить из рациона белки животного и растительного происхождения, не принимать витамины группы В и аскорбиновую кислоту.
Позитронно эмиссионная томография всего тела или отдельных органов допускает легкий ужин перед обследованием, но лучше проходить процедуру натощак. Дополнительные рекомендации по подготовке пациент получит от врача, который дает направление на диагностику.
Как проходит ПЭТ?
Перед процедурой рекомендуется выполнить несколько условий, что также поможет повысить эффективность обследования:
- Одежда должна быть свободной, не сдавливать и не сковывать движения.
- Снять все украшения, металлические предметы;
- Взять с собой 1 литр негазированной воды.
Обследование проводится в специальном кабинете с томографом. Пациенту внутривенно, перорально или методом ингаляции вводят раствор контраста, укладывают на кушетку томографа. Доза РФП определяется врачом индивидуально для каждого пациента, зависит от исследуемой области, возраста, массы тела пациента. Стол томографа перемещается в сканер. Если пациент волнуется, испытывает страх, ему вводят седативный лекарственный препарат.
Длительность процедуры составляет 20-60 минут. Пациент в это время должен лежать неподвижно, поскольку любые движения при сканировании способны исказить результаты. После прохождения обследования рекомендуется как можно больше пить воды, это поможет ускорить выведение радиоактивных изотопов из организма.
Полученные снимки анализируют на предмет патологических отклонений в работе отдельного органа или целого организма. Получить заключение можно через 1-3 дня после прохождения обследования.
Диагностика полностью безболезненна, проводится при помощи современного оборудования под контролем опытного специалиста, имеет высокую стоимость, но позволяет определить малейшие изменения в организме, тем самым повысить эффективность терапии.
Читайте также:

