Элементы 14 iva группы кратко
Обновлено: 04.07.2024
В 14 группу входят C, Si, Ge, Sn, Pb (табл. 1 и 2). Как и элементы 3А подгруппы, это p -элементы со сходной электронной конфигурацией внешней оболочки – s 2 p 2 . При перемещении вниз по группе атомный радиус возрастает, вызывая ослабление свзяи между атомами. Из-за усиливающейся делокализации электронов внешних атомных оболочек в этом же направлении возрастает электропроводность, поэтому свойства элементов изменяются от неметаллических к металлическим. Углерод ( С ) в форме алмаза является изолятором (диэлектриком), Si и Ge – полуметаллы, Sn и Pb – металлы и хорошие проводники.
Таблица 1. Некоторые физические и химические свойства металлов 14 группы
Относит, ат. масса
Углерод Carbon [от лат. carbo — уголь]
ковалентный 77 при двойной связи 67, при тройной связи 60
Кремний Silicon [от лат. silicis — кремень]
Германий Germanium [от лат. Germania — Германия]
[Ar]3d 10 4s 2 4p 2
Олово Tin [от англо-сакс. tin, лат. stannum]
[Kr]4d 10 5s 2 5p 2
Свинец Lead [от англо-сакс. lead, лат. plumbum]
[Xe]4f 14 5d 10 6s 2 6р 2
Свойства элементов этой группы позволили использовать их в качестве противоводорослевых покрытий (ПП) судов. В первых таких покрытиях использовали Pb, затем стали применять Sn (в виде бис-трибутилового оловоорганического радикала, связанного с углеродным полимером). Из экологических соображений в 1989 г. использование в ПП этих, а также других токсичных металлов (Hg, Cd, As) запретили, заменив на ПП на основе кремнийорганических полимеров.
Таблица 2. Содержание в организме, токсическая (ТД) и летальная дозы (ЛД) металлов 14 группы
В человеческом организме
Среднее (при массе тела 70 кг)
обычно нетоксичен, но в виде СО и цианидов CN очень токсичен
ТД 2 г, ЛД нд, некоторые оловоорганич. соединения очень токсичны
ТД 1 мг, ЛД 10 г
Углерод (С) – отличается от всех других элементов так называемой катенацией, то есть способностью образовывать соединения, в которых его атомы связаны друг с другом в длинные цепи или кольца. Это свойство объясняет образование миллионов соединений, называемых органическими, которым посвящен отдельный раздел химии – органическая химия.
Способность углерода к катенации объясняется несколькими особенностями:
Во-первых, прочностью связи С - С. Так, средняя энтальпия этой связи составляет около 350 кДж/моль, тогда как энтальпия связи Si - Si — только 226 кДж/моль.
Во-вторых, уникальной способностью атомов углерода к гибридизации: образованию 4 sр 3 -орбиталей с тетраэдрической ориентацией (обеспечивающих формирование простых ковалентных связей), или 3 sр 2 -орбиталей, ориентированных в одной плоскости (обеспечивающих образование двойных связей), или 2 sр-орбиталей с линейной ориентацией (обеспечивающих образование тройных связей).
Таким образом, углерод может образовывать 3 типа координационного окружения: линейную у двух- и трехатомных молекул, когда КЧ элемента равно 2, плоскотреугольную у молекул графита, фуллеренов, алкенов, карбонильных соединений, бензольного кольца, когда КЧ равно 3, и тетраэдрическую у алканов и их производных с КЧ = 4.
В природе углерод встречается в виде аллотропных, то есть различных структурных форм (графит, алмаз, фуллерены), а также в виде известняка и углеводородного сырья (угля, нефти и газа). Используется в виде кокса при выплавке стали, сажи в полиграфии, активированного угля при очистке воды, сахара и т.п.
В 2010 г. присуждена Нобелевская премия по физике за изучение уникальной формы С - графена. Лауреатам - выходцам из России - А. Гейму и К. Новосёлову удалось получить этот материал из графита. Он представляет собой двумерный кристалл, то есть похож на сетку из атомов С толщиной в один атом, волнообразной структуры, что обеспечивает устойчивость кристалла. Его свойства очень многообещающие: он является самым тонким прозрачным материалом из всех ныне известных, притом чрезвычайно прочным (примерно в 200 раз прочнее стали), обладает электро- и теплопроводностью. При комнатной температуре его электрическое сопротивление самое минимальное среди всех известных проводников. В недалёком будущем на основе графена будут созданы сверхскоростные компьютеры, плоскопанельные экраны и солнечные батареи, а также чувствительные газовые детекторы, реагирующие на несколько молекул газа. Не исключены и другие сферы его использования.
В форме оксида (СО) и цианидов (СN – ) углерод очень токсичен, поскольку нарушает процессы дыхания. Механизмы биологического действия у этих соединений разные. Цианид ингибирует дыхательный фермент цитохромоксидазу, быстро связываясь с Си — активным центром фермента, блокируя электронный поток на конечном участке дыхательной цепи. СО, будучи основанием Льюиса, связывается с атомом Fe в молекуле гемоглобина прочнее, чем O2, образуя карбонилгемоглобин, лишенный способности связывать и переносить O2. Способность СО образовывать координационные связи с d-металлами в низких степенях окисления приводит к образованию многообразных карбонильных соединений. Например, Fe в очень ядовитом веществе — пситакарбопиле Fe(CO)5 — имеет нулевую степень окисления, а в комплексе [Fe(CO)4] 2– — степень окисления -2 (рис. 1).
Рис. 1. Строение пентакарбонила Fe
Стабилизация атома металла в низкой степени окисления в комплексах с СО объясняется способностью углерода выступать благодаря структуре низко расположенных р*-орбиталей в роли акцепторного лиганда. Эти орбитали перекрываются с занятыми орбиталями металла, образуя координационную р-связь, в которой металл выступает донором электронов. Это одно из немногих исключений из общего правила образования КС, где акцептором электронов является металл.
Нет смысла описывать свойства углерода более подробно, поскольку при многоэлементном анализе его, как правило, не только не определяют, но и считают его примесь в образце нежелательной и подлежащей максимальному удалению при пробоподготовке. При оптическом эмиссионном анализе он даёт очень широкий спектр, повышая шумовой фон и снижая тем самым предел чувствительности обнаружения определяемых элементов. При масс-спектрометрии органические молекулы образуют большое количество осколков молекул с разной молекулярной массой, дающих значительные помехи при анализе. Поэтому в подавляющем большинстве случаев все углеродсодержащие вещества при пробоподготовке удаляют.
Кремний (Si) — полуметалл. При восстановлении кремнезема (SiО2) углеродом образуется черный аморфный Si. Кристаллы Si высокой чистоты напоминают серо-голубой металл. Кремний применяют в полупроводниках, сплавах и полимерах. Он важен для некоторых форм жизни, например, для построения оболочек у диатомовых водорослей; возможно, имеет значение и для организма человека. Некоторые силикаты канцерогенны, некоторые вызывают силикоз.
Во всех соединениях Si четырехвалентен, образует химические связи ко-валентного характера. Наиболее распространен диоксид SiO2. Несмотря на химическую инертность и нерастворимость в воде, при попадании в организм может образовывать кремниевые кислоты и кремнийорганические соединения с неявно выраженными биологическими свойствами. Токсичность SiO2 зависит от дисперсности частиц: чем они мельче, тем токсичнее, хотя корреляции между растворимостью различных форм SiO2 и силикогенностью не наблюдается. Связь токсичности кремниевых кислот именно с Si доказывает полная инертность пыли алмаза той же дисперсности.
В последнее время отмечено, что в биосредах кремниевые кислоты участвуют в формировании гидроксилалюмосиликатов, причем это явление нельзя объяснить ни связью Si-С, ни связью Si-О-С. По мере расширения промышленного использования Аl и его соединений посредством алюмосиликатов Аl все шире вовлекается во множество биохимических реакций. В частности, функциональные кислород- и фторсодержащие группы легко образуют высокоустойчивые комплексные соединения с Аl, извращая их метаболизм.
Наиболее изучены среди кремнийорганических соединений силиконы — полимеры, скелет молекулы которых состоит из чередующихся связанных между собой атомов Si и O2. К атомам Si в силиконах присоединены алкильные или арильные группы. Наличие Si в кремнийорганических соединениях кардинально меняет свойства веществ, когда они его не содержат. Например, обычные полисахариды можно выделить и очистить с помощью крепкого этанола, который осаждает полисахарид из раствора. Кремнийсодержащие углеводы, напротив, не осаждаются даже в 90% этаноле. Классификация кремнийорганических соединений представлена в табл. 3.

Неметаллами в группе IVA Периодической системы Д.И. Менделеева являются углерод C, кремний Si. Кроме того, в нее входят германий Ge, олово Sn и свинец Pb.
На внешнем энергетическом уровне всех этих элементов находятся 4 электрона (конфигурации ns 2 np 2 ), наиболее характерные степени окисления — +2 и +4. В органических соединениях углерод может проявлять степени окисления от –4 до +4. С увеличением атомного номера возрастают радиусы нейтральных атомов, уменьшается энергия ионизации, ослабевают неметаллические свойства элементов и усиливаются металлические. Так, углерод и кремний — типичные неметаллы, а олово и свинец — металлы.
Некоторые физические характеристики этих элементов приведены в таблице 5.

С увеличением атомного номера ослабевают неметаллические свойства элементов и усиливаются металлические.
Для углерода известны стабильные аллотропные модификации (графит, алмаз), в виде которых он встречается в природе, а также полученные лабораторным путем карбин и фуллерены. Кремний получают восстановлением его оксида магнием или углеродом в электрических печах, а кремний высокой чистоты — восстановлением SiCl4 цинком или водородом, например:

Кремний может существовать в кристаллической или аморфной форме. Для кремния наиболее устойчива степень окисления +4.
Ниже приведены уравнения реакций, общие для углерода и кремния (Э = C, Si):

В реакциях с другими простыми и сложными веществами свойства углерода и кремния отличаются. Реакции, характерные для углерода:

Карбиды щелочных и щелочноземельных металлов являются ацетелинидами, т. е. при их взаимодействии с водой или кислотами образуется ацетилен, например:

Карбид алюминия относят к метанидам: при его взаимодействии с водой или кислотами выделяется метан:

Реакции, характерные для кремния:

Углерод и кремний образуют кислотные оксиды общей формулы ЭО2, а также летучие водородные соединения общей формулы ЭН4.
Свойства оксида углерода (IV):

Оксиду углерода (IV) соответствует очень слабая двухосновная угольная кислота H2CO3, которая не существует в чистом виде. Она образует два ряда солей: средние — карбонаты, например карбонат кальция CaCO3, и кислые — гидрокарбонаты, например Ca(HCO3)2 — гидрокарбонат кальция.
Карбонаты переходят в гидрокарбонаты под действием избытка углекислого газа в водной среде:

Гидрокарбонат кальция превращается в карбонат под действием гидроксида кальция:

Гидрокарбонаты и карбонаты разлагаются при нагревании:

Карбонаты ряда металлов (алюминия, железа (III), хрома (III) не существуют. При попытке их получения реакциями обмена образуются углекислый газ и гидроксид соответствующего металла, например:

Свойства оксида кремния (IV):

Кремний образует кислоты переменного содержания SiO2 и H2O. Соединение состава H2SiO3 в чистом виде не выделено, но для упрощения допускается его запись в уравнениях реакций:
Ключевые слова конспекта: углерод, кремний, элементы IVA-группы, свойства элементов, алмаз, графит, карбин, фуллерен.
Элементы IV группы – это углерод, кремний, германий, олово и свинец. Более подробно рассмотрим свойства углерода и кремния. В таблице приведены важнейшие характеристики этих элементов.
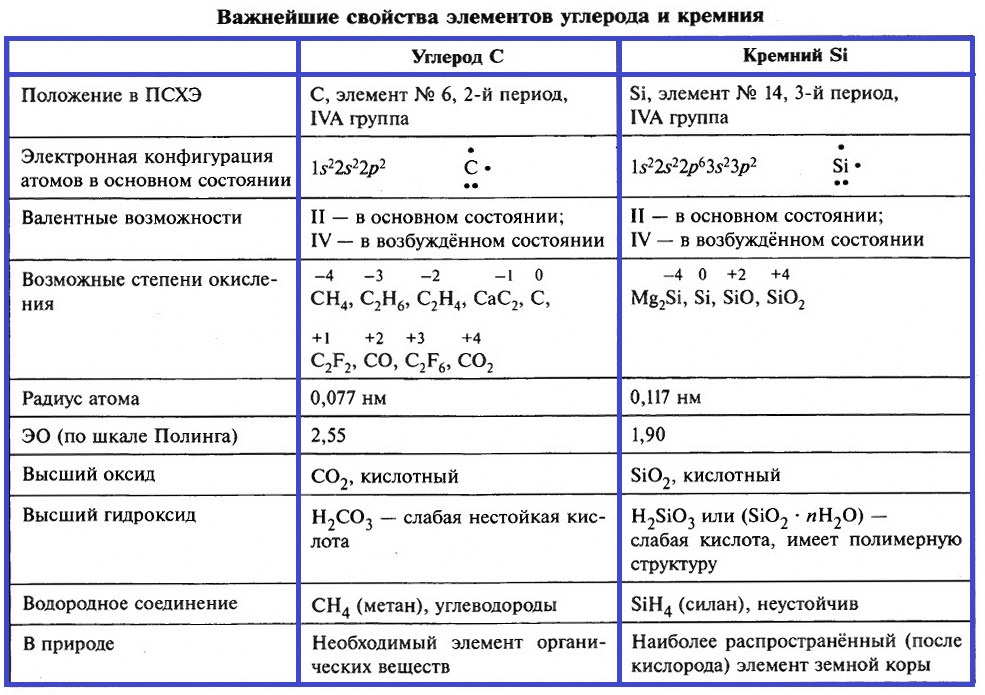

Почти во всех своих соединениях, углерод и кремний четырёхвалентны, их атомы находятся в возбуждённом состоянии. Конфигурация валентного слоя атома углерода при возбуждении атома меняется:

Аналогично меняется конфигурация валентного слоя атома кремния:
На внешнем энергетическом уровне атомов углерода и кремния находится 4 неспаренных электрона. Радиус атома кремния больше, на его валентном слое имеются вакантные 3d–орбитали, это обусловливает отличия в характере связей, которые образуют атомы кремния.
Степени окисления углерода меняются в интервале от –4 до +4.
Характерной особенностью углерода является его способность образовывать цепи: атомы углерода соединяются друг с другом и образуют устойчивые соединения. Аналогичные соединения кремния неустойчивы. Способность углерода к цепеобразованию обусловливает существование огромного числа органических соединений.
К неорганическим соединениям углерода относятся его оксиды, угольная кислота, карбонаты и гидрокарбонаты, карбиды. Остальные соединения углерода являются органическими.
Для углерода–элемента характерна аллотропия, его аллотропными модификациями являются алмаз, графит, карбин, фуллерен. Сейчас известны и другие аллотропные модификации углерода.
Уголь и сажу можно рассматривать как аморфные разновидности графита.
Кремний образует простое вещество – кристаллический кремний. Существует аморфный кремний – порошок белого цвета (без примесей).
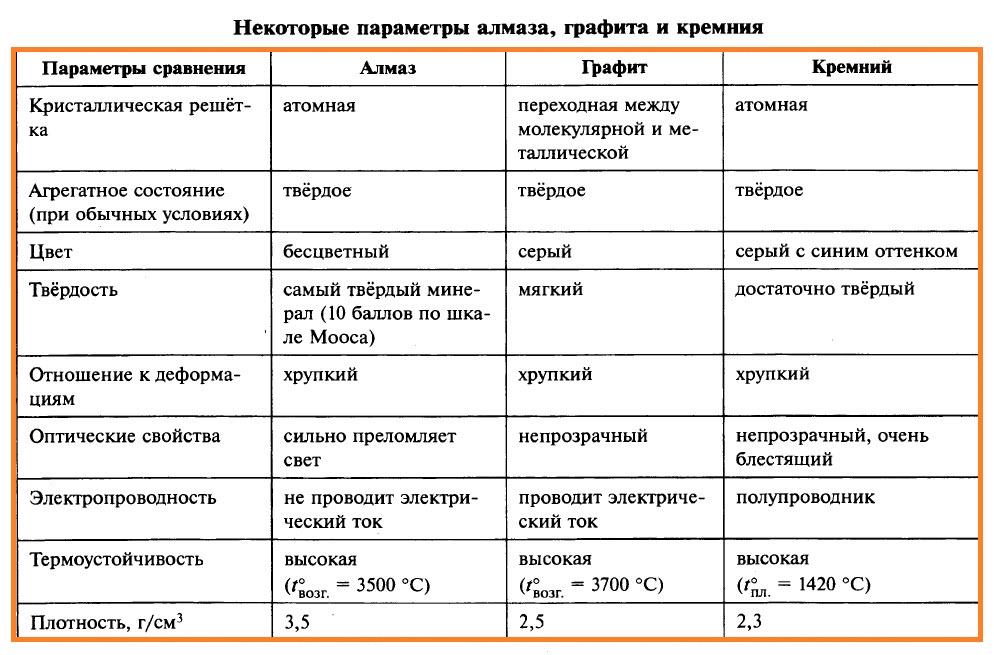
Свойства алмаза, графита и кристаллического кремния приведены в таблице.
Причина явных отличий в физических свойствах графита и алмаза обусловлена различным строением кристаллической решётки. В кристалле алмаза каждый атом углерода (исключая те, которые находятся на поверхности кристалла) образует четыре равноценные прочные связи с соседними атомами углерода. Эти связи направлены к вершинам тетраэдра (как в молекуле СН4). Таким образом, в кристалле алмаза каждый атом углерода окружён четырьмя такими же атомами, располагающимися в вершинах тетраэдра. Симметричность и прочность С–С-связей в кристалле алмаза обусловливают исключительную прочность и отсутствие электронной проводимости.
В кристалле графита каждый атом углерода образует три прочные равноценные связи с соседними атомами углерода в одной плоскости под углом 120°. В этой плоскости образуется слой, состоящий из плоских шестичленных колец.
Кроме того, каждый атом углерода имеет один неспаренный электрон. Эти электроны образуют общую электронную систему. Связь между слоями осуществляется за счёт относительно слабых межмолекулярных сил. Слои расположены один относительно другого таким образом, что атом углерода одного слоя находится над центром шестиугольника другого слоя. Длина связи С–С внутри слоя составляет 0,142 нм, расстояние между слоями – 0,335 нм. В результате связи между слоями гораздо менее прочны, чем связи между атомами внутри слоя. Это обусловливает свойства графита: он мягок, легко расслаивается, имеет серый цвет и металлический блеск, электропроводен и химически более активен, чем алмаз. Модели кристаллических решёток алмаза и графита изображены на рисунке.

Возможно ли превратить графит в алмаз? Такой процесс осуществим в жёстких условиях – при давлении примерно 5000 МПа и при температуре от 1500 °С до 3000 °С в течение нескольких часов в присутствии катализаторов (Ni). Основную массу продукции составляют небольшие кристаллы (от 1 до нескольких мм) и алмазная пыль.
Карбин – аллотропная модификация углерода, в которой атомы углерода образуют линейные цепи типа:
–С≡С–С≡С–С≡С– (α–карбин, полиин) или =С=С=С=С=С=С= (β–карбин, полиен)
Расстояние между этими цепями меньше, чем между слоями графита, за счёт более сильного межмолекулярного взаимодействия.
Карбин представляет собой чёрный порошок, является полупроводником. Химически он более активен, чем графит.
Фуллерен – аллотропная модификация углерода, образованная молекулами С60, С70 или С84. На сферической поверхности молекулы С60 атомы углерода располагаются в вершинах 20 правильных шестиугольников и 12 правильных пятиугольников. Все фуллерены представляют собой замкнутые структуры из атомов углерода. Кристаллы фуллерена относятся к веществам с молекулярным строением.
Кремний. Существует только одна устойчивая аллотропная модификация кремния, кристаллическая решётка которой подобна решётке алмаза. Кремний – твёрдое, тугоплавкое (t°пл = 1412 °С), очень хрупкое вещество тёмно-серого цвета с металлическим блеском, при стандартных условиях – полупроводник.
Общая характеристика элементов 4 группы главной подгруппы
От С к Pb (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 4 электрона на внешнем слое ns 2 np 2 :
С – 2s 2 2p 2
Si – 3s 2 3p 2
Ge – 4s 2 4p 2
Sn – 5s 2 5p 2
Pb – 6s 2 6p 2
Углерод и кремний

Нахождение в природе углерода и кремния
Углерод в природе распространен и в виде простых веществ (алмаз, графит), и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).

Кремний — второй по распространенности элемент на Земле после кислорода. Чаще всего в природе кремний встречается в виде соединений на основе SiO2 (речной и кварцевый песок, кварц и кварциты, кремень, полевые шпаты), силикатов и алюмосиликатов.

Углерод
Химические свойства углерода
Качественные реакции
- Обнаружить карбонат-ионы CO3 2- — можно при помощи взаимодействия солей-карбонатов с сильными кислотами. При этом выделяется углекислый газ — газ без цвета и запаха, не поддерживающий горение:
- Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок CaCO3 растворяется:
- Углекислый газ СО2не поддерживает горение.
- Угарный газ CO горит голубым пламенем.

Взаимодействие углерода с простыми веществами
С кислородом
Горит в недостатке кислорода с образованием угарного газа:
в избытке кислорода – с образованием углекислого газа:
С галогенами (F, Cl, Br, I)
Углерод реагирует со фтором при нагревании до 900ºС с образованием фторида углерода (IV):
Раскаленный углерод реагирует с другими галогенами:
С водородом
При нагревании в присутствии катализатора (Ni) углерод взаимодействует с водородом с образованием метана:
С серой
При сильном нагревании углерод взаимодействует с серой с образованием сероуглерода:
С азотом
С азотом углерод реагирует при действии электрического разряда, образуя дициан:
С углеродом
При нагревании около 2000 о С кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами углерод выступает в качестве окислителя, образуя карбиды:
Взаимодействие со сложными веществами
С водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
С кислотами
Углерод как восстановитель взаимодействует с кислотами-окислителями:
С концентрированной азотной кислотой
C концентрированной серной кислотой:
С солями
В расплавах KNO3 и NaNO3 измельченный уголь интенсивно сгорает:
С оксидами
Углерод взаимодействует с многими основными и амфотерными оксидами, с образованием металла и угарного газа:
C + 2ZnO → 2Zn + CO
Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
При взаимодействии углерода с оксидами активных металлов образуются карбиды:
3С + СаО → СаС2 + СО
Кремний
Способы получения кремния
В промышленности основным сырьем для получения кремния служит кремнезем (диоксид кремния):
- Восстановление SiO2 углеродом в электропечах при температуре 1800ºС:
SiO2 + 2C → Si + 2CO
Таким способом получают технический кремний.
- Особо чистый кремний из технического продукта получают следующим образом:
В лаборатории кремний можно получить:
- при прокаливании смеси металлического магния с мелко измельченным кремнеземом:
SiO2 + 2Mg → Si + 2MgO
- восстановление кремния из его оксида алюминием:
Химические свойства кремния
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами.
При этом выделяется белый гелеобразный осадок:

Взаимодействие кремния с простыми веществами
С кислородом
Взаимодействует с кислородом при температуре более 400°С с образованием диоксида кремния:
С галогенами (F, Cl, Br, I)
При обычных условиях кремний реагирует только со фтором с образованием фторида кремния (IV):
С остальными галогенами реакция идет при нагревании до 300-500ºС:
С водородом
Не взаимодействует
С серой
При температуре выше 600°С кремний взаимодействует с серой с образованием сульфида кремния:
С азотом
С азотом кремний реагирует в очень жестких условиях:
С углеродом
При нагревании около 2000 о С кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами кремний выступает в качестве окислителя, образуя силициды:
Взаимодействие кремния со сложными веществами
С водой
Непосредственно с водой не взаимодействует, однако аморфный кремний реагирует с перегретым водяным паром при температуре 400-500°С:
С кислотами
- Кремний не взаимодействует с водными растворами кислот.
- Аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
- При обработке кремния безводным HF комплекс не образуется:
- Кремний растворяется в смеси концентрированных азотной и плавиковой кислот (травление кремния кислотами):
С водными растворами щелочей
В водных растворах щелочей при нагревании выше 60ºС кремний растворяется с образованием солей силикатов (травление щелочами):
С оксидами
При восстановлении SiO2 кремнием при температурах свыше 1200 ºC образуется оксид кремния (II) — SiO.
Читайте также:

