Четвертичная структура определение кратко
Обновлено: 02.07.2024
Третичная структура (или трёхмерная структура) — пространственное строение (включая конформацию) всей молекулы белка или другой макромолекулы, состоящей из единственной цепи.
Сигнальный пептид, или сигнальная последовательность, — короткая (от 3 до 60 аминокислот) аминокислотная последовательность в составе белка, которая обеспечивает котрансляционный или посттрансляционный транспорт белка в соответствующую органеллу (ядро, митохондрия, эндоплазматический ретикулум, хлоропласт, апопласт или пероксисома). После доставки белка в органеллу сигнальный пептид может отщепляться под действием специфической сигнальной протеазы.
Флагеллин — бактериальный белок, который способен самоорганизовываться в полые цилиндрические структуры, образующие филаменты бактериальных жгутиков. Это главный компонент жгутиков и представлен в больших количествах у всех жгутиковых бактерий. Флагеллин является лигандом для рецептора врождённой иммунной системы TLR5.
Остаток в биохимии и молекулярной биологии — структурная единица биополимера, состоящего из аминокислот и сахаров; часть мономера, которая остаётся неизменной после включения его в биополимер. Например, остатками принято называть аминокислотные звенья, входящие в состав пептида. Остатки уже не являются аминокислотами, так как в результате реакции конденсации, они утратили по одному атому водорода из аминогруппы и гидроксил, входящий в состав карбоксильной группы. Кроме того, остатками также считаются.
Упоминания в литературе
Четвертичная структура (или субъединичная, доменная) – взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Многие белки с особо сложным строением состоят из нескольких полипептидных цепей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка.
Молекула белка является полимером, который состоит из большого количества повторяющихся единиц мономеров. Мономеры белка аминокислоты (их 20) соединены между собой пептидными связями, образуя полипептидную цепь (первичную структуру белка). Она закручивается в спираль, образуя, в свою очередь, вторичную структуру белка. Благодаря определенной пространственной ориентации полипептидной цепи возникает третичная структура белка, которая определяет специфичность и биологическую активность молекулы белка. Несколько третичных структур, объединяясь между собой, образуют четвертичную структуру .
Наконец, четвертичная структура возникает в том случае, если функциональный белок собирается из нескольких отдельных полипептидных цепей (см. рис. 3.7Б). Если белок состоит из одной полипептидной цепи, значит, четвертичной структуры у него нет. Взаимодействия, создающие четвертичную структуру, те же самые, что и в третичной структуре, только не внутри одной полипептидной цепи, а между разными цепями.
Белковые молекулы представляют собой длинные цепочки-полимеры. Мономерами (составными частями) белка являются аминокислоты. Из 20 входящих в состав белков аминокислот 12 синтезируются в организме – заменимые аминокислоты, а 8 не синтезируются – незаменимые аминокислоты, которые должны поступать в организм с пищей. 2 незаменимые аминокислоты присутствуют только в животной пище. Биосинтез белков происходит во всех клетках организма, из отдельных аминокислот с участием ДНК и РНК. Полипептидные цепи подвергаются многоступенчатой обработке, в результате которой формируется третичная и четвертичная структура готовых белков. Белки используются внутри клетки или собираются (с участием эндоплазматического ретукулума и аппарата Гольджи) в мембранные пузырьки, выводимые из клеток при помощи процессов эк-зоцитоза.
Связанные понятия (продолжение)
В биохимии, димер — макромолекулярный комплекс, образованный двумя, как правило, не ковалентносвязаными макромолекулами, такими как белки или нуклеиновые кислоты. Белковый димер — это четвертичная структура белка.
Пальмитирование — это ковалентное присоединение к белку остатка одной из высших жирных кислот с образованием тиоэфирной связи. Чаще всего происходит присоединение пальмитиновой кислоты (откуда и название) к сера-содержащей аминокислоте, чаще всего цистеину, реже к серину или треонину. Обычно пальмитированию подвергаются мембранные белки, например молекулы поверхностных рецепторов. Роль пальмитирования в изменении функциональности того или иного белка зависит от конкретного белка.
Сигна́л я́дерной локализа́ции (англ. nuclear localization signal, NLS) — участок молекулы белка, необходимый и достаточный для его локализации в ядре клетки. Сигнал ядерной локализации — это место узнавания белка транспортными факторами — кариоферинами (транспортинами), которые осуществляют его перенос в ядро.
Интегральный мембранный белок (ИМБ, IMP или просто интегральный белок) — один из типов мембранных белков, которые прочно связаны с цитоплазматической мембраной (интегрированы). Они составляют значительную часть белков, закодированных в геноме любого организма. Интегральные белки могут быть погружены в мембрану полностью, а иногда даже пронизывают её насквозь. В этом смысле, все трансмембранные белки являются интегральными белками, но не все интегральные — трансмембранными. Связь интегральных белков.
Гибридный белок (англ. fusion protein, также химерный, составной белок) — белок, полученный объединением двух или более генов, изначально кодировавших отдельные белки. Трансляция гибридного гена приводит к синтезу белка, который может сочетать некоторые функциональные свойства обоих исходных белков.
Ядерные поры, или ядерные поровые комплексы, — крупные белковые комплексы, пронизывающие ядерную мембрану и осуществляющие транспорт макромолекул между цитоплазмой и ядром клетки. Переход молекул из ядра в цитоплазму и в обратном направлении называется ядерно-цитоплазматическим транспортом.
Экзонуклеазы — белки из группы нуклеаз, отщепляющие концевые мононуклеотиды от полинуклеотидной цепи путём гидролиза фосфодиэфирных связей между нуклеотидами.
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Клатрин (англ. clathrin) — внутриклеточный белок, основной компонент оболочки окаймлённых пузырьков, образующихся при рецепторном эндоцитозе.
Гликаны, в состав которых входят одинаковые углеводные звенья (гомополисахариды), называются гомогликанами, если цепь образована различными углеводными звеньями (гетерополисахариды) — гетерогликанами.
Липи́дные ра́фты — особые участки (микродомены) плазматической мембраны, обогащённые гликосфинголипидами и холестерином. Эти участки координируют клеточные процессы, влияют на текучесть мембраны, служат организующими центрами для сборки сигнальных молекул, регулируют перемещение мембранных белков, рецепторов, а также регулируют нейротрансмиссию. Липидные рафты более структурированы и упакованы плотнее, чем окружающий их липидный бислой; при этом они способны свободно в нём перемещаться.
Тубули́н — белок, из которого построены микротрубочки. В них, а также в цитоплазме клеток он находится в форме димера из одной молекулы α-тубулина и одной — β-тубулина. В составе такого димера к каждой молекуле тубулина присоединена молекула ГТФ. У каждой из этих субъединиц выделяют три домена. Форма γ-тубулина принимает участие в нуклеации микротрубочек, то есть образовании затравки, с которой начинается рост. Тубулин способен связывать в растворе молекулы ГТФ. Рост микротрубочек осуществляется.
Кальмодулин — небольшой, кислый, высококонсервативный кальций-связывающий белок, представитель суперсемейства белков EF-hand.
Аденозинтрифосфатазы (АТФ-азы) — группа ферментов класса гидролаз (КФ 3.6.1.3), катализирующих отщепление от аденозинтрифосфорной кислоты (АТФ) одного или двух остатков фосфорной кислоты с освобождением энергии, используемой в процессах мышечного сокращения, транспорта веществ через мембраны, биосинтеза различных соединений.
Железосерные кластеры (также Fe—S-кластеры) — элементоорганические соединения, группа белковых кофакторов, обладающих окислительно-восстановительным (Red/Ox) потенциалом в районе от −500 мВ до +300 мВ. Red/Ox-потенциал зависит от структуры и конформации белка, что делает эти кофакторы важнейшими участниками окислительно-восстановительных реакций в клетке. Железосерные кластеры способны принимать или отдавать электроны (см. рисунок). Белки, содержащие железосерные кластеры, являются эволюционно древними.
Тиоредоксины — семейство маленьких белков, представленный во всех организмах от архей до человека. Они участвуют во многих важных биологических процессах, включая определение окислительно-восстановительного потенциала клетки и передачу сигнала. У человека тиоредоксин кодируется геном TXN. Мутации, приводящие к потере функциональности даже одного аллеля этого гена, приводят к смерти на стадии четырёхклеточного эмбриона. Тиоредоксин играет значительную роль в организме человека, хотя и не до конца.
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
Рибонуклеазы (РНКазы, англ. Ribonuclease, RNase) — ферменты-нуклеазы, катализирующие деградацию РНК. Рибонуклеазы классифицируют на эндорибонуклеазы и экзорибонуклеазы. К рибонуклеазам относят некоторые подклассы КФ 2.7 и КФ 3.1.
Я́дерная лами́на — фибриллярная сеть жесткой структуры, подстилает ядерную мембрану (находится под ядерной мембраной), участвует в организации хроматина.
Кооперативность — это явление в биохимии, характерное для ферментов или рецепторов, которые имеют множественные сайты связывания. Также явление кооперативности отмечено для больших молекул, имеющих многие идентичные субъединицы (ДНК, белки, фосфолипиды), в момент, когда происходят фазовые переходы — плавление, разворачивание, расплетание.
Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру, в которой отношение длинной оси молекулы к короткой (степень асимметрии) составляет от 80 до 150. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу и высокорегулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Первичная и вторичная структура фибриллярного белка также, как правило.
Цитоскеле́т прокарио́т — совокупное название для всех структурных филаментов прокариот. В прошлом считалось, что у прокариот цитоскелета нет, однако с начала 1990-х стали накапливаться данные о наличии у прокариот разнообразных филаментов. У прокариот не только имеются аналоги ключевых белков цитоскелета эукариот, но и белки, не имеющие аналогов у эукариот. Элементы цитоскелета играют важные роли в делении клеток, защите, поддержании формы и определении полярности у различных прокариот.
Нокдаун гена (англ. Gene knockdown) — методика, позволяющая снизить экспрессию одного или нескольких генов при помощи изменения соответствующей последовательности нуклеотидов, либо при помощи короткого олигонуклеотида, комплементарного соответствующей молекуле мРНК. Метод нокдауна генов относится к методам обратной генетики. В случае, когда изменяется последовательность гена, организм называют нокаутным по данному гену. В случае использования коротких олигонуклеотидов, комплементарных соответствующим.
Лакто́зный репре́ссор (англ. Lac repressor) — ДНК-связывающий белок, который ингибирует экспрессию генов, кодирующих белки лактозного оперона. Кодируется геном lacI. Белки лактозного оперона участвуют в метаболизме лактозы в клетках бактерий. Эти гены подавляются, когда лактоза недоступна клеткам, гарантируя, что бактериальная клетка не будет тратить энергию на синтез белков, метаболизирующих лактозу, в условиях её отсутствия. Когда лактоза становится доступной, она преобразуется в аллолактозу, которая.
Корепрессор — вещество, которое ингибирует экспрессию генов. Для прокариот корепрессорами являются низкомолекулярные вещества или малые молекулы, тогда как в эукариотах, корепрессорами являются белки. Корепрессоры непосредственно не связывают ДНК, но вместо этого косвенно регулируют экспрессию гена путём связывания с репрессорами и усиливают или модулируют их действие.
Глобула — состояние (набор конформаций) полимерной цепи, в котором флуктуации концентрации звеньев малы: их радиус корреляции значительно меньше размера макромолекулы. Концентрация звеньев в глобулярном состоянии значительно выше, чем в полимерном клубке, причём эта концентрация постоянна во всём объёме глобулы, кроме тонкого слоя на поверхности (например, межфазной границы полимер/растворитель), называемого опушкой глобулы.
Сайт рестрикции (участок узнавания) — короткая последовательность нуклеотидов в молекуле ДНК, которая распознаётся ферментом эндонуклеазой рестрикции-модификации (рестриктазой). Рестриктаза связывается с молекулой ДНК в точке расположения сайта рестрикции и перерезает цепочку нуклеотидов внутри сайта или в непосредственной близости от него.
Белковая субъединица в структурной биологии — полипептид, который вместе с другими компонентами собирается в мультимерный или олигомерный белковый комплекс. Многие природные ферменты и другие белки состоят из нескольких белковых субъединиц.
Гомеодомен — это структурный домен белков, связывающих ДНК или РНК, широко распространенный среди факторов транскрипции. Домен состоит из 60 остатков аминокислот, и образует структуру спираль-поворот-спираль, в которой альфа-спирали связаны короткими петлевыми участками. Две спирали на N-конце являются антипараллельными, и длиннее спирали на C-конце, которая перпендикулярна осям N-концевым петлям. Непосредственно С-концевая спираль взаимодействует с ДНК. Укладка доменов белков по типу гомеодомена.
Аминоацил-тРНК-синтетаза (АРСаза) — фермент-синтетаза, катализирующий образование аминоацил-тРНК в реакции этерификации определённой аминокислоты с соответствующей ей молекулой тРНК. Для каждой протеиногенной аминокислоты существует своя аминоацил-тРНК-синтетаза.
Эпитоп (англ. epitope), или антигенная детерминанта — часть макромолекулы антигена, которая распознаётся иммунной системой (антителами, B-лимфоцитами, T-лимфоцитами). Часть антитела, распознающая эпитоп, называется паратопом. Хотя обычно эпитопы относятся к чужеродным для данного организма молекулам (белкам, гликопротеинам, полисахаридам и др.), участки собственных молекул, распознаваемые иммунной системой, также называются эпитопами.
Аффинность (лат. affinitas — родственность) — термодинамическая характеристика, количественно описывающая силу взаимодействия веществ (например, антигена и антитела). Аффинность можно определить по закону действующих масс как отношение концентрации комплекса антиген — антитело к произведению концентраций компонентов. Высокой аффинностью в случае антител считают 1012 М−1, низкой аффинностью — 105 М−1.
Злокачественные клетки или малигниризованные клетки — это опухолевые клетки, обладающие не только тканевым, но и клеточным атипизмом, в значительной степени утратившие тканевую специфичность и обладающие способностью к безостановочному неконтролируемому размножению, метастазированию.
Биосинтез белка — это многостадийный процесс синтеза и созревания белков, протекающий в живых организмах. В биосинтезе белка выделяют два основных этапа: синтез полипептидной цепи из аминокислот, происходящий на рибосомах с участием молекул мРНК и тРНК (трансляция), и посттрансляционные модификации полипептидной цепи. Процесс биосинтеза белка требует значительных затрат энергии.
Окисли́тельное декарбоксили́рование пирува́та — биохимический процесс, заключающийся в отщеплении одной молекулы углекислого газа (СО2) от молекулы пирувата и присоединения к декарбоксилированному пирувату кофермента А (КоА) с образованием ацетил-КоА; является промежуточным этапом между гликолизом и циклом трикарбоновых кислот. Декарбоксилирование пирувата осуществляет сложный пируватдегидрогеназный комплекс (ПДК), включающий в себя 3 фермента и 2 вспомогательных белка, а для его функционирования.
Транскрипт — молекула РНК, образующаяся в результате транскрипции (экспрессии соответствующего гена или участка ДНК).
Принцип компартментализации клеток эукариот постулирует, что биохимические процессы в клетке локализованы в определённых отсеках, покрытых оболочкой из бислоя липидов. Большинство органоидов в эукариотической клетке являются компартментами — митохондрии, хлоропласты, пероксисомы, лизосомы, эндоплазматический ретикулум, ядро клетки и аппарат Гольджи. Внутри ряда компартментов (в том числе ядра) выделяются также субкомпартменты, различающиеся по форме и функциям.
Сплайсосо́ма — структура, состоящая из молекул РНК и белков и осуществляющая удаление некодирующих последовательностей (интронов) из предшественников мРНК. Этот процесс называется сплайсингом (от англ. splicing — сращивание).
Нуклеазы — большая группа ферментов, гидролизующих фосфодиэфирную связь между субъединицами нуклеиновых кислот. Различают несколько типов нуклеаз в зависимости от их специфичности: экзонуклеазы и эндонуклеазы, рибонуклеазы и дезоксирибонуклеазы, рестриктазы и некоторые другие. Рестриктазы занимают важное положение в прикладной молекулярной биологии.
Нуклеосома — это структурная часть хромосомы, образованная совместной упаковкой нити ДНК с гистоновыми белками H2А, H2B, H3 и H4. Последовательность нуклеосом, соединенная гистоновым белком H1, формирует нуклеофиламент, или иначе нуклеосомную нить.
Инфламмасома (англ. inflammasome от англ. inflammation, воспаление) — особый белковый комплекс в макрофагах и нейтрофилах, который приводит к запуску воспалительной реакции при контакте клетки с микроорганизмами, играет важную роль в системе врождённого иммунитета. Криопириновый тип инфламмасом ответственен за воспаление, возникающее при контакте клеток с кристаллами мочевой кислоты, что характерно для подагры.
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
(См. сначала п.57 и 58, затем п.6)
Содержание параграфа 59:
59. 1. Четвертичная структура белков.
59. 2. Связи в четвертичной структуре.
59. 2. Положительная и отрицательная кооперативность в олигомерах.
59. 2. 1. Пример положительной кооперативности.
59. 2 .2. Пример отрицательной кооперативности.
59. 3. Олигомерные белки и полибелковые комплексы (полиферментные комплексы).
59. 1. Четвертичная структура белков.
Глобулы (см. п.58) и фибриллы, имеющие третичную структуру,
могут соединяться (нековалентно обычно),
образуя комплексы.
Это и есть четвертичная структура белка.
Определение:
Четвертичная структура белка –
это соединение (комплекс)
из нескольких отдельных полипептидных цепей (ППЦ),
у каждой из которых обычно есть третичная структура.
Кратко: четвертичная структура – это комплекс глобул. Или нитей-фибрилл.
Термины:
При наличии у белка четвертичной структуры
(а она не у всех белков есть, характерна для регулируемых белков)
отдельную ППЦ (глобулу, например) называют СУБЪЕДИНИЦЕЙ
или протомером, или мономером
(но не путайте эти мономеры
с мономерами типа аминокислот в ППЦ или глюкозы в гликогене).
Комплекс субъединиц называют ОЛИГОМЕРОМ
(олиго- означает несколько).
Олигомеры из двух субъединиц называют димерами,
из четырёх – ТЕТРАМЕРАМИ,
из шести – гексамерами,
из восьми – октамерами.
Примеры тетрамеров –
гемоглобин и протеинкиназа А
(в ассоциированном виде – п.6).
59. 2. Связи в четвертичной структуре.
Какие связи удерживают субъединицы в комплексе
и тем самым стабилизируют четвертичную структуру (олигомер)? –
Те же самые, что и третичную,
кроме дисудьфидных –
ковалентные связи не характерны для четвертичной структуры,
поскольку важно, чтобы субъединицы могли соединяться и разъединяться.
Те же самые – то есть ионные, водородные и т.д.
59. 2. Положительная и отрицательная кооперативность в олигомерах.
Субъединицы могут влиять на конформацию других субъединиц олигомеров
и за счёт этого –
менять активность субъединиц –
активировать или инактивировать их.
Это влияние одних субъединиц на активность других субъединиц олигомера
называется КООПЕРАТИВНОСТЬЮ.
Активация субъединицы другой субъединицей (при связывании с ней)
называется ПОЛОЖИТЕЛЬНОЙ кооперативностью,
а инактивация субъединицы другой субъединицей
называется ОТРИЦАТЕЛЬНОЙ кооперативностью.
Примеры. –
59. 2. 1. Пример положительной кооперативности.
Молекула гемоглобина состоит из четырёх субъединиц,
то является тетрамером.
Субъединицы гемоглобина активируют друг друга
(то есть в тетрамере гемоглобина наблюдается положительная кооперативность)
– благодаря этому активность тетрамера в 400 раз выше,
чем активность отдельной субъединицы
или чем активность молекулы миоглобина, у которой есть только одна субъединица.
(Миоглобин – это белок мышц.
Он тоже связывает кислород, как и гемоглобин,
но глобулы миоглобина не образуют олигомеры).
59. 2 .2. Пример отрицательной кооперативности.
Есть группа ферментов, которые катализируют фосфорилирование белков
и называются протеинкиназами.
Одна из них называется протеинкиназой А (ПК А).
Молекула протеинкиназы А (см. п.6 и 95) тоже является тетрамером,
то есть состоит из четырёх субъединиц, как и гемоглобин.
Две субъединицы ПК А
способны катализировать реакцию
(фосфорилировать белки)
и поэтому называются КАТАЛИТИЧЕСКИМИ.
А две другие субъединицы протеинкиназы А
не катализируют реакции,
их функция – регулировать активность каталитических,
поэтому они эти субъединицы называются РЕГУЛЯТОРНЫМИ.
Когда регуляторные субъединицы связаны с каталитическими,
то каталитические не могут работать –
так как регуляторные их инактивируют
(то есть регуляторные являются ингибиторами каталитических),
поэтому тетрамер протеинкиназы не активен.
Кооперативность в протеинкиназе А отрицательная.
Каталитические субъединицы могут работать только тогда,
когда регуляторные отсоединяются от них.
Отсоединение регуляторных от каталитических
(и в итоге активация протеинкиназы А)
происходит тогда,
когда с регуляторными субъединицами связывается цАМФ.
Поэтому цАМФ считается активатором протеинкиназы А.
Таким образом, при положительной кооперативности олигомеры активнее субъединиц,
а при отрицательной кооперативности олигомеры не активны.
59. 3. Олигомерные белки
и полибелковые комплексы (полиферментные комплексы).
Олигомерные белки – это белки, которые образуют олигомеры.
О них выше.
Некоторые белки образуют комплексы из множества ППЦ (обычно глобул).
Это и есть полибелковые комплексы.
Если это комплекс ферментов, то он называется полиферментным комплексом.
Пример такого комплекса – пируват/дегидрогеназный комплекс (ПДГ),
катализирующий превращение пирувата в ацетилКоА (п.32, 20).
В этом комплексе объединены ферменты,
которые катализируют последовательность реакций.
Что даёт объединение белков в комплекс? – повышение эффективности работы.
Глобулы отдельных ферментов передают друг другу метаболиты, работая как конвейер.
Четвертичная структура белка – это способ укладки в пространстве отдельных полипептидных цепей, которые обладают разной (возможно одинаковой) первичной, вторичной, третичной структурой.
Четвертичная структура белка
Большая часть белковых молекул способна сохранять свою биоактивность, то есть выполнять присущую им функцию только в узком диапазоне температур и кислотности среды. При повышении температуры, изменении кислотности до экстремальных значений, добавлении гидрофобных агентов (например, органических растворителей) или при значительном увеличении концентрации солей, в структуре белков происходят изменения, которые приводят к их денатурации — потере своей нативной (естественной) пространственной структуры. Как правило, при этом первичная структура белка не разрушается.
Рисунок 1. Четвертичная структура белка. Автор24 — интернет-биржа студенческих работ
В структурном отношении четвертичная структура белка является макромолекулой. Многочисленные функциональные белки состоят из нескольких полипептидных цепей, они соединяются между собой несколькими главновалентными цепями. В данном случае ковалентные связи отсутствуют. Каждая отдельная полипептидная цепь получила название протомера, мономера или субъединицы, не обладающей высокой функциональной активностью.
Такую способность белок приобретает при определенном способе пространственного объединения мономеров. При этом возникает новое качество, которое не свойственно мономерному белку. Та молекула, которая образуется в результате этого, называется олигомером.
Готовые работы на аналогичную тему
Олигомерные белки обладают следующими свойствами:
- состоят из четного числа протомеров (2 или 4, реже 6);
- имеют одинаковые или разные молекулярные массы (с весьма высокой степенью вариативности).
Например, молекула гемоглобина состоит из двух α- и двух β-полипептидных цепей. Эта молекула имеет форму тетрамера. Другими словами, в состав молекула гемоглобина входят четыре полипептидные цепи, которые находятся в систематическом взаимодействии.
Каждая из них окружает специализированную группу гема-пигмента, окрашивающего кровь в характерный красный цвет. В определенных условиях молекула гемоглобина может подвергнуться обратной диссоциации. Такой процесс формируется под влиянием разрыва водородных связей. После удаления солей или мочевины происходит автоматическая ассоциация исходной молекулы гемоглобина.
Классическим примером олигомерной молекулы является вирус табачной мозаики, который имеет гигантскую молекулу. Длина вируса составляет примерно 300 нм. Вокруг молекулы РНК нанизываются белковые частицы, которые образуют спиралеобразную структуру, содержащую более 130 витков..
Данный вирус обладает удивительной способностью, которая заключается в том, что наблюдается полная регенерация (восстановление) четвертичной структуры с восстановлением всех ее физических параметров, а также биологических функций.
Особенности функционирования четвертчиной структуры белка
Таким образом, последовательность аминокислот содержит внутри себя информацию, которая реализуется на всех уровнях организации структуры белковой молекулы.
Многие ферменты обладают четвертичной структурой. Например, фосфорилаза это молекула, которая состоит из двух идентичных друг другу субъединиц, каждая из которых состоит из двух пептидных цепей. Таким образом, молекула представляет собой тетрамер. Отдельные субъединицы не могут иметь особенной каталитической активности. Любой регуляторный фермент всегда имеет четвертичную структуру и обеспечивает в клетке высокую скорость требуемых химических реакций.
Четвертичная структура белка имеет достаточно высокую степень стабильности. При этом она все- таки подвергается денатурации и может быть восстановлена при наличии нескольких условий от температуры и до наличия катализаторов.
Следует отметить тот факт, что четвертичная структура полностью расшифрована для нескольких сотен белков, но это далеко не все из известных белков. Эта структура обладает следующими характеристиками:
- стабилизируется нековалентынми связями;
- площадки протомеров взаимодействуют друг с другом по принципу комплементарности (согласованности).
Структура белка, которая сформировалась в рибосоме может подвергаться модификации или посттрансляционному процессингу. Например, это происходит при превращении предшественников ряда ферментов или специализированных гормонов в вещества более высокого порядка.
Таким образом, существуют все основания, которые подтверждают существование четвертичной структуры белка (а также структур) низшего порядка. Каждый белок характеризуется собственной уникальной структурой и специализированными функциями. Выяснение структуры всех белков может служить ключом к познанию природы функционирования всех живых организмов. Такой путь научного поиска может помочь решить следующие многообразие проблем:
- исследование наследственных болезней человека;
- выяснение структуры и системы биосинтеза белка.
Многие исследователи склонны рассматривать существование пятого уровня организации структуры белка. В данном случае речь идет о полифункциональных макромолекулярных комплексах.
Ассоциат – это макромолекулярный белковый комплекс.
Ферменты в данном случае получают название метаболонов или олигомеров, которые катализируют весь путь превращений субстрата в синтетазы высших кислот, пируватдегидрогеназный комплекс, дыхательную цепь.
Подводя итог всему вышесказанному, можно сделать вывод о том, что взаимодействие между отдельными молекулами внутри четвертичной структуры белка дает свободу к изменениям ее пространственной структуры.
Расположение атомов и групп молекул органического вещества, обусловленное возможностями вращения данных молекул вокруг ковалентных связей, получило название конформации. Такие изменения лежат в основе биологической активности белковых полимеров.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 31.01.2022
Анжелика Ивановна Иванова
Автор24 - это сообщество учителей и преподавателей, к которым можно обратиться за помощью с выполнением учебных работ.
Под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называется субъединицей белка с четвертичной структурой. Белок при таком объединении нескольких цепей приобретает новую функцию.

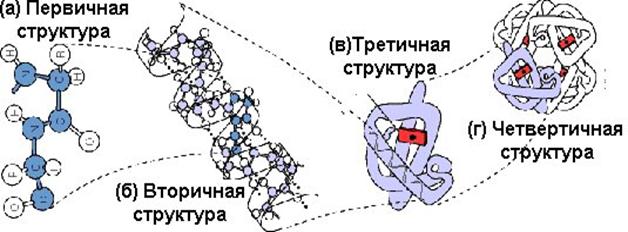
Уровни структурной организации белковой молекулы
Связи, которые имеются между субъединицами, как правило, нековалентные (силы гидрофобного взаимодействия, ионные, водородные), хотя в ряде белков (например, белки плазмы крови) субъединицы соединены ковалентными дисульфидными мостиками. Создание белков с четвертичной структурной организацией позволило Природе расширить свои возможности в области качественного разнообразия белков при незначительном увеличении количества генетического материала. Например, фермент лактатдегидрогеназа (ЛДГ), состоящий из 4-х субъединиц, формируется из 2-х генетически детерминированных полипептидных цепей H и M. Их разные комбинации (HHHH,HHHM,HHMM,HMMM,MMMM) позволяют существовать в организме 5 ферментам ЛДГ, катализирующих одинаковую реакцию в разных органах и тканях: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. Такие белки с одинаковыми функциями, но отличающимися физико-химическими свойствами получили название изопротеинов (изоферментов).
Слабое взаимодействие между отдельными частями белкой молекулы дает ей некоторую свободу к изменениям пространственной структуры. Мы уже указывали, что расположение атомов или групп атомов молекулы органического вещества, обусловленное возможностями вращения их вокруг ковалентных связей, получило название конформации. Изменение конформации белковой молекулы лежит в основе ее биологической активности.
Каждая отдельно взятая полипептидная цепь, которая называется протомером, чаще всего не обладает биологической активностью. Эту способность белок приобретает при объединении с другими протомерами. Образовавшуюся при этом молекулу называют мультимером. Мультимерные белки чаще всего построены из чётного числа протомеров. Функционально активная часть мультимера называется субъединицей.
В частности молекула белка глобина состоит из 2a и 2b субъедениц, каждая из которых состоит из двух одинаковых полипептидных цепей соответственно. То есть молекула гемоглобина состоит из четырех полипептидных цепей, каждая из которых окружает группу гема.
При определённых условиях (в присутствии мочевины) или при сдвиге рН молекула гемоглобина обратимо диссоциируют на 2a и 2b полипептидных цепи. После удаления мочевины происходит автоматическая ассоциация исходной молекулы. Это возможно благодаря информации, заложенной в первичной структуре. То есть последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организаци белка. Наиболее изученным мультемерным ферментом является ЛДГ, состоящий из 4-х субъединиц и может существовать в 5-ти формах (изоферменты).
ПЯТЫЙ УРОВЕНЬорганизации представлен в виде ферментных комплексов, которые катализируют цепной и метаболический путь. Эти комплексы называются метаболонами, они чаще связаны с клеточными мембранами.
Стабильность четвертичной структуры обусловлена ковалентными связями между контактными площадками протомеров, которые взаимодействуют друг с другом по принципу комплементарности. Так, например, в гемоглобине каждая субъединица имеет 4 контактные поверхности для связывания с гемом, 3 – для связывания с другими протомерами.
В последние годы была сформулирована теория доменной структуры белка. Домен – это функциональный модуль, рабочая поверхность отдельного белка. То есть белок – это полифункциональный модуль, состоящий из нескольких доменов. Было установлено, что белки выполняющие одну и ту же функцию, но выделенные из разных веществ, имеют сходное строение. Домены друг относительно друга могут смещаться благодаря “ гибкости” белковой молекулы. Смещение происходит под действием температуры, факторов внешней среды, фосфорилирования, метилирования, и это отражается на свойствах и функциях белка.
Уникальная пространственная структура каждой белковой молекулы и ее возможности в определенных пределах изменять эту структуру придают белкам способность выполнять многочисленные специфические функции. Главный принцип, лежащий в основе этой специфичности, это принцип комплементарности или пространственной дополнительности между определенным участком белковой молекулы (активным участком) и молекулой или участком молекулы (лигандом), с которой реагирует этот белок. Активные участки белковых молекул образуются на поверхности в "карманах", "расщелинах". При этом если для функции необходимы гидрофобные радикалы аминокислот, то они, упрятанные от воды в глубине белковой молекулы, становятся доступными благодаря изменению её конформации. В таком случае говорят о кооперативном эффекте, который образно можно представить на модели "рука - перчатка".

Лигандами могут быть самые разные по химической природе вещества: белки, углеводы, липиды, неорганические вещества и т.д. Примерами такого специфического белок-лиганд взаимодействия являются взаимодействие между ферментом и субстратом, антителом и антигеном, рецептором и гормоном и т.д.
Учитывая важность конформационных изменений для выполнения белками их функций, становится понятным, что в регуляции их функциональной активности важная роль отводится факторам, влияющим на конформацию белка. Такими факторами могут быть изменения pH, температуры, которые в равной мере влияют на все белки и могут быть названы неспецифическими факторами регуляции. С другой стороны, это могут быть специфически взаимодействующие с белками вещества и тогда говорят о специфических факторах регуляции. Последние создают неограниченные возможности в специфической регуляции процессами жизнедеятельности.
Под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называется субъединицей белка с четвертичной структурой. Белок при таком объединении нескольких цепей приобретает новую функцию.


Уровни структурной организации белковой молекулы
Связи, которые имеются между субъединицами, как правило, нековалентные (силы гидрофобного взаимодействия, ионные, водородные), хотя в ряде белков (например, белки плазмы крови) субъединицы соединены ковалентными дисульфидными мостиками. Создание белков с четвертичной структурной организацией позволило Природе расширить свои возможности в области качественного разнообразия белков при незначительном увеличении количества генетического материала. Например, фермент лактатдегидрогеназа (ЛДГ), состоящий из 4-х субъединиц, формируется из 2-х генетически детерминированных полипептидных цепей H и M. Их разные комбинации (HHHH,HHHM,HHMM,HMMM,MMMM) позволяют существовать в организме 5 ферментам ЛДГ, катализирующих одинаковую реакцию в разных органах и тканях: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. Такие белки с одинаковыми функциями, но отличающимися физико-химическими свойствами получили название изопротеинов (изоферментов).
Слабое взаимодействие между отдельными частями белкой молекулы дает ей некоторую свободу к изменениям пространственной структуры. Мы уже указывали, что расположение атомов или групп атомов молекулы органического вещества, обусловленное возможностями вращения их вокруг ковалентных связей, получило название конформации. Изменение конформации белковой молекулы лежит в основе ее биологической активности.
Каждая отдельно взятая полипептидная цепь, которая называется протомером, чаще всего не обладает биологической активностью. Эту способность белок приобретает при объединении с другими протомерами. Образовавшуюся при этом молекулу называют мультимером. Мультимерные белки чаще всего построены из чётного числа протомеров. Функционально активная часть мультимера называется субъединицей.
В частности молекула белка глобина состоит из 2a и 2b субъедениц, каждая из которых состоит из двух одинаковых полипептидных цепей соответственно. То есть молекула гемоглобина состоит из четырех полипептидных цепей, каждая из которых окружает группу гема.
При определённых условиях (в присутствии мочевины) или при сдвиге рН молекула гемоглобина обратимо диссоциируют на 2a и 2b полипептидных цепи. После удаления мочевины происходит автоматическая ассоциация исходной молекулы. Это возможно благодаря информации, заложенной в первичной структуре. То есть последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организаци белка. Наиболее изученным мультемерным ферментом является ЛДГ, состоящий из 4-х субъединиц и может существовать в 5-ти формах (изоферменты).
ПЯТЫЙ УРОВЕНЬорганизации представлен в виде ферментных комплексов, которые катализируют цепной и метаболический путь. Эти комплексы называются метаболонами, они чаще связаны с клеточными мембранами.
Стабильность четвертичной структуры обусловлена ковалентными связями между контактными площадками протомеров, которые взаимодействуют друг с другом по принципу комплементарности. Так, например, в гемоглобине каждая субъединица имеет 4 контактные поверхности для связывания с гемом, 3 – для связывания с другими протомерами.
В последние годы была сформулирована теория доменной структуры белка. Домен – это функциональный модуль, рабочая поверхность отдельного белка. То есть белок – это полифункциональный модуль, состоящий из нескольких доменов. Было установлено, что белки выполняющие одну и ту же функцию, но выделенные из разных веществ, имеют сходное строение. Домены друг относительно друга могут смещаться благодаря “ гибкости” белковой молекулы. Смещение происходит под действием температуры, факторов внешней среды, фосфорилирования, метилирования, и это отражается на свойствах и функциях белка.
Уникальная пространственная структура каждой белковой молекулы и ее возможности в определенных пределах изменять эту структуру придают белкам способность выполнять многочисленные специфические функции. Главный принцип, лежащий в основе этой специфичности, это принцип комплементарности или пространственной дополнительности между определенным участком белковой молекулы (активным участком) и молекулой или участком молекулы (лигандом), с которой реагирует этот белок. Активные участки белковых молекул образуются на поверхности в "карманах", "расщелинах". При этом если для функции необходимы гидрофобные радикалы аминокислот, то они, упрятанные от воды в глубине белковой молекулы, становятся доступными благодаря изменению её конформации. В таком случае говорят о кооперативном эффекте, который образно можно представить на модели "рука - перчатка".
Лигандами могут быть самые разные по химической природе вещества: белки, углеводы, липиды, неорганические вещества и т.д. Примерами такого специфического белок-лиганд взаимодействия являются взаимодействие между ферментом и субстратом, антителом и антигеном, рецептором и гормоном и т.д.
Учитывая важность конформационных изменений для выполнения белками их функций, становится понятным, что в регуляции их функциональной активности важная роль отводится факторам, влияющим на конформацию белка. Такими факторами могут быть изменения pH, температуры, которые в равной мере влияют на все белки и могут быть названы неспецифическими факторами регуляции. С другой стороны, это могут быть специфически взаимодействующие с белками вещества и тогда говорят о специфических факторах регуляции. Последние создают неограниченные возможности в специфической регуляции процессами жизнедеятельности.
Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярно-го образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигоме-ром (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер. На рис. 1.23 представлена структура молекулы гемоглобина, а на рис. 1.24 хорошо видно, что молекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет (см. главу 2).
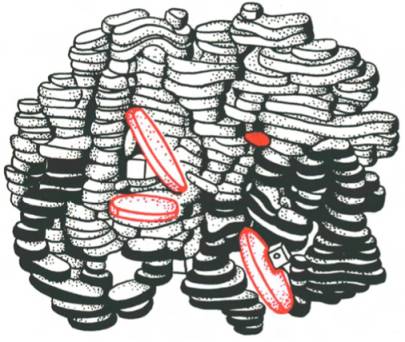
Рис. 1.23. Олигомерная молекула гемоглобина (красные диски – группы гема).
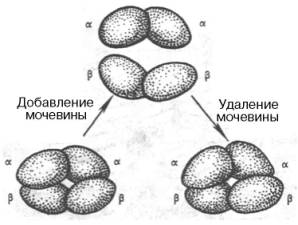
В определенных условиях (присутствие солей, 8М мочевины или резкие изменения рН) молекула гемоглобина обратимо диссоциирует на две α-и две β-цепи. Эта диссоциация обусловлена разрывом водородных связей. После удаления солей или мочевины происходит автоматическая ассоциация исходной молекулы гемоглобина (рис. 1.25).
Классическим примером олигомерной молекулы, или надмолекулярной структуры, является вирус табачной мозаики, представляющий собой гигантскую молекулу с мол. м. около 40•10 6 . Он состоит из одной молекулы РНК (см. главу 3) и 2130 белковых субъединиц, масса каждой из которых составляет 17500. Длина вируса примерно 300 нм, ширина – около 17 нм. РНК вируса имеет спиралеобразную форму. Вокруг РНК нанизаны белковые частицы, образующие гигантскую надмолекулярную спиральную структуру, в которой насчитывается около 130 витков (рис. 1.26). Удивительной особенностью вируса является то, что после разъединения соответствующими приемами (добавление детергента) РНК и белковых субъединиц и последующего их смешивания (с предварительным удалением детергента) наблюдаются полная регенерация четвертичной структуры, восстановление всех физических параметров и биологических функций (инфектив-ная способность вируса). Подобная точность процесса спонтанной самосборки вируса обеспечивается, вероятнее всего, информацией, содержащейся в первичной структуре молекулы РНК и белковых субъединиц. Таким образом, последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организации белков.
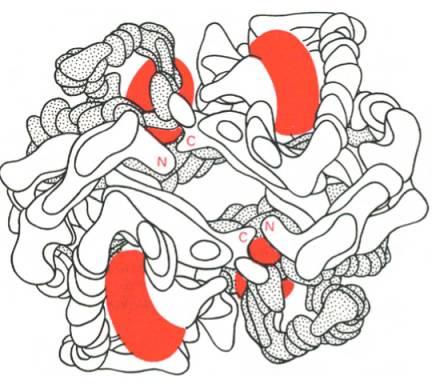
Рис. 1.24. Модель гемоглобина (по Перутцу).
α-Цепи светлые; β-цепи темные; группы гема красные.
Многие ферменты также обладают четвертичной структурой, например фосфорилаза а, состоящая из двух идентичных субъединиц, в каждой из которых по две пептидные цепи. Вся молекула фосфорилазы а, таким образом, представляет собой тетрамер. Отдельные субъединицы чаще всего не обладают каталитической активностью; вообще регуляторные ферменты (см. главу 4) имеют четвертичную олигомерную структуру. Они наделены функцией обеспечения в клетке требуемых скоростей химических реакций.
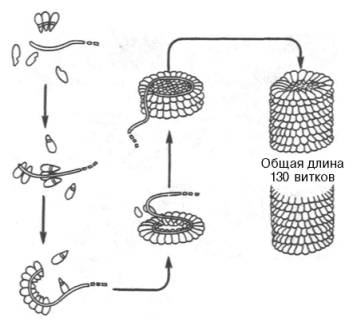
Рис. 1.26. Самосборка вируса табачной мозаики.
Наиболее изученным олигомерным ферментом является лактатдегидро-геназа (она катализирует обратимое превращение пировиноградной кислоты в молочную), содержащая два типа полипептидных цепей: Н – сердечный тип (от англ. heart – сердце) и М – мышечный тип (от англ. muscle – мышца) – и состоящая из 4 субъединиц. Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах. Такие ферменты получили название изоферментов, или, в соответствии с новой классификацией, множественных форм ферментов (см. главу 4).
К настоящему времени субъединичная структура обнаружена у нескольких сотен белков. Однако только для немногих белков, в том числе для молекулы гемоглобина, методом рентгеноструктурного анализа расшифрована четвертичная структура . Основными силами, стабилизирующими четвертичную структуру, являются нековалентные связи между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности – универсальному принципу, свойственному живой природе. Структура белка после его синтеза в рибосоме может частично подвергаться модификации (посттрансляционный процессинг): например, при превращении предшественников ряда ферментов или гормонов (инсулин).
Таким образом, имеются все основания для подтверждения мнения о существовании 4 уровней структурной организации белков. Более того, каждый индивидуальный белок характеризуется уникальной структурой, обеспечивающей уникальность его функций. Поэтому выяснение структуры разнообразных белков может служить ключом к познанию природы живых систем и соответственно сущности жизни. На этом пути научного поиска могут быть решены также многие проблемы наследственных заболеваний человека, в основе которых лежат дефекты структуры и биосинтеза белков.
Некоторые исследователи склонны рассматривать, и не без основания, существование пятого уровня структурной организации белков. Речь идет о полифункциональных макромолекулярных комплексах, или ассоциатах из разных ферментов, получивших название метаболических олигомеров, или метаболонов, и катализирующих весь путь превращений субстрата (синте-тазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
Читайте также:

