Челночные системы биохимия кратко
Обновлено: 02.07.2024

Челночные механизмы нужны для переноса электронов и протона водорода с НАДH в матрикс митохондрий. Почему эта молекула так важна, что для неё существуют отдельные механизмы?
НАДH — это восстановленный кофермент. Он образовался в шестой реакции гликолиза, которую катализирует глицеральдегидфосфатдегидрогеназа. Для этой реакции в активном центре фермента должен находиться кофермент — НАД + . Кофермент принимает на себя два электрона и протон от глицеральдегид-3-фосфата. Так образуется восстановленный НАДH.

Шестая реакция гликолиза
Шестая реакция гликолиза не пойдёт, если в активном центре фермента не будет НАД + . А это значит, что реакции гликолиза остановятся. Так, если следующая глюкоза попадает в гликолиз, то дальше пятой реакции дело не пойдёт. Клетка не получит то, ради чего всё затевалось: две молекулы АТФ, две молекулы пирувата и две молекулы НАДH. Обидно терять всё это богатство из-за одного кофермента.
Тут нужно остановиться и вспомнить, что гликолиз идёт в цитоплазме клетки. Там НАДH можно окислить с помощью анаэробного гликолиза. Но клетку такое интересует не часто. Из-за анаэробного гликолиза она теряет две молекулы пирувата, которые пойдут на синтез лактата. Эту реакцию катализирует лактатдегидрогеназа. С помощью неё НАДH окисляется до НАД + . Эта реакция очень полезна в мышцах, когда им не хватает кислорода, и эритроцитах. НО остаётся огромный минус — клетка не получит пируват. Он не отправится в цикл трикарбоновых кислот и дыхательную цепь, а значит куча энергии пропадёт даром.

Превращение пирувата в лактат. При этом окисляется НАДH.
Нужен лучший способ окислить НАДH до НАД + , при котором мы не пожертвуем двумя молекулами пирувата. Для этого есть митохондрия, которая отделена двумя биологическими мембранами от цитоплазмы. Там основная энергетическая топка нашей клетки. При наличии кислорода восстановленные коферменты (НАДH и ФАДH2) окисляются в дыхательной цепи.
И вроде всё просто — давайте перекинем туда НАДH и дело с концом. Пусть он там окисляется, а потом возвращается в цитоплазму. Но тут есть проблема. Во внешней мембране митохондрий есть поры. Через них могу проходить небольшие молекулы, но вот внутренняя мембрана непроницаема. Поэтому НАДH и НАД + не могут проникнуть через неё.

Мембраны митохондрии
Нужно придумать какой-то механизм, благодаря которому НАДH будет переноситься через внутреннюю мембрану в матрикс митохондрии. Клетка запарилась, но придумала. Её идея ужасно проста, но очень умна (как и всегда). Что если переносить два электрона и протон с НАДH на другую молекулу? Эта молекула должна проходить через одну или две мембраны. Там отдавать электроны и протоны, а потом возвращаться обратно в цитоплазму. И так по кругу.
В общем-то вы уже поняли суть челночных механизмов, а теперь познакомимся с ними поближе. Всего таких механизмов два: глицеролфосфатный и малат-аспартатный.
Глицеролфосфатный челночный механизм
Работает в скелетных мышцах. Давайте посмотрим на общую картинку этого челнока.

Глицеролфосфатный челночный механизм
Первый этап катализирует цитоплазматическая глицерол-3-фосфатдегидрогеназа. Фермент присоединяет два электрона и два протона к дигидроксиацентофосфату. Образуется глицерол-3-фосфат и НАД + .
Два электрона и протон отдаёт НАДH, а второй протон берётся из цитоплазмы. Но их там не мало. Не запутайтесь в названиях: здесь образуется глицерол-3-фосфат, а не глицеральдегид-3-фосфат из гликолиза.
НАД + остаётся в цитоплазме, где может снова использоваться в шестой реакции гликолиза.
На втором этапе глицерол-3-фосфат проходит через внешнюю мембрану и попадает в межмембранное пространство митохондрии. Там идёт третий этап челночного механизма. Катализирует его митохондриальная глицерол-3-фосфатдегидрогеназа. Фермент находится во внутренней мембране митохондрий. Эта реакция — зеркальное отражение прошлой. Из глицерол-3-фосфата образуется дигидроксиацетонфосфат. Два электрона и два протона принимает кофермент ФАД. Мы получаем дигидроксиацетонфосфат и восстановленный ФАДH2.

Третий этап глицеролфосфатного челночного механизма
Четвёртый этап. Дигидроксиацетонфосфат покидает межмембранное пространство — снова оказывается в цитоплазме. Он опять может повторить цикл.

1. Превращение дигидроксиацетонфосфата в глицерол-3-фосфат с помощью фермента глицеролфосфатдегидрогеназы. В этой реакции окисляется НАДH, клетка получает НАД + . 2. Перемещение глицерол-3-фосфата в межмембранное пространство митохондрий. 3. Митохондриальная дегидрогеназа превращает глицерол-3-фосфат в дигидроксиацетонфосфат. Электроны и протоны принимает кофермент ФАД. 4. Дигидроксиацетонфосфат возвращается в цитоплазму клетки.
Вот так мы окислили НАДH до НАД + и перенесли его два электрона и протон в митохондрию. А ещё мы захватили один протон из цитоплазмы, но от неё не убудет. Дальше митохондриальная глицерофосфатдегидрогеназа отдаст два электрона на убихинон, который отправится на третий комплекс дыхательной цепи.
Малат-аспартатный челночный механизм
Работает в большинстве органов и тканей, для нас самые важные — печень и сердце. В нём больше реакций, чем в прошлом челноке. Так что он посложнее.

Малат-аспартатный челночный механизм
Первый этап. Электроны и протоны принимает оксалоацетат, который находится в цитоплазме. Катализирует реакцию цитоплазматическая малатдегидрогеназа. Клетка получает окисленный НАД + и малат. НАД + снова идёт в гликолиз. У малата не такая простая судьба.

Первый этап малат-аспартатного челночного механизма
Малат проходит через внешнюю мембрану митохондрии, но не может пройти через внутреннюю. Для него есть специальный белок переносчик: малат-α-кетоглутарат транслоказа. При её работе малат перемещается в матрикс митохондрий, а альфа-кетоглутарат в межмембранное пространство. Напоминаю, что такой транспорт называется антипортом. Из межмембранного пространства альфа-кетоглутарат может попасть в цитоплазму. Скажу даже больше, он туда попадает…
Второй этап. Малат превращается в оксалоацетат с помощью митохондриальной малатдегидрогеназы. Кофермент этой реакции НАД + , а не ФАД. Образуется НАДH, оксалоацетат и протон. Нужно запомнить, что в малат-аспартатном челноке используется кофермент НАД + .
Теперь нужно вернуть оксалоацетат в цитоплазму, но внутренняя мембрана митохондрии для него непроницаема. Это связано с тем, что он участвует в цикле трикарбоновых кислот. А он как раз идёт в матриксе митохондрий. Поэтому клетка не хочет терять его просто так.
Третий этап. Для обхода этого защитного механизма есть дополнительная реакция. Эту реакцию катализирует митохондриальная аспартатаминотрансфераза. Фермент переносит аминогруппу с глутамата на оксалоацетат, для этого ему нужен кофермент — пиридоксальфосфат. Образуется аспартат и альфа-кетоглутарат.

Третий этап малат-аспартатного челнока
Аспартат переносится через внутреннюю мембрану с помощью белка переносчика — глутамат-аспартат транслоказы. Она переносит аспартат в межмембранное пространство митохондрий, а глутамат в матрикс. Там глутамат используется для трансаминирования — мы видели это выше.
Четвёртый этап. Снова превращаем аспартат в оксалоацетат. Здесь нам понадобится альфа-кетоглутарат, который мы переносили в цитоплазму на первом этапе. Катализирует реакцию цитоплазматическая аспартатаминотрансфераза. Снова образуется оксалоацетат и глутамат. Оксалоацетат используется для малат-аспартатного челночного механизма, а глутамат переносится в митохондрию.

Четвёртый этап малат-аспартатного челночного механизма
Цикл завершён. Мы перенесли электроны и протон с НАДH в матрикс митохондрии.

1. Оксалоацетат принимает два электрона и протона и превращается в малат — катализирует реакцию цитоплазматическая малатдегидрогеназа. НАД + идёт на реакции гликолиза, а малат попадает в матрикс митохондрий. Для этого нужен белок переносчик, который транспортирует малат в матрикс, а альфа-кетоглутарат в межмембранное пространство. 2. Малат превращается в оксалоацетат с помощью малатдегидрогеназы. При этом электроны и протоны переносятся на НАД + . Образуется оксалоацетат и НАДH. 3. Оксалоацетат превращается в аспартат с помощью реакции трансаминирования. Катализатор реакции — митохондриальная аспартатаминотрансфераза. Аспартат попадает в цитоплазму с помощью белка переносчика. При этом глутамат попадает в матрикс. 4. Аспартат переходит в оксалоацетат с помощью цитоплазматической аспартатаминотрансферазы.
В челноках было много одинаковых по функциям ферментов. Но при этом у каждого была приписочка: цитоплазматический или митохондриальный. Дело в том, что это изоферменты — они выполняют одинаковую функцию, но при этом отличаются по аминокислотным последовательностям. А это значит, что они кодируются разными генами.
С аспартатаминотрансферазой (АСТ) вы встретитесь ещё миллиард раз. Она используется при диагностике инфаркта миокарда и заболеваний печени. А всё почему? Потому что там наибольшая активность малат-аспартатного челнока. Так что запоминайте этот фермент и не думайте, что биохимия бесполезна. Опять говорю как препод….
Что происходит с электронами дальше?
Смысл окисления НАДH до НАД + не только в бесперебойной работе гликолиза. Электроны и протоны, которые были перенесены в матрикс митохондрий используются для синтеза АТФ. Как? С помощью дыхательной цепи. Я не буду расписывать её ещё раз, если хотите подробнее, то о ней можно почитать тут. Главное сейчас — это понять суть.
Электроны переносятся от одного комплекса дыхательной цепи к другому, пока они не попадут на кислород. В ходе такого переноса выделяется энергия. Эта энергия используется для транспорта протонов водорода из матрикса митохондрий в межмембранное пространство. Так создаётся градиент концентрации. Внутри митохондрии протонов мало, а снаружи много. При этом первый комплекс выкачивает четыре протона, третий тоже четыре, а четвёртый только два протона. Градиент концентрации используется на синтез АТФ с помощью АТФ-синтазы. На синтез одной молекулы АТФ затрачивается ~ четыре протона.

Окислительное фосфорилирование
В глицеролфосфатном челноке мы получили ФАДH2. Электроны с него попадают сразу на убихинон, то есть пропускают первый комплекс дыхательной цепи. Значит в ходе путешествия электронов по дыхательной цепи мы получим всего шесть протонов водорода. Или 1,5 молекулы АТФ — на синтез одной молекулы нужно четыре протона. Это из одного ФАДH2. Но в ходе гликолиза образовались две молекулы НАДH, а значит мы получим две молекулы ФАДH2. Умножим 1,5 на 2 и получим три молекулы АТФ — из каждого ФАДH2 по 1,5 АТФ. Прибавим две, которые мы получили в ходе гликолиза. И выйдет пять молекул АТФ. Это общий выход гликолиза при использовании глицеролфосфатного челнока.

В ходе малат-аспартатного челнока был получен НАДH. Он отдаёт электроны на первый комплекс дыхательной цепи. Значит общее количество протонов — десять. Или 2,5 молекулы АТФ. В ходе гликолиза мы получили два НАДH, а значит и здесь их будет два. Общее количество АТФ — пять. Прибавим две, которые мы получили в ходе гликолиза. Выходит семь молекул АТФ. Это общий выход гликолиза при использовании малат-аспартатного челнока.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Глицеролфосфатная челночная системаработает в клетках белых мышц, печени, мозге.
Водород от НАДH в цитозоле передается на диоксиацетонфосфат глицерол-3-фосфатдегидрогеназой (НАД-зависимый фермент) (рис. 38). Образовавшийся глицерол-3-фосфат окисляется ферментом внутренней мембраны митохондрий - глицерол-3-фосфатдегидрогеназой (ФАД-зависимый фермент). Затем протоны и электроны с ФАДH2 переходят на убихинон и далее по дыхательной цепи.
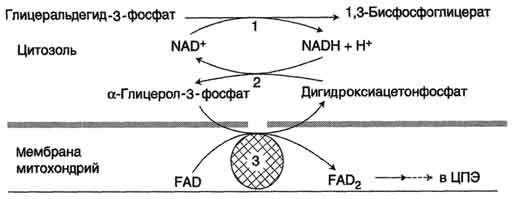
Рис. 38. Глицеролфосфатная челоночная система:
1 - глицеральдегид-3-фосфатдегидрогеназа;
2 - глицерол-3-фосфатдегидрогеназа (цитозольный фермент);
3 - глицерол-3-фосфатдегидрогеназа (митохондриальныи фермент)
Малат-аспартатная челночная система, в которой участвуют малат, цитозольная и митохондриальная малат-дегидрогеназы, является более универсальной, и работает в сердечной мышце, печени, почках.
В цитоплазме НАДH восстанавливает оксалоацетат в малат (реакция 1), который при участии переносчика проходит в митохондрии, где окисляется в оксалоацетат НАД-зависимой малатдегидрогеназой (реакция 2). Восстановленный НАДН отдает водород в митохондриальную ЦПЭ (рис. 39).
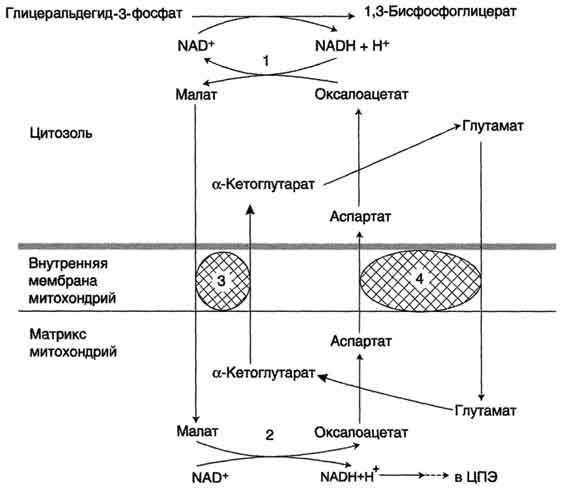
Рис. 39. Малат-аспартатная челоночная система:
1, 2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на ЦПЭ;
3, 4 - транслоказы, обеспечивающие транспорт a-кетоглутарата, аспартата и глутамата и через мембрану митохондрий
Образованный из малата оксалоацетат выйти из митохондрий в цитозоль не может: мембрана митохондрий для него непроницаема. Поэтому он превращается в аспартат, который транспортируется в цитозоль, где снова превращается в оксалоацетат.
Обе челночные системы отличаются по количеству синтезированной АТФ. В первой системе образуется 2АТФ (водород вводится в ЦПЭ на уровне убихинона). Вторая система энергетически более эффективна – образуется 3АТФ (водород поступает в ЦПЭ с митохондриальным НАД + ).
Глицеролфосфатная челночная системаработает в клетках белых мышц, печени, мозге.
Водород от НАДH в цитозоле передается на диоксиацетонфосфат глицерол-3-фосфатдегидрогеназой (НАД-зависимый фермент) (рис. 38). Образовавшийся глицерол-3-фосфат окисляется ферментом внутренней мембраны митохондрий - глицерол-3-фосфатдегидрогеназой (ФАД-зависимый фермент). Затем протоны и электроны с ФАДH2 переходят на убихинон и далее по дыхательной цепи.

Рис. 38. Глицеролфосфатная челоночная система:
1 - глицеральдегид-3-фосфатдегидрогеназа;
2 - глицерол-3-фосфатдегидрогеназа (цитозольный фермент);
3 - глицерол-3-фосфатдегидрогеназа (митохондриальныи фермент)
Малат-аспартатная челночная система, в которой участвуют малат, цитозольная и митохондриальная малат-дегидрогеназы, является более универсальной, и работает в сердечной мышце, печени, почках.
В цитоплазме НАДH восстанавливает оксалоацетат в малат (реакция 1), который при участии переносчика проходит в митохондрии, где окисляется в оксалоацетат НАД-зависимой малатдегидрогеназой (реакция 2). Восстановленный НАДН отдает водород в митохондриальную ЦПЭ (рис. 39).

Рис. 39. Малат-аспартатная челоночная система:

1, 2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на ЦПЭ;
3, 4 - транслоказы, обеспечивающие транспорт a-кетоглутарата, аспартата и глутамата и через мембрану митохондрий
Образованный из малата оксалоацетат выйти из митохондрий в цитозоль не может: мембрана митохондрий для него непроницаема. Поэтому он превращается в аспартат, который транспортируется в цитозоль, где снова превращается в оксалоацетат.
Обе челночные системы отличаются по количеству синтезированной АТФ. В первой системе образуется 2АТФ (водород вводится в ЦПЭ на уровне убихинона). Вторая система энергетически более эффективна – образуется 3АТФ (водород поступает в ЦПЭ с митохондриальным НАД + ).
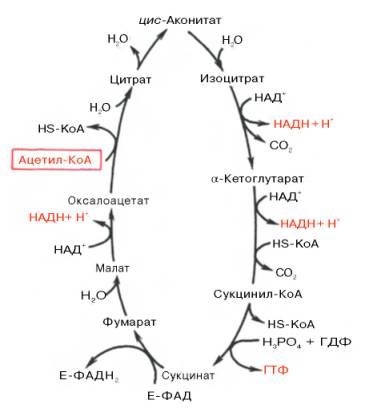
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
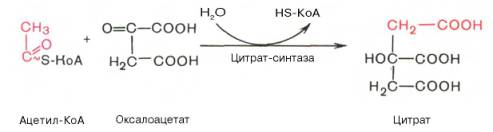
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
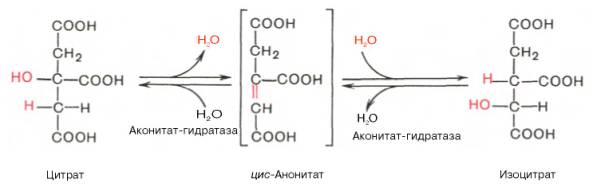
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
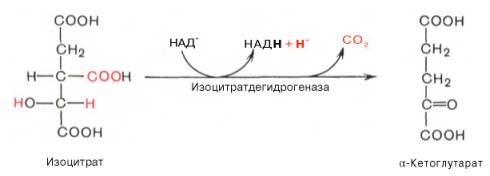
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg 2+ или Мn 2+ .
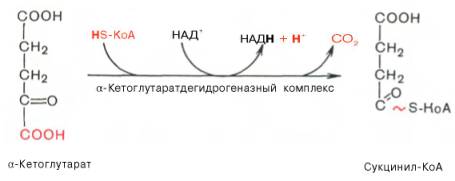
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД + .
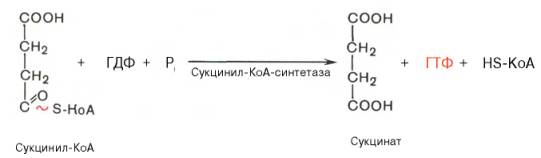
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
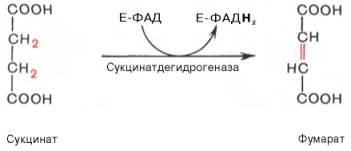
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:
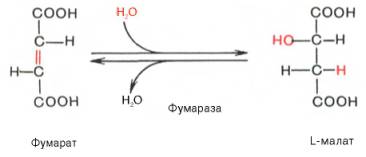
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:

Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Ци-топлазматический НАДН сначала реагирует с цитоплазматическим ди-гидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализи-
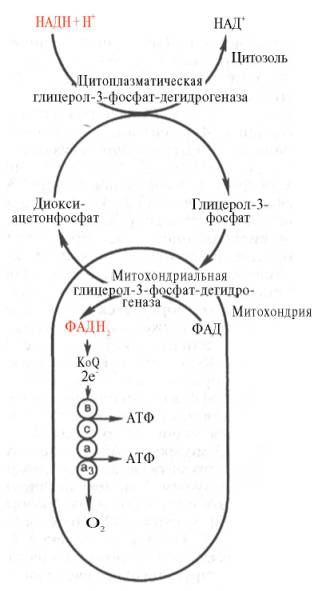
Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
руется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Дигидроксиацетонфосфат + НАДН + Н + Глицерол-3-фосфат + НАД + .
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиаце-тонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н + . Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н + ), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.
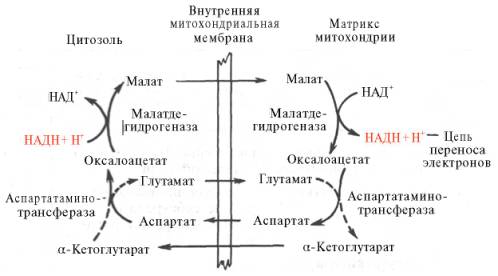
Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н + в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н + восстановленные эквиваленты сначала при участии фермента малатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД + восстанавливается в НАДН + Н + , который может теперь передавать свои электроны в цепь дыхательных ферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
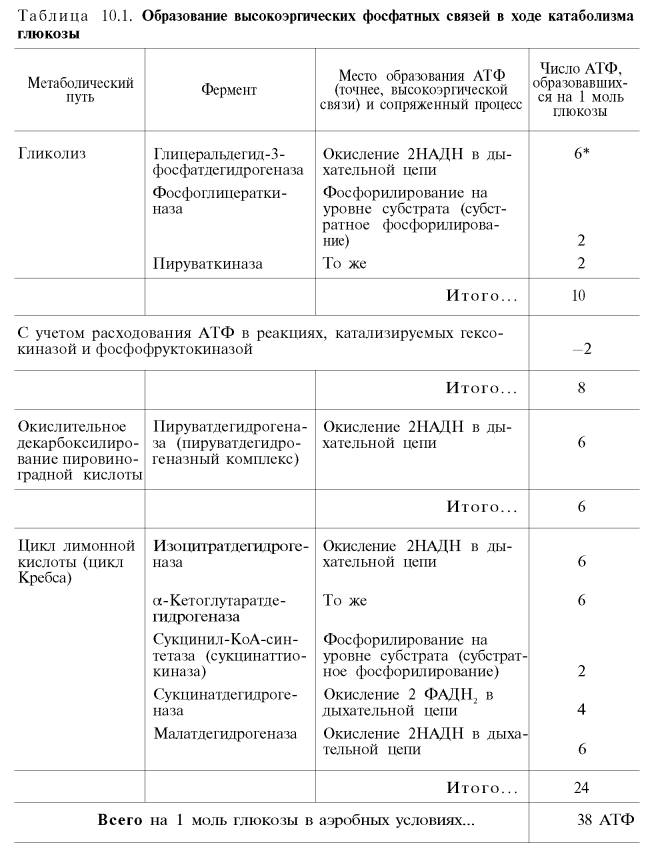
В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.
Читайте также:

