Жидкие и твердые вещества доклад
Обновлено: 04.07.2024
Различают два состояния твердых веществ - кристаллическое и аморфное. Кристаллическое состояние характеризуется упорядоченной структурой. Упорядоченность в кристаллах обусловливается правильным геометрическим расположением частиц, из которых состоит твердое вещество. Каждое кристаллическое вещество имеет определенную, характерную форму. Например, кристаллы поваренной соли имеют форму куба, калийной селитры - форму призмы, алюминиевых квасцов - форму октаэдров и т. д.
Прикрепленные файлы: 1 файл
Различают два состояния твердых веществ.docx
Различают два состояния твердых веществ - кристаллическое и аморфное. Кристаллическое состояние характеризуется упорядоченной структурой. Упорядоченность в кристаллах обусловливается правильным геометрическим расположением частиц, из которых состоит твердое вещество. Каждое кристаллическое вещество имеет определенную, характерную форму. Например, кристаллы поваренной соли имеют форму куба, калийной селитры - форму призмы, алюминиевых квасцов - форму октаэдров и т. д.
Аморфные вещества не образуют правильной геометрической структуры, представляя собой структуры неупорядоченно расположенных молекул. В отличие от кристаллических веществ, имеющих вполне определенную температуру плавления, аморфные вещества плавятся в широком интервале температур. При нагревании они постепенно размягчаются, затем начинают растекаться и, наконец, становятся жидкими.
Примерами аморфных веществ могут быть стекла и смолы. К аморфным веществам относится также большинство полимеров. Некоторые вещества могут находиться и в кристаллическом, и в аморфном состояниях, - например сера, оксид кремния ( IV ) и др.
Стоит также отметить, что если свойства аморфных веществ изотропны (одинаковы по всем направлениям), то свойства кристаллов анизотропны, что особенно наглядно проявляется при исследовании таких веществ оптическими методами. Подавляющее большинство твердых веществ имеет кристаллическое строение.
Свойства твердых веществ
По сравнению с двумя другими состояниями вещества- газообразным и жидким-твердые вещества имеют наибольшую упорядоченность. Именно этой высокой упорядоченностью объясняются многие физические свойства твердых веществ.
Сжимаемость твердых веществ практически равна нулю. Все твердые вещества имеют определенный объем. Одним из наиболее известных свойств твердых веществ является их способность сохранять свою форму. По сравнению с газами и жидкостями твердые вещества могут выдерживать значительные внешние нагрузки. Плотность каждого вещества в твердом состоянии значительно больше, чем в газообразном состоянии, и несколько больше, чем в жидком. Исключение составляет вода, которая в жидком состоянии обладает большей плотностью, чем лед. Кристаллические твердые вещества имеют строго определенную температуру плавления, но аморфные твердые вещества, как, например, стекла, размягчаются в некотором интервале температур.
Все твердые вещества характеризуются определенным давлением пара, хотя оно, как правило, очень мало. Это особенно относится к твердым веществам ионного типа.
Все частицы (атомы, ионы либо молекулы) в кристаллической решетке твердых тел совершают колебательные движения. Иногда какая-либо частица на поверхности твердого вещества приобретает достаточную кинетическую энергию, чтобы преодолеть силы притяжения, связывающие ее в твердом веществе. Тогда она улетает с поверхности. Именно такие улетающие с поверхности частицы обусловливают давление пара над поверхностью твердых веществ.
Энтальпии плавления твердых веществ намного меньше, чем энтальпии испарения соответствующих жидкостей.
Твердые вещества могут значительно отличаться друг от друга по своим пластическим свойствам. Некоторые из них, например ионные вещества, обычно раскалываются под нагрузкой. Такое свойство называется хрупкостью. Другие, как, например, резина, являются упругими. После удаления внешней нагрузки они приобретают свою первоначальную форму. Многие металлы обладают свойствами ковкости и тягучести. Ковкий металл можно превратить ударами в тонкий лист, а тягучий металл вытянуть в тонкую проволоку.
Твердые вещества сильно различаются по способности проводить тепло и электрический ток. Все металлы обладают хорошей теплопроводностью и электропроводностью. Неметаллические вещества, как правило, являются изоляторами (диэлектриками), хотя, как мы уже упоминали, графит проводит электрический ток. Графит - пример анизотропного вещества: его свойства неодинаковы в разных направлениях. Например, графит проводит электрический ток только вдоль своих слоев. Кристаллы могут обладать и другими анизотропными свойствами. Например, их показатель преломления (света) может изменяться в зависимости от направления.
Если свойства какого-либо вещества одинаковы во всех направлениях, такое вещество называется изотропным. Кубические кристаллы изотропны, поскольку они обладают высокой симметрией.
Физические свойства твердых веществ в большой степени зависят от типа химической связи и от структуры.
Актуальность тематики состоит в понимании необходимости наличия данного знания, так как по существу оно носит основополагающий фундаментальный характер. Как известно, любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой. В обычной жизни мы наблюдаем три агрегатных состояния вещества — твердое, жидкое и газообразное.
Одно и то же вещество может находиться в твердом, жидком или газообразном состоянии. Нам хорошо знакомы лед, вода и пар; давно известно, что это различные состояния одного и того же вещества - воды; но они так сильно различаются, что в разговорном языке не появилось объединяющего их слова.
Для того чтобы понять, как растут кристаллы из газообразных, жидких или твердых сред, нам мало знать внешние физические различия этих трех состояний материи, надо хорошо уяснить себе своеобразие их атомно-кинетического строения.
В ходе исследования автором были поставлены две основные задачи:
– изучить понятие состояний веществ;
– изучить особенности состояний веществ.
Рассмотрением вышеперечисленных аспектов мы и намерены заняться в дальнейшем.
Глава 1. Понятие состояний веществ
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном . Четвертым агрегатным состоянием вещества часто считают плазму .[1] Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.[2]
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела.
В кристаллах атомы (или ионы) расположены в пространстве в узлах кристаллической решетки и колеблются около них. Строгая периодичность в расположении атомов приводит к сохранению порядка на больших расстояниях.
В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью.
По типам химической связи твердые тела делят на три класса, каждый из которых характеризуется определенным пространственным распределением электронов: 1) ионные кристаллы (NaCl, KaCl); 2) ковалентные (алмаз, Ge, Si); 3) металлические.[3]
Кристаллическая структура твердых тел зависит от сил, действующих между атомами и частицами. Одни и те же атомы могут образовывать различные структуры - серое и белое олово, графит и алмаз.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации).
Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие).
Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов одинаковы. При сильном нагревании любое вещество испаряется, превращается в газ. Если увеличивать температуру и далее, резко усиливается процесс термической ионизации. Молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра и ионосферы. На поверхности Земли в естественных условиях плазма - редкий гость, появляющийся лишь при вспышках молний.
В лабораторных условиях плазма впервые появилась в виде газового разряда. Она заполняет лампы дневного света, стеклянные трубки неоновой рекламы и т. д. За последние годы применение плазмы существенно расширилось.[4]
Высокотемпературная плазма (Т ~ 10 6 -10 8 К) из смеси дейтерия с тритием используется для осуществления управляемого термоядерного синтеза; низкотемпературная плазма (Т = 5 К) - в различных газоразрядных приборах: газовых лазерах, ионных приборах, МГД-генераторах и так далее.
Глава 2. Особенности состояний веществ
Газ (франц. gaz, от греч. chaos — хаос) есть агрегатное состояние вещества, в котором кинетическая энергия теплового движения его частиц (молекул, атомов, ионов) значительно превосходит потенциальную энергию взаимодействий между ними, в связи с чем частицы движутся свободно, равномерно заполняя в отсутствие внешних полей весь предоставленный им объем.
Газ расширяется, пока не заполнит весь отведенный ему объем. Если рассмотреть газ на молекулярном уровне, мы увидим беспорядочно мечущиеся и сталкивающиеся между собой и со стенками сосуда молекулы, которые, однако, практически не вступают во взаимодействие друг с другом. Если увеличить или уменьшить объем сосуда, молекулы равномерно перераспределятся в новом объеме. Молекулярно-кинетическая теория связывает молекулярные свойства газа с его макроскопическими свойствами, такими как температура и давление.[5]
Жидкость есть агрегатное состояние вещества, сочетающее в себе черты твердого состояния (сохранение объема, определенная прочность на разрыв) и газообразного (изменчивость формы). Для жидкости характерны ближний порядок в расположении частиц (молекул, атомов) и малое различие в кинетической энергии теплового движения молекул и их потенциальной энергии взаимодействия. Тепловое движение молекул жидкости состоит из колебаний около положений равновесия и сравнительно редких перескоков из одного равновесного положения в другое, с этим связана текучесть жидкости.
В отличие от газа жидкость при заданной температуре занимает фиксированный объем, однако и она принимает форму заполняемого сосуда — но только ниже уровня ее поверхности. На молекулярном уровне жидкость проще всего представить в виде молекул-шариков, которые хотя и находятся в тесном контакте друг с другом, однако имеют свободу перекатываться друг относительно друга, подобно круглым бусинам в банке. Налейте жидкость в сосуд — и молекулы быстро растекутся и заполнят нижнюю часть объема сосуда, в результате жидкость примет его форму, но не распространится в полном объеме сосуда.[6]
Твердое тело есть агрегатное состояние вещества, отличающееся стабильностью формы и характером теплового движения атомов, которые совершают малые колебания вокруг положений равновесия. Различают кристаллические и аморфные твердые тела. В первых существует пространственная периодичность в расположении равновесных положений атомов. В аморфных твердых телах атомы колеблются около хаотически расположенных точек. Устойчивым состоянием твердых тел является кристаллическое. Различают твердые тела с ионной, ковалентной, металлической и др. типами связи между атомами, что обусловливает разнообразие их физических свойств. Электрические и некоторые др. свойства твердых тел в основном определяются характером движения внешних электронов его атомов. По электрическим свойствам твердые тела делятся на диэлектрики, полупроводники и металлы, по магнитным — на диамагнетики, парамагнетики и тела с упорядоченной магнитной структурой. Исследования свойств твердых тел объединились в большую область — физику твердого тела, развитие которой стимулируется потребностями техники.
Твердое тело имеет собственную форму, не растекается по объему контейнера и не принимает его форму. На микроскопическом уровне атомы прикрепляются друг к другу химическими связями, и их положение друг относительно друга фиксировано. При этом они могут образовывать как жесткие упорядоченные структуры — кристаллические решетки, — так и беспорядочное нагромождение — аморфные тела (именно такова структура полимеров, которые похожи на перепутанные и слипшиеся макароны в миске).[7]
Выше были описаны три классических агрегатных состояния вещества. Имеется, однако, и четвертое состояние, которые физики склонны относить к числу агрегатных. Это плазменное состояние. Плазма характеризуется частичным или полным срывом электронов с их атомных орбит, при этом сами свободные электроны остаются внутри вещества. Таким образом, плазма, будучи ионизированной, в целом остается электрически нейтральной, поскольку число положительных и отрицательных зарядов в ней остается равным. Мы можем наблюдать как холодную и в незначительной степени ионизированную плазму (например, в люминесцентных лампах), так и полностью ионизированную горячую плазму (внутри Солнца, например).
При сверхнизких температурах скорости молекул снижаются настолько, что мы не можем точно определить их местоположение. Это происходит в силу принципа неопределенности Гейзенберга.[8] Когда температура снижается настолько, что степень неопределенности положения атомов оказывается сопоставимой с размерами группы атомов, к которой они принадлежат, вся группа начинает вести себя, как единое целое. Такое состояние вещества называется конденсатом Бозе—Эйнштейна, и его можно считать пятым агрегатным состоянием вещества.[9]
Подведем итог вышесказанному.
В ходе исследования было показано, что все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном. Четвертым агрегатным состоянием вещества часто считают плазму. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой.
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.
Установлено, что газ есть агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Твердые тела характеризуются стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
В отличие от газа и твердых тех, жидкость есть агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
Список использованной литературы
1. Гуревич А. Е. и др. Физика. Химия. 5-6 классы: Методическое пособие. – М.: Дрофа, 2002. – 96 с.
2. Гуревич А. Е. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – 192 с.
3. Гуревич А. Е. и др. Физика. 8 класс: Учебник. – М.: Дрофа, 2002. – 272 с.
4. Перышкин А. В. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – 192 с.
5. Касьянов В. А. Физика. 10-11 классы: Учебник. – М.: Дрофа, 2002. – 416 с.
6. Перышкин А. В. Физика. 9 класс: Учебник. – М.: Дрофа, 2002. – 256 с.
7. Рыбьев И.А. Строительное материаловедение. – М.: Высшая школа, 2002. – 701 с.
8. Физика. 7 класс: Методическое пособие. – М.: Дрофа, 2002. – 64 с.
9. Физика композиционных материалов. В 2-х тт. Т. 1. / Под ред. Трофимова Н.Н., Кановича М.З., Карташова Э.М., Натрусова В.И., Пономаренко А.Т., Шевченко В.Г., Соколова В.И., Симонова-Емельянова И.Д. – М.: Высшая школа, 2005. – 456 с.
[1] Гуревич А. Е. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – С. 64.
[3] Перышкин А. В. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – С. 73.
[4] Рыбьев И.А. Строительное материаловедение. – М.: Высшая школа, 2002. – С. 238.
[5] Перышкин А. В. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – С. 64.
[8] Физика композиционных материалов. В 2-х тт. Т. 1. / Под ред. Трофимова Н.Н., Кановича М.З., Карташова Э.М., Натрусова В.И., Пономаренко А.Т., Шевченко В.Г., Соколова В.И., Симонова-Емельянова И.Д. – М.: Высшая школа, 2005. – С. 218.

Все вещества в природе, независимо от температуры и давления, состоят из молекул одного и того же состава. Однако строение вещества отличается при различных внешних условиях. Кратко рассмотрим строение газообразных, жидких и твердых тел.
Агрегатные состояния вещества
Внешний вид одного и того же вещества существенно зависит от температуры и давления. Правда, далеко не любое вещество легко наблюдать в разных состояниях (особенно это касается плазмы). Но для подготовки доклада в 10 классе достаточно изучить свойства обычной воды. Любой знает, что обычная вода при низкой температуре превращается в лед, а при высокой — в пар, причем эти изменения обратимы.
Влияние давления проследить сложнее, однако тоже возможно: например, измеряя температуру кипения воды в горах, где атмосферное давление заметно ниже. Так, на Крестовом перевале (Военно-Грузинская дорога) вода кипит уже при 92 ⁰С.
Лед, жидкость и пар — это агрегатные состояния воды, строение которых имеет свои особенности. Рассмотрим их с точки зрения молекулярно-кинетической теории (МКТ).
Строение газа
При достаточно высокой температуре и не слишком большом давлении молекулы вещества обладают большой энергией, и сил их взаимодействия недостаточно, чтобы удерживать их рядом. Сила гравитации также оказывается недостаточной, чтобы заметно влиять на поведение молекул. Поэтому при таких условиях молекулы могут свободно перемещаться в пространстве, заполняя весь предоставленный объем.
Молекулы сталкиваются друг с другом и с другими телами, создавая давление газа, однако путь их свободного полета многократно превышает размеры молекул. Взаимодействия происходят лишь в короткое время столкновения. Связь давления с объемом и температурой описывается газовыми законами.

Рис. 1. Три газовых закона.
Строение жидкого вещества
Если уменьшать температуру газа, то энергия молекул будет всё меньше, свободный пробег — тоже. Наконец, молекулы в среднем станут находиться настолько близко друг к другу, что силы притяжения начнут играть заметную роль в поведении вещества, выражаясь в виде поверхностного натяжения. Сила тяжести будет также вносить свою лепту: в результате вещество займет нижнюю часть предоставленного объема.
В жидком состоянии молекулы находятся очень близко друг к другу. Поэтому сжать их можно лишь за счет изменения формы молекул, для чего требуется гораздо больше энергии по сравнению со сжатием за счет уменьшения расстояний между молекулами. Большую часть времени молекулы жидкости проводят в беспорядочных колебаниях, но появление даже небольшой внешней силы способно двигать молекулы жидкости, что обеспечивает текучесть.

Рис. 2. Молекулы в жидкости.
Строение твердого тела
Если уменьшать температуру жидкости, то наступает момент, когда энергия молекулы становится меньше энергии связи между соседними молекулами. В таком состоянии молекулы выстраиваются в регулярную пространственную структуру с наименьшей потенциальной энергией, называемую кристаллом. Порядок, в котором находятся молекулы внутри кристалла, называется кристаллической решеткой.
В кристалле молекулы не могут менять свое расположение относительно соседей. Уменьшению расстояний мешают силы отталкивания положительных ядер в молекулах, увеличению расстояний — силы притяжения между электронными оболочками и ядрами соседних молекул.
Кристалл сохраняет свою форму даже под действием достаточно больших внешних нагрузок потому, что для ее изменения необходимо разрушить сразу много молекулярных связей.
Сравнительная таблица строения твердых, жидких и газообразных тел представлена ниже:
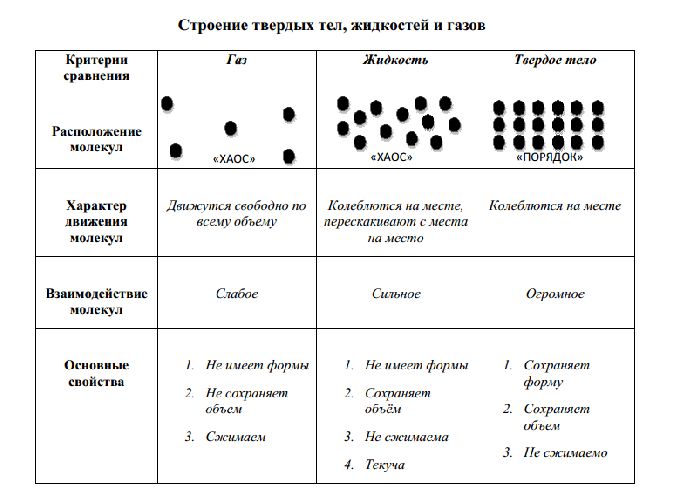
Рис. 3. Таблица строения твердых жидких и газообразных тел.
Что мы узнали?
С точки зрения МКТ, газ представляет собой молекулы вещества, имеющие достаточно большую энергию, чтобы независимо двигаться на относительно больших расстояниях друг от друга. В жидкостях молекулы располагаются рядом и начинают взаимодействовать, но всё еще способны двигаться независимо. В твердых телах молекулы выстраиваются в строгую пространственную структуру и не могут двигаться относительно друг друга.
Загадочный окружающий мир не перестает удивлять. Кубик льда, брошенный в стакан и оставленный при комнатной температуре, в считанные минуты превратится в жидкость, а если оставить эту жидкость на подоконнике на более продолжительное время, – и вовсе испарится. Это — самый простой способ наблюдать за переходами одного агрегатного состояния вещества в другое.
Агрегатное состояние — состояние какого-либо вещества, имеющее определенные свойства: способность сохранять форму и объем, иметь дальний или ближний порядок и другие. При изменении агрегатного состояния вещества происходит изменение физических свойств, а также плотности, энтропии и свободной энергии.
Как и почему происходят эти удивительные превращения? Чтобы разобраться в этом, вспомним, что все вокруг состоит из атомов и молекул. Атомы и молекулы различных веществ взаимодействуют друг с другом, и именно связь между ними определяет, какое у вещества агрегатное состояние .
Выделяют четыре типа агрегатных веществ:
Кажется, что химия открывает нам свои тайны в этих удивительных превращениях. Однако это не так. Переход из одного агрегатного состояния в другое, а также броуновское движение или диффузия относятся к физическим явлениям, поскольку в этих превращениях не происходит изменений молекул вещества и сохраняется их химический состав.
Газообразное состояние
На молекулярном уровне газ представляет собой хаотически движущиеся, сталкивающиеся со стенками сосуда и между собой молекулы, которые друг с другом практически не взаимодействуют. Поскольку молекулы газа между собой не связаны, то газ заполняет весь предоставленный ему объем, взаимодействуя и изменяя направление только при ударах друг о друга.
Это происходит потому, что в замкнутый ограниченный объем шины попадает большое количество молекул, которым становится тесно, и они начинают чаще ударяться друг о друга и о стенки шины, а в результате суммарное воздействие миллионов молекул на стенки воспринимается нами как давление.
Но если газ занимает весь предоставленный ему объем, почему тогда он не улетает в космос и не распространяется по всей вселенной, заполняя межзвездное пространство? Значит, что-то все-таки удерживает и ограничивает газы атмосферой планеты?
Тогда возникает следующий вопрос: почему молекулы газов не падают на землю, а продолжают летать? Оказывается, благодаря солнечной энергии молекулы воздуха имеют солидный запас кинетической энергии, который позволяет им двигаться против сил земного притяжения.

Жидкое состояние
При повышении давления и/или снижении температуры газы можно перевести в жидкое состояние. Еще на заре ХIХ века английскому физику и химику Майклу Фарадею удалось перевести в жидкое состояние хлор и углекислый газ, сжимая их при очень низких температурах. Однако некоторые из газов не поддались ученым в то время, и, как оказалось, дело было не в недостаточном давлении, а в неспособности снизить температуру до необходимого минимума.
Жидкость, в отличие от газа, занимает определенный объем, однако она также принимает форму заполняемого сосуда ниже уровня поверхности. Наглядно жидкость можно представить как круглые бусины или крупу в банке. Молекулы жидкости находятся в тесном взаимодействии друг с другом, однако свободно перемещаются относительно друг друга.
Если на поверхности останется капля воды, через какое-то время она исчезнет. Но мы же помним, что благодаря закону сохранения массы-энергии, ничто не пропадает и не исчезает бесследно. Жидкость испарится, т.е. изменит свое агрегатное состояние на газообразное.
Испарение — это процесс преобразования агрегатного состояния вещества, при котором молекулы, чья кинетическая энергия превышает потенциальную энергию межмолекулярного взаимодействия, поднимаются с поверхности жидкости или твердого тела.
Испарение с поверхности твердых тел называется сублимацией или возгонкой. Наиболее простым способом наблюдать возгонку является использование нафталина для борьбы с молью. Если вы ощущаете запах жидкости или твердого тела, значит происходит испарение. Ведь нос как раз и улавливает ароматные молекулы вещества.
Жидкости окружают человека повсеместно. Свойства жидкостей также знакомы всем — это вязкость, текучесть. Когда заходит разговор о форме жидкости, то многие говорят, что жидкость не имеет определенной формы. Но так происходит только на Земле. Благодаря силе земного притяжения капля воды деформируется.
Однако многие видели как космонавты в условиях невесомости ловят водяные шарики разного размера. В условиях отсутствия гравитации жидкость принимает форму шара. А обеспечивает жидкости шарообразную форму сила поверхностного натяжения. Мыльные пузыри – отличный способ познакомиться с силой поверхностного натяжения на Земле.
Еще одно свойство жидкости — вязкость. Вязкость зависит от давления, химического состава и температуры. Большинство жидкостей подчиняются закону вязкости Ньютона, открытому в ХIХ веке. Однако есть ряд жидкостей с высокой вязкостью, которые при определенных условиях начинают вести себя как твердые тела и не подчиняются закону вязкости Ньютона. Такие растворы называются неньютоновскими жидкостями. Самый простой пример неньютоновской жидкости — взвесь крахмала в воде. Если воздействовать на неньютоновскую жидкость механическими усилиями, жидкость начнет принимать свойства твердых тел и вести себя как твердое тело.

Наливаете стакан сока и добавляете туда лед, моете стакан водой, а потом можно еще паром обдать, чтобы стакан был совсем чистым. В этом процессе трижды используется вода, но в разных агрегатных состояниях. Давайте разбираться, в каких.
О чем эта статья:
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений равновесия.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
На самом деле, есть еще четвертое — плазма. Звучит, как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором помимо нейтральных частиц есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:

Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.

Разбираемся по шагам.
Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов Цельсия).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. В точке B это еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расплавленное вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
- DE — кипение (парообразование) воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс, как и плавление, происходит при постоянной температуре. Но парообразование нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой .
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг · ˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг · °С)
Сначала нужно перевести массу в килограммы:
Q = 380 · 0,1 · (60 − 20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ = 80 кДж/кг. Теплопотерями пренебречь.
Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80 000 Дж/кг
Q = 80 000 · 2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
Примерчики из жизни🤓
Про белье. Попробуйте повесить белье сушиться на улицу в мороз. Поскольку вода замерзает из-за низких температур, белье должно вернуться домой в виде большого айсберга, но этого не происходит — оно возвращается абсолютно сухим. В данном процессе произошла возгонка молекул воды (сублимация).
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Допустим, зимой при температуре −20 градусов в 1 литре воздуха содержится 1 миллиграмм пара. Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь. Но если мы тот же воздух поместим в помещение с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит, что его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40–50%.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Читайте также:

