Железо доклад по технологии
Обновлено: 18.05.2024
Исторические сведения о железе. Сырье для производства, сведения о производстве и обработке железа и изделий из него. Геохимические свойства железа, его изотопы. Химические и физические свойства. Особенности применения, биологическое значение железа.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 11.11.2009 |
| Размер файла | 30,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Тема: Железо в деятельности человека
2. Происхождение названия
4. Геохимия железа
4.1 Геохимические свойства железа
4.2 Минералы железа
6. Физические свойства
7. Химические свойства
9. Биологическое значение железа
Желемзо -- элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) -- ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железоникелевых метеоритов. Распространённость железа в земной коре -- 4,65 % (4-е место после O, Si, Al[2]). Считается также, что железо составляет большую часть земного ядра.
(молярная масса) 55,847 а. е. м. (г/моль)
Радиус атома 126 пм
(первый электрон) 759,1(7.87) кДж/моль (эВ)
Электронная конфигурация [Ar] 3d6 4s2
Ковалентный радиус 117 пм
Радиус иона (+3e) 64 (+2e)74 пм
Электроотрицательность (по Полингу) 1.83
Электродный потенциал Fe 2CO^.
В свою очередь, угарный газ восстанавливает железо из руды:
3CO + Fe2O3 > 2Fe + 3CO2^.
Флюс добавляется для извлечения нежелательных примесей из руды, в первую очередь силикатов, таких, как кварц (диоксид кремния). Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Против других примесей используют другие флюсы.
Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь):
CaCO3 > CaO + CO2^.
Оксид кальция соединяется с диоксидом кремния, образуя шлак:
CaO + SiO2 > CaSiO3.
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности и его можно сливать отдельно от металла. Шлак затем употребляется в строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишний углерод и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используют и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, содержащими водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор -- обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
6. Физические свойства
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
до 769 °C существует б-Fe (феррит) с объемно-центрированной кубической решёткой и свойствами ферромагнетика (769 °C ? 1043 K -- точка Кюри для железа)
в температурном интервале 769--917 °C существует в-Fe, который отличается от б-Fe только параметрами объемно-центрированной кубической решётки и магнитными свойствами парамагнетика
в температурном интервале 917--1394 °C существует г-Fe (аустенит) с гранецентрированной кубической решёткой
выше 1394 °C устойчив д-Fe с объёмно-центрированной кубической решёткой
Металловедение не выделяет в-Fe, как отдельную фазу[4], и рассматривает её как разновидность б-Fe. При нагреве железа или стали выше точки Кюри (769 °C ? 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком -- происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
От абсолютного нуля до 910 єC устойчива б-модификация с объемно-центрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в б-железе называется ферритом.
От 910 до 1400 єC устойчива г-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой. Твёрдый раствор углерода в г-железе называется аустенитом.
От 910 до 1539 єC устойчива д-модификация с объемно-центрированной кубической (ОЦК) кристаллической решеткой. Твёрдый раствор углерода в д-железе (так же, как и в б-железе) называется ферритом. Иногда различают высокотемпературный д-феррит и низкотемпературный б-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо-углерод).
В области высоких давлений (свыше 104 МПа, 100 тыс. атм.) возникает модификация е-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря б- г переходам кристаллической решетки происходит термообработка стали. Без этого явления железо, как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения -- около 3200 °C.
7. Химические свойства
Основные степени окисления железа -- +2 и +3.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3О4, при сгорании в чистом кислороде -- оксид Fe2О3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200--300 °C. При хлорировании железа (при температуре около 200 °C) образуется летучий FeCl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и йода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) СО, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (з5-С5Н5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная плёнка пассирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl > FeCl2 + H2^;
Fe + H2SO4 > FeSO4 + H2^.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III):
2Fe + 6H2SO4 > Fe2(SO4)3 + 3SO2^ + 6H2O.
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(ОН)2. Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(ОН)2, основание Fe(ОН)3, которое реагирует с кислотами:
2Fe(ОН)3 + 3H2SO4 > Fe2(SO4)3 + 6H2O.
Гидроксид железа(III) Fe(ОН)3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей:
Fe(ОН)3 + 3КОН > К3[Fe(ОН)6].
Образующиеся при этом гидроксокомплексы железа(III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 > 3FeCl2.
При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III):
4FeCl2 + O2 + 2H2O > 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора -- двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2О.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 -- железокалиевые квасцы, (NH4)Fe(SO4)2 -- железоаммонийные квасцы и т. д.
Для обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN-. При взаимодействии ионов Fe3+ с анионами SCN- образуется ярко-красный роданид железа Fe(SCN)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат (II) калия K4[Fe(CN)6] (жёлтой кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4- выпадает ярко-синий осадок берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ > 4KFeIII[FeII(CN)6]v + 12K+.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3- выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ > 3KFeII[FeIII(CN)6]v + 6K+.
Интересно, что берлинская лазурь и турнбулева синь -- две формы одного и того же вещества, так как в растворе устанавливается равновесие:
8. Применение
Железо -- один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов -- важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов -- например, никелевых.
Магнитная окись железа (магнетит) -- важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железоникелевых аккумуляторах, железо-воздушных аккумуляторах.
9. Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02%), из которых 75% являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине -- важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Неорганические соединения железа встречается в некоторых бактериях, иногда используется ими для связывания азота воздуха.
Суточная потребность человека в железе следующая[5]: дети -- от 4 до 18 мг, взрослые мужчины -- 10 мг, взрослые женщины -- 18 мг, беременные женщины во второй половине беременности -- 33 мг. У женщин потребность несколько выше, чем у мужчин. Как правило, железа, поступающего с пищей, вполне достаточно, но в некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (Гематоген, Ферроплекс).
Содержание железа в воде больше 1-2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени (гемохроматоз). ПДК железа в воде 0,3 мг/л.
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Как индивидуальный представитель периодической системы химических элементов Дмитрия Ивановича Менделеева, элемент характеризуется уникальными химическими и физическими свойствами
Элемент имеет большое народнохозяйственное значение и играет большую роль в мировой культуре
Список литературы
1. Редкол.: Кнунянц И.Л. (гл. ред.) Химическая энциклопедия: в 5 т. -- Москва: Советская энциклопедия, 1990. -- Т. 2. -- С. 140. -- 671 с. -- 100 000 экз.
2. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия: Учебник для вузов. -- 4-е изд., стер. -- М.: Химия, 2000, ISBN 5-7245-1130-4, с. 529
3. Ю.М. Широков, Н.П. Юдин Ядерная физика. Москва. Наука, 1972 г. Глава Ядерная космофизика.
4. Металловедение и термическая обработка стали. Справ. изд. В 3-х т./ Под ред. М.Л. Берштейна, А.Г. Рахштадта -- 4-е изд., перераб. и доп. Т.2. Основы термической обработки. В 2-х кн. Кн.1. М.: Металлургия, 1995. 336 с.
Подобные документы
Электронное строение железа, характерные степени окисления. Нахождение железа в природе, способы получения, применение. Парамагнитные сине-зеленые моноклинные кристаллы. Соединения железа, их физические и химические свойства, биологическое значение.
реферат [256,2 K], добавлен 08.06.2014
Запасы железных руд России. История получения железа. Основные физические и химические свойства железа. Способы обнаружения в растворе соединений железа. Применение железа, его сплавов и соединений. Сплавы железа с углеродом. Роль железа в организме.
реферат [19,6 K], добавлен 02.11.2009
История открытия железа. Положение химического элемента в периодической системе и строение атома. Нахождение железа в природе, его соединения, физические и химические свойства. Способы получения и применение железа, его воздействие на организм человека.
презентация [8,5 M], добавлен 04.01.2015
Физические свойства элементов VIIIB группы и их соединений, в частности, соединений железа. Анализ комплексных соединений железа (II) и железа (III) с различными лигандами с точки зрения теории кристаллического поля. Строение цианидных комплексов железа.
курсовая работа [1,3 M], добавлен 24.02.2011
Нахождение металла в природе, характеристика его типичных минералов. Способы получения и области применения. Физические и химические свойства его аллотропных модификаций. Углерод - основной легирующий элемент. Описание синтеза оксидов железа (II) и (III).
курсовая работа [71,0 K], добавлен 24.05.2015
Железо - один из самых распространенных металлов в земной коре. Свойства и использование железа. Доменная печь. Железные руды – гематит и магнетит. Выплавка чугуна из железной руды. Комплексные соединения железа.
реферат [10,2 K], добавлен 22.05.2007
Общие сведения о порфиринах и родственных соединениях. Синтез комплексов железа с порфиразинами и фталоцианином. Получение водорастворимого биядерного комплекса фталоцианина железа и его модификация. Изучение биядерных комплексов в присутствии брома.
магистерская работа [792,6 K], добавлен 04.04.2015

Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Смотрите так же:
СТРУКТУРА
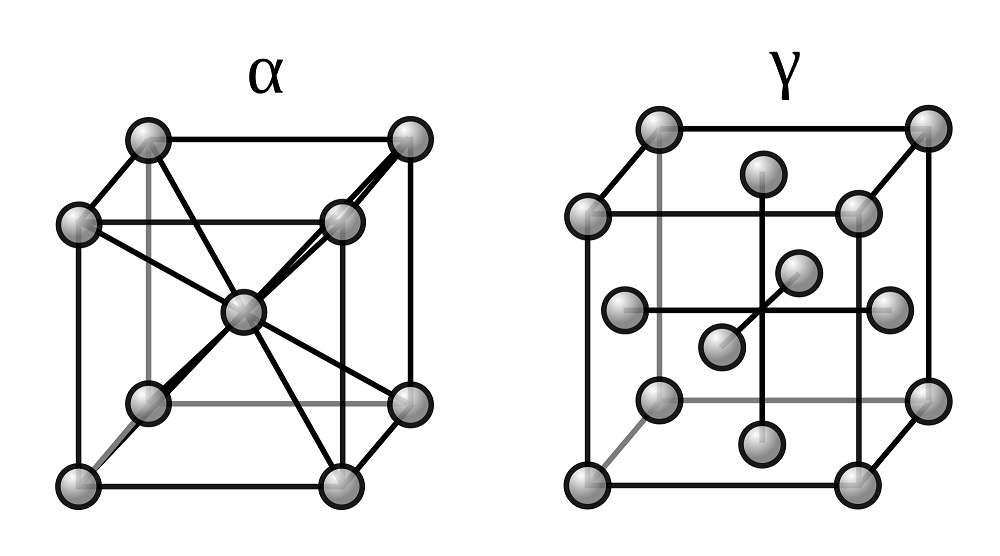
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация – γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная – α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, – единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

ПРОИСХОЖДЕНИЕ

ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Доклад по труду
Металлы и их применение
Нахождение в природе
Характеристика группы элементов
Физические свойства металлов
5.1. Черные металлы
5.2. Цветные металлы
Значение навыков выделения металлов
9.1. Общее применение металлов
Интересное о металлах и сплавах
Металлы и их применение
МЕТАЛЛЫ (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
В периодической системе Д. И. Менделеева из 118 элементов 87 являются металлами.
Они имеют решающее значение для нашего образа жизни, так как не только являются частью структур и технологий, но и важны для производства почти всех предметов.
Металл есть даже в человеческом теле. Такие элементы, как натрий, кальций, магний и цинк, необходимы для жизни, и, если они отсутствуют в наших телах, наше здоровье может быть в серьезной опасности. Например, кальций необходим для здоровых костей, магний — для метаболизма. Цинк усиливает функцию иммунной системы, а железо помогает клеткам крови переносить кислород по всему телу. Однако металлы в наших телах отличаются от металла в ложке или стальном мосте тем, что они потеряли электроны. Они называются катионами.
Металлы также обладают антибиотическими свойствами, поэтому перила и ручки в общественных местах часто изготавливаются из этих элементов. Известно, что многие инструменты делаются из серебра для предотвращения размножения бактерий. Искусственные суставы изготавливаются из титановых сплавов, которые одновременно предотвращают заражение и делают реципиентов сильнее.
2. НАХОЖДЕНИЕ В ПРИРОДЕ
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия . Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам . Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
3. ХАРАКТЕРИСТКА ГРУППЫ ЭЛЕМЕНТОВ
Под металлами понимают совокупность неорганических химических веществ, обладающих характерными свойствами. Как правило, они включают следующее:
пластичность, относительная легкость механической обработки;
сравнительно высокая температура плавления;
роль восстановителя в реакциях;
низкая способностью к ионизации;
Разумеется, не все элементы этой группы обладают всеми этими свойствами, например, ртуть при комнатной температуре жидкая, галлий плавится от тепла человеческих рук, а висмут вряд ли можно назвать пластичным.
4. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Так, некоторые щелочные металлы легко режутся кухонным ножом, а такие металлы, как ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
5. КЛАССИФИКАЦИЯ МЕТАЛЛОВ
Металлы делятся на две большие группы: черные и цветные металлы. Причем цветные металлы в свою очередь делятся на следующие группы: тяжелые, легкие, благородные или драгоценные, тугоплавкие, рассеянные, редкоземельные, радиоактивные.
5.1. ЧЕРНЫЕ МЕТАЛЛЫ
По сути, черные металлы — это сплав железа с углеродом, но помимо этого в составе есть и другие химические элементы, например сера, фосфор, кремний др. Существуют следующие сплавы:
Чугун . Различные химические элементы прямым образом влияют на свойства изделия. Так, сера с фосфором повышают хрупкость, а хромовые и никелевые присадки делают чугун более жаростойким и устойчивым к коррозии.
Сталь . Отличается от чугуна высокой пластичностью, а также высокими технологическими показателями.
5.2. ЦВЕТНЫЕ МЕТАЛЛЫ
Цветными металлами являются:
золото, серебро, платина (драгоценные (благородные) металлы);
медь, олово, свинец, цинк, кобальт, никель, ртуть, кадмий (тяжелые);
алюминий, титан, магний, литий, бериллий (легкие);
ниобий, молибден, цирконий, хром, вольфрам (тугоплавкие);
индий, галлий, таллий (рассеянные);
скандий, иттрий и все лантаноиды (редкоземельные);
радий, технеций, актиний, полоний, торий, франций, уран и трансурановые элементы (радиоактивные).
1. ДРАГОЦЕННЫЕ (БЛАГОРОДНЫЕ) МЕТАЛЛЫ представляют собой металлы, которые могут быть редкими или трудно добываемыми, а также экономически очень ценными.
Платина . Несмотря на свою тугоплавкость, она используется в ювелирных изделиях, электронике, автомобилях, в химических процессах и даже в медицине.
Золото . Этот драгоценный металл используется для изготовления ювелирных изделий и золотых монет. Однако он имеет много других применений. Он используется в медицине, производстве и лабораторном оборудовании.
Серебро . Этот благородный металл серебристо-белого цвета является очень ковким. в чистом виде является достаточно тяжелым, оно легче свинца, но тяжелее меди.
2. ТЯЖЕЛЫЕ МЕТАЛЛЫ
Тяжелые металлы представляют собой металлические, встречающиеся в природе соединения, которые имеют очень высокую плотность по сравнению с другими металлами — по меньшей мере, они в пять раз больше плотности воды. Они токсичны для людей. Даже небольшие дозы могут привести к серьезным последствиям.
О самых опасных чуть подробнее:
Свинец . Это тяжелый металл, являющийся токсичным для людей, особенно для детей. Отравление этим веществом может привести к проблемам неврологического характера. Несмотря на то что когда-то он был весьма привлекательным из-за его гибкости, высокой плотности и способности поглощать вредное излучение, свинец был выведен из употребления по многим направлениям. Этот мягкий серебристый металл, который встречается на Земле, является опасным для людей и накапливается в организме в течение долгого времени. Самое страшное, что от него нельзя избавиться. Он сидит там, накапливается и постепенно отравляет тело. Свинец токсичен для нервной системы и может вызвать серьезное повреждение головного мозга у детей. Он широко использовался в 1800-х годах для создания макияжа и вплоть до 1978 года использовался в качестве одного из ингредиентов в краске для волос. Сегодня свинец используется в основном в больших батареях, в качестве экранов для рентгеновских лучей или изоляции для радиоактивного материала.
Медь . Это красновато-коричневый тяжелый металл, у которого есть множество применений. Медь по-прежнему является одним из лучших проводников электричества и тепла, и многие электрические провода сделаны из этого металла и покрыты пластиком. Монеты, в основном мелочь, также делают из этого элемента периодической системы. Острые отравления медью встречаются редко, но, как и свинец, она может накапливаться в тканях, что в конечном итоге приводит к токсичности. Люди, которые подвергаются воздействию большим количеством меди или медной пыли, также находятся в зоне риска.
3. ЛЕГКИМИ МЕТАЛЛАМИ называют металлы с небольшой плотностью.
Самый легкий металл в мире — литий . При комнатной температуре его плотность является самой низкой. Благодаря маленькой плотности он всплывает в воде и керосине. Литий содержится в морской воде и верхней континентальной коре.
При нормальных условиях литий представляет пластичный ковкий серебристый металл, настолько мягкий, что его можно разрезать ножом. Плавится при температуре 181°C. Он токсичен и активно взаимодействует с окружающей средой, поэтому не используется в чистом виде.
Алюминий имеет серебристо-белый цвет, обладает высокой пластичностью, тепло- и электропроводностью. Способен образовывать сплавы практически с любым металлом. Чаще всего используется вместе с магнием и медью. Многие его сплавы прочнее, чем сталь.
Алюминий слабо поддается коррозийным разрушениям благодаря образованию оксидных пленок. Он закипает при температуре 2500°C. Является слабым парамагнетиком. В природе металл содержится в виде соединений, его самородки встречаются исключительно редко в жерлах некоторых вулканов.
Магний . Что касается магния, то этот металл наделен, наоборот, весьма низкой пластичностью. Это сказывается на неудовлетворительной свариваемости. При этом магний легко поддается резанию, хотя механические свойства этого металла имеют низкий показатель. Как следствие — использование магния как конструкционного материала бывает затрудненным.
Магний обладает:
высокой температурой плавления;
способностью образовывать гидроокись при взаимодействии с влагой;
способностью образовывать сплавы (при этом механические показатели магния усиливаются, что существенно расширяет сферу его использования).
Титан является невзаимодействующим и используется как плакирующий материал в строительстве химических установок. Он отличается высокой устойчивостью против коррозии, окисляющих водных коррозионных сред. Высокая антикоррозийность образуется вследствие очень стабильного пассивированного оксидного слоя, который может быстро образоваться при слабых средствах окисления. Титановые сплавы отличаются высокой прочностью, прежде всего высокой жаропрочностью.
Бериллий имеет в 1,5 раза большую жесткость, чем сталь. Тормозные диски из бериллий вследствие высокой теплоемкости при одинаковых условиях остаются существенно более холодными, чем диски из стали.
В строительстве реакторов бериллий имеет значение из-за нейтронной проницаемости.
Бериллиевые окна применяются в рентгенотехнике и рентгеноаналитике, так как они поглощают лишь малое ионизирующее излучение. Как легирующий материал бериллий используется в медных материалах для изготовления высокообжигаемых литейных и деформируемых сплавов. Для материалов с бериллием, однако, установлены четкие границы применяемости из-за его вреда здоровью и окружающей среде. Бериллиевая пыль чрезвычайно ядовита и ведет к заболеваниям легких и кожным повреждениям.
4. ТУГОПЛАВКИЕ МЕТАЛЛЫ
Одни источники устанавливают пороговую величину как 4000 F. В переводе на привычную шкалу это дает 2204°C. Согласно этому критерию, к жаропрочным относятся только пять элементов: вольфрам, ниобий, рений, тантал и молибден. Например, температура плавления вольфрама составляет 3422°C.
Другое утверждение позволяет расширить класс температуростойких материалов, поскольку принимает за точку отсчета температуру плавления железа — 1539°C. Это позволяет увеличить список еще на девять элементов, включив в него титан, ванадий, хром, иридий, цирконий, гафний, родий, рутений и осмий.
5. РАССЕЯННЫЕ МЕТАЛЛЫ — это техническое название некоторых редких металлов, встречающиеся главным образом в виде примеси в различных минералах и извлекаемых попутно из руд других металлов или полезных ископаемых (углей, солей, фосфоритов и пр.). Рассеянные металлы даже при высоком содержании в земной коре, самостоятельных минералов, как правило, не образуют. Свойства редких металлов весьма разнообразны и необычайно ценны. Главным образом рассеянные металлы используют в сплавах с цветными металлами и используются в металлургии, химической и атомной промышленности, медицине, электротехнике.
6. РЕДКОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — это сравнительно небольшая группа элементов, которая насчитывает всего 17 представителей. Все они представлены веществами серебристо-белого цвета.
А к 1907 году было обнаружено уже 14 таких элементов.
Данные элементы используются в совершенно различных отраслях. Например, их широко применяют в стекольной промышленности. Во-первых, они повышают светопрозрачность стекла. Во-вторых, эти металлы используются для производства стекла специального назначения — стекла, поглощающие ультрафиолетовые лучи или пропускающие инфракрасные излечения. С помощь редкоземельных веществ производят жаростойкие стекла.
В нефтепереработке эти элементы выступают в роли катализаторов. Их используют также в химической промышленности для производства высококачественных красок, лаков и пигментов.
7. РАДИОАКТИВНЫЕ МЕТАЛЛЫ — это металлы, которые самопроизвольно излучают поток элементарных частиц во внешнюю среду. Этот процесс называют альфа(α), бета(β), гамма(γ) излучением или просто радиоактивным излучением .
Все радиоактивные металлы со временем распадаются и превращаются в стабильные элементы (иногда проходя целую цепочку превращений). У разных элементов радиоактивный распад может длиться от нескольких миллисекунд до нескольких тысяч лет.
В периодической системе Менделеева железо входит в группу VIIIВ. В четвертом периоде, к которому принадлежит и железо, в эту группу входят, кроме железа, также кобальт и никель. Эти три элемента образуют триаду и обладают сходными свойствами.
Радиус нейтрального атома железа 0,126 нм, радиус иона Fe2+ - 0,080 нм, иона Fe3+ - 0,067 нм. Энергии последовательной ионизации атома железа 7,893, 16,18, 30,65, 57, 79 эВ. Сродство к электрону 0,58 эв. По шкале Полинга электроотрицательность железа около 1,8.
Железо высокой чистоты - это блестящий серебристо-серый, пластичный металл, хорошо поддающийся различным способам механической обработки.
1. Нахождение в природе
В земной коре железо распространено достаточно широко - на его долю приходится около 5,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2· n H2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия - серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. В свободном состоянии железо находят только в падающих на землю метеоритах. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10-5-1·10-8% железа.
2. История получения железа
Железо играло и играет исключительную роль в материальной истории человечества. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли, но самородное железо на поверхности крайне редко. Вероятно, еще несколько тысяч лет назад человек заметил, что после горения костра в некоторых случаях наблюдается образование железа из тех кусков руды, которые случайно оказались в костре. При горении костра восстановление железа из руды происходит за счет реакции руды как непосредственно с углем, так и с образующимся при горении оксидом углерода (II) СО. Возможность получения железа из руд существенно облегчило обнаружение того факта, что при нагревании руды с углем возникает металл, который далее можно дополнительно очистить при ковке. Получение железа из руды с помощью сыродутного процесса было изобретено в Западной Азии во 2-м тысячелетии до нашей эры. Период с 9-7 века до нашей эры, когда у многих племен Европы и Азии развилась металлургия железа, получил название железного века, пришедшего на смену бронзовому веку. Усовершенствование способов дутья (естественную тягу сменили меха) и увеличение высоты горна (появились низкошахтные печи - домницы) привело к получению чугуна, который стали широко выплавлять в Западной Европе с 14 века. Полученный чугун переделывали в сталь. С середины 18 века в доменном процессе вместо древесного угля начали использовать каменно-угольный кокс. В дальнейшем способы получения железа из руд были значительно усовершенствованы, и в настоящее время для этого используют специальные устройства - домны, кислородные конвертеры, электродуговые печи.
3.Физические и химические свойства
При температурах от комнатной и до 917°C, а также в интервале температур 1394-1535°C существует α-Fe с кубической объемно центрированной решеткой, при комнатной температуре параметр решетки а = 0,286645 нм. При температурах 917-1394°C устойчиво α-Fe с кубической гранецентрированной решеткой Т (а = 0,36468 нм). При температурах от комнатной до 769°C (так называемая точка Кюри) железо обладает сильными магнитными свойствами (оно, как говорят, ферримагнитно), при более высоких температурах железо ведет себя как парамагнетик. Иногда парамагнитное -Fe с кубической объемно центрированной решеткой, устойчивое при температурах от 769 до 917°C, рассматривают как α-модификацию железа, а γ-Fe, устойчивое при высоких температурах (1394-1535°C), называют по традиции γ-Fe (представления о существовании четырех модификаций железа - α,β,γ и δ- возникли тогда, когда еще не существовал рентгеноструктурный анализ и не было объективной информации о внутреннем строении железа). Температура плавления 1535°C, температура кипения 2750°C, плотность 7,87 г/см3. Стандартный потенциал пары Fe2+/Fe0 –0,447В, пары Fe3+/Fe2+ +0,771В.
При хранении на воздухе при температуре до 200°C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe2О3, при сгорании в чистом кислороде - оксид Fe3О4. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeО. При нагревании порошка серы и железа образуется сульфид, приближенную формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200-300°C. При хлорировании железа (при температуре около 200°C) образуется летучий FeСl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeСl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа (II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с монооксидом углерода СО, причем образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава [Fe(-C5H5)2].
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа (III):
2Fe + 4H2SO4 = Fe2(SO4)3 + SO2 + 4H2O
Оксид железа (II) FeО обладает основными свойствами, ему отвечает основание Fe(ОН)2. Оксид железа (III) Fe2O3 слабо амфотерен, ему отвечает еще более слабое, чем Fe(ОН)2, основание Fe(ОН)3, которое реагирует с кислотами:
2Fe(ОН)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксид железа (III) Fe(ОН)3 проявляет слабо амфотерные свойства; он способен реагировать только с концентрированными растворами щелочей:
Fe(ОН)3 + КОН = К[Fe(ОН)4]
Образующиеся при этом гидроксокомплексы железа(III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причем в осадок выпадает гидроксид железа(III) Fe(OH)3.
Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 = 3FeCl2
При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III):
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2
Из солей железа(II) в водных растворах устойчива соль Мора - двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2О.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 - железокалиевые квасцы, (NH4)Fe(SO4)2 - железоаммонийные квасцы и т.д.
Для обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами CNS-. При взаимодействии ионов Fe3+ с анионами CNS- образуется ярко-красный роданид железа Fe(CNS)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (ранее это вещество называли желтой кровяной солью). При взаимодействии ионов Fe3+ и [Fe(CN)6]4- выпадает ярко-синий осадок.
Реактивом на ионы Fe2+ в растворе может служить раствор гексацианоферрат(III) калия K3[Fe(CN)6], ранее называвшегося красной кровяной солью. При взаимодействии ионов Fe3+ и [Fe(CN)6]3- выпадает ярко-синий осадок такого же состава, как и в случае взаимодействия ионов Fe3+ и [Fe(CN)6]4-.
Сплавы железа с углеродом
Чугун получают в домнах. Домна представляет собой гигантский (высотой до 30-40 м) усеченный конус, полый внутри. Стенки домны изнутри выложены огнеупорным кирпичом, толщина кладки составляет несколько метров. Сверху в домну вагонетками загружают обогащенную (освобожденную от пустой породы) железную руду, восстановитель кокс (каменный уголь специальных сортов, подвергнутый коксованию - нагреванию при температуре около 1000°C без доступа воздуха), а также плавильные материалы (известняк и другие), способствующие отделению от выплавляемого металла примесей - шлака. Снизу в домну подают дутье (чистый кислород или воздух, обогащенный кислородом). По мере того, как загруженные в домну материалы опускаются, их температура поднимается до 1200-1300°C. В результате реакций восстановления, протекающих главным образом с участием кокса С и СО:
Fe2O3 + 3C = 2Fe + 3CO;
Fe2O3 + 3CО = 2Fe + 3CO2
возникает металлическое железо, которое насыщается углеродом и стекает вниз.
Этот расплав периодически выпускают из домны через специальное отверстие - клетку - и дают расплаву застыть в специальных формах. Чугун бывает белый, так называемый предельный (его используют для получения стали) и серый, или литьевой. Белый чугун - это твердый раствор углерода в железе. В микроструктуре серого чугуна можно различить микрокристаллики графита. Из-за наличия графита серый чугун оставляет след на белой бумаге.
Чугун хрупок, при ударе он колется, поэтому из него нельзя изготавливать пружины, рессоры, любые изделия, которые должны работать на изгиб.
Твердый чугун легче расплавленного, так что при его затвердевании происходит не сжатие (как обычно при затвердевании металлов и сплавов), а расширение. Эта особенность позволяет изготавливать из чугуна различные отливки, в том числе использовать его как материал для художественного литья.
Если содержание углерода в чугуне снизить до 1,0-1,5%, то образуется сталь. Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома, никеля, молибдена, кобальта и других металлов, улучшающие механические и иные свойства стали).
Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.
Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. Так как сталь, в отличие от чугуна, при затвердевании сжимается, то полученные стальные отливки подвергают обжатию на прокатных станах. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.
Производство сталей имеет в России давние глубокие традиции, и полученные нашими металлургами стали отличаются высоким качеством.
4. Применение железа, его сплавов и соединений
Чугун и сталь являются сплавами железа с углеродом. Чугун содержит более 2,14% углерода, а сталь обычно содержит несколько десятых процентов углерода. Чугун также содержит небольшое количество кремния, фосфора и серы.
Различают серый чугун (содержит 2-3,5%C, а также,Si и Mn) – он не очень твердый, хорошо отливается в формы, хрупкий и при ударе легко раскалывается. Серый чугун идет на отливку машинных станин, маховых колес, канализационных труб, плит и т.п.
Чугун, в котором почти весь углерод содержится в виде цементита(Fe3 C),тверже и беле серого чугуна, он называется белый чугун (содержит 2-3,5%C,Si>1%,Mn-1-1,5%). Белый чугун непосредственного применения не имеет и идет в предел на сталь.
Сталь, в отличие от чугуна, легко поддаётся ковке и прокатке. При быстром охлаждении она получается очень твердой, при медленном охлаждении мягкой. Мягкую сталь легко обрабатывают. Из неё делают гвозди, болты, проволоку, кровельное железо, детали машин. Из твердой стали изготавливают инструменты. Большое значение имеют в современной технике легированные стали. Они содержат так называемые легирующие элементы, к которым относятся хром, никель, молибден, ванадий, вольфрам, марганец, медь, кремний и др. Легирующие элементы добавляются для придания стали определённых свойств.
На производстве используют стали со следующими легирующими элементами:
1. Стали, содержащие Cr, - твердые, устойчивые к коррозии. Используются для изготовления инструментов.
2. Стали, содержащие Ni,- вязкие, механически прочные, устойчивы к коррозии. Применяются для изготовления турбин, измерительных приборов, деталей, используемых при высоких температурах.
3. Стали, содержащие Mn, - обладают твердостью, механической прочностью, устойчивостью к ударениям, трению. Используются в деталях дробильных установок, для изготовления железнодорожных рельсов.
4. Стали, содержащие Ti, - жаростойки, обладают прочностью к высоким температурам, устойчивы к коррозии. Используется в самолётах, ракето- и судостроении.
5. Стали, содержащие вольфрам W, - твердые, жаропрочные и износоустойчивые. Используют для изготовления пил, фрез, штампов, нитей электрических ламп.
6. Стали, содержащие молибден Mo, - эластичные, жаростойкие, устойчивые к коррозии. Используются для изготовления лопастей турбин, броневых плит.
7. Стали, содержащие кремний Si, - обладают устойчивостью к кислотам. Используются для изготовления кислотоупорных автодеталей. Процесс насыщения кремнием называется цементацией.
8. Стали, содержащие ванадий V, - обладают высокой прочностью, упругостью, устойчивостью к ударам. Используется для изготовления деталей машин.
9. Азотированная сталь – обладает большей твердостью, чем цементированная. Выдерживает нагревание до 500 градусов, не теряя своей твердости. Используется для изготовления деталей машин.
Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов, для некоторых других целей. Но сплавы железа - чугун и сталь - составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа(III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.
5. Железо в организме
Железо присутствует в организмах всех растений и животных как микроэлемент, то есть в очень малых количествах (в среднем около 0,02%). Однако железобактерии, использующие энергию окисления железа(II) в железо(III) для хемосинтеза, могут накапливать в своих клетках до 17-20% железа. Основная биологическая функция железа - участие в транспорте кислорода и окислительных процессах. Эту функцию железа выполняет в составе сложных белков - гемопротеидов, простатической группой которых является железопорфириновый комплекс - гем. Среди важнейших гемопротеидов дыхательные пигменты гемоглобин и миоглобин, универсальные переносчики электронов в реакциях клеточного дыхания, окисления и фотосинеза цитохромы, ферменты каталаза и пероксида, и других. У некоторых беспозвоночных железосодержащие дыхательные пигменты гелоэритрин и хлорокруорин имеют отличное от гемоглобинов строение. При биосинтезе гемопротеидов железо переходит к ним от белка ферритина, осуществляющего запасание и транспорт железа. Этот белок, одна молекула которого включает около 4 500 атомов железа, концентрируется в печени, селезенке, костном мозге и слизистой кишечника млекопитающих и человека. Суточная потребность человека в железе (6-20 мг) с избытком покрывается пищей (железом богаты мясо, печень, яйца, хлеб, шпинат, свекла и другие). В организме среднего человека (масса тела 70 кг) содержится 4,2 г железа, в 1 л крови - около 450 мг. При недостатке железа в организме развивается железистая анемия, которую лечат с помощью препаратов, содержащих железо. Препараты железа применяются и как общеукрепляющие средства. Избыточная доза железа (200 мг и выше) может оказывать токсичное действие. Железо также необходимо для нормального развития растений, поэтому существуют микроудобрения на основе препаратов железа.
6. Железо в корме
Железо обычно находится в кормах в виде иона Fe 3+ , который связан с белками или органическими кислотами. При участии аскорбиновой кислоты в желудке животного Fe 3+ восстанавливается в Fe 2+ . Обычно лишь около 10% железа кормов абсорбируется в кишечнике, откуда оно поступает в печень, где частично депонируется в составе белка ферритина ( являющимся депо Fe 3+ ).
Ферритин синтезируется печенью как гликопротеин, который может связывать более 4000 атомов железа на одну молекулу белка. Гемосидерин является нерастворимым соединением железа, производным ферритина; высокое содержание железа, производным ферритина; высокое содержание железа в тканях вызывает токсический эффект и приводит к гемохроматозу.
Другая часть железа, поступившего в организм, в составе трансферрина поступает в костный мозг на синтез гемма.
Роль железа в организме велика. Железо входит в структуру костной ткани, скорлупы. Железо находится в составе каталазы, пероксидаз, активных участников реакций биологического окисления. Как компонент гемоглобина и миоглобина, железо необходимо для транспорта кислорода и углекислоты. В частности, из общего количества железа в организме 60-70% составляет железо в составе гемоглобина. Как компонент цитохромов и негеминовых белков, железо необходимо для реакций окислительного фосфорилирования. Как компонент важного лизосомального фермента миелопероксидазы, железо участвует в фагоцитозе и разрушении бактерий нейтрофилами. Поэтому снижение доступности железа для данного фермента фагатоцитов может нарушить переваривающую способность этих клеток в отношении бактерий.
Железо необходимо для поддержания функций лимфоидных тканей, куда оно доставляется трансферрином, для связывания которого на наружной мембране клеток имеется специальные рецепторы; недостаток железа вызывает атрофию лимфоидных тканей средней степени.
У различных животных содержание железа в крови колеблется в широких пределах (в среднем от 13 до 39 мкМ), данные приведены в Приложении. Признаком недостаточности железа в организме является анемия (малокровие). Более часто анемия этой этиологии наблюдается у новорожденных поросят, поскольку в молоке свиноматок обычно низкий уровень этого элемента.
Недостаток железа у цыплят и индюшат приводит к гипохромной анемии. У цыплят красного оперения отмечают полную депигментацию оперения
Читайте также:

