Строение атома фосфора доклад
Обновлено: 19.05.2024
1s 2 2s 2 2p 6 3s 2 3p 3 , фосфор: p– элемент, неметалл
Валентные возможности фосфора шире, чем у атома азота, так как в атоме фосфора имеются свободные d-орбитали. Поэтому может произойти распаривание 3s 2 – электронов и один из них может перейти на 3d– орбиталь. В этом случае на третьем энергетическом уровне фосфора окажется пять неспаренных электронов и фосфор сможет проявлять валентность V.
Фосфор может существовать в виде большого числа аллотропных модификаций, в настоящее время их насчитывается 11, но все многообразие видов можно свести к трем: белый , красный и черный фосфор.
Аллотропные видоизменения фосфора
Взаимопревращение аллотропных модификаций фосфора
Наиболее распространен белый , или желтый, фосфор . Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р 4 . Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле, нерастворимое в жидкой воде, с водяным паром образует газовую смесь. Очень ядовито. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления. Температура плавления 44 °С. В лаборатории его хранят под слоем воды.
Название красный фосфор (атомная кристаллическая решётка) относится к нескольким модификациям, различающимся по плотности и окраске: она колеблется от оранжевой до темно-красной и даже фиолетовой. Красный фосфор, образующийся при нагревании белого до 320 °С без доступа воздуха, является рентгеноаморфным, при дальнейшем нагревании до 560 °С переходит в кристаллическое состояние за счет разрыва одной связи Р – Р в тетраэдре Р 4 и дальнейшего связывания оставшихся групп в цепи, кольца и трубки. Такая полимеризация приводит к упрочнению связи Р – Р, увеличению плотности и температуры плавления до 600 °С и уменьшению реакционной способности. Красный фосфор менее активен, чем белый, нерастворим в воде и сероуглероде, не светится в темноте, абсолютно безвреден.
При повышенном давлении белый фосфор переходит в черный фосфор (атомная кристаллическая решётка) . Это самая устойчивая модификация фосфора. Кристаллический черный фосфор тоже имеет несколько модификаций. Ромбическая модификация построена из гексагональных колец Р 6 , упакованных в слои, причем кольца не являются плоскими.
По внешним признакам черный фосфор напоминает металл, имеет металлический блеск, обладает электропроводностью, теплопроводностью, довольно твердый. Наименее активный из всех модификаций.
Красный и черный фосфор получают из белого фосфора.
В природе фосфор встречается в виде двух аллотропных модификаций – белый фосфор и красный фосфор, которые резко различаются по физическим свойствам.
Из-за большой химической активности фосфор в природе встречается только в виде соединений.
Нахождение в природе
Общее содержание фосфора в земной коре составляет 0,08%. В связанном виде он входит в состав многих минералов, главным образом апатитов 3Ca 3 (РО 4 ) 2 хСаF 2 и фосфатов Са 3 (РO 4 ) 2 . Разновидности апатита слагают осадочные горные породы — фосфориты, фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах - 0,27%.
Самые богатые в мире залежи апатитов находятся близ г. Кировска на Кольском полуострове. Фосфориты широко распространены на Урале, в Поволжье, в Сибири, Казахстане, Эстонии, Белоруси и др. Большие месторождения фосфоритов имеются в Северной Африке, Сирии и США. Фосфор необходим для жизни растений. Поэтому почва всегда должна содержать достаточное количество соединений фосфора.
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са 3 (РО 4 ) 3 ·CaF 2 . В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800-1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
ТОКСИКОЛОГИЯ ФОСФОРА
Красный фосфор практически нетоксичен. Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м³.
ПОЛУЧЕНИЕ ФОСФОРА
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Р – окислитель
1. С металлами — окислитель, образует фосфиды:
Фосфиды разлагаются кислотами и водой с образованием газа фосфина
Свойства фосфина:
Р – восстановитель
1. Фосфор легко окисляется кислородом:
4P + 5O 2 = 2P 2 O 5 (с избытком кислорода),
4P + 3O 2 = 2P 2 O 3 (при медленном окислении или при недостатке кислорода)
2. С неметаллами — восстановитель:
! Не взаимодействует с водородом
3. Сильные окислители превращают фосфор в фосфорную кислоту:
4. Реакция окисления также происходит при поджигании спичек , в качестве окислителя выступает бертолетова соль:

Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :

Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:

При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.


Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой . Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300 о С без доступа воздуха.


Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.

Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор , который очень хорошо проводит электрический ток.

В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Относится к элементам p-семейства. Неметалл. Обозначение – P. Порядковый номер – 15. Относительная атомная масса – 30,974 а.е.м.
Электронное строение атома фосфора
Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
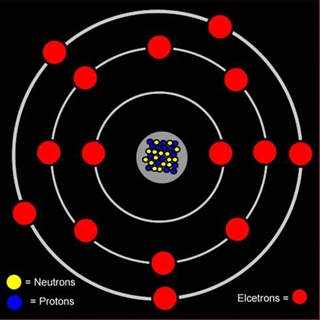
Рис.1. Схематическое строение атома фосфора.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
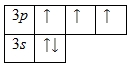
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
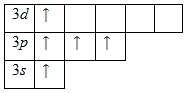
Именно поэтому для фосфора также характерна степень окисления +5.
Примеры решения задач
| Задание | Определите число нейтронов в ядре изотопа титана с массовым числом 48. |
| Решение | Массовое число А указывает суммарное число протонов Z и нейтронов в ядре атома любого элемента: |
Атом титана имеет порядковый номер 22, следовательно, количество протонов в ядре равно 22 (Z=22). Тогда число нейтронов в ядре атома титана определим по формуле:
n= A- Z =.48 -22 = 26.
| Задание | Элемент состоит из двух изотопов в соотношении 2:3. Ядро первого изотопа содержит 10 протонов и 10 нейтронов. Определите атомную массу второго изотопа, если средняя относительная масса элемента равна 21,2. В ответе укажите на сколько нейтронов больше в ядре атома второго изотопа. |
| Решение | Относительная атомная масса первого изотопа равна: |
A1 = Z +n = 10 + 10 = 20 а.е.м.
Относительную атомную массу второго изотопа обозначим через A2.
Средняя относительная атомная масса элемента определяется суммой масс его изотопов с учетом их количества. Составим уравнение:
В ядре атома второго изотопа 10 протонов, следовательно, число, нейтронов будет равно n= A- Z =.22 — 10= 12. По условию задачи в ядре атома первого изотопа было 10 нейтронов. Значит, ядро атома второго изотопа содержит на два нейтрона больше, чем ядро первого изотопа.
Ключевые слова конспекта: свойства простых веществ, фосфор, строение и физические свойства, химические свойства, производство и применение фосфора.
Фосфор – элемент группы VA. Его важнейшие параметры приведены в таблице.
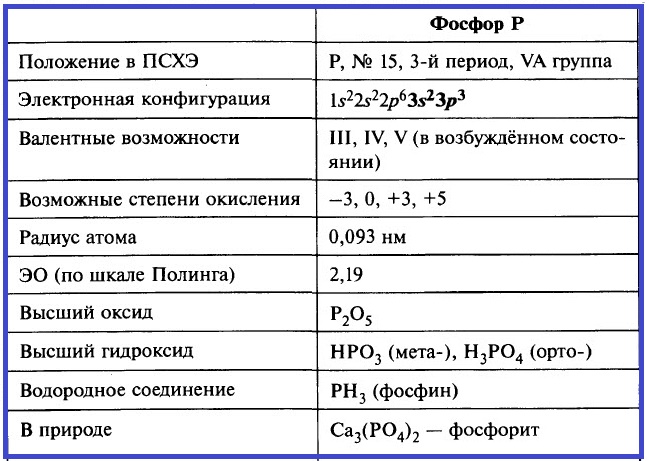
Таблица. Важнейшие параметры элемента фосфор.
На валентном слое атома фосфора, в отличие от азота, есть вакантные 3d-орбитали. В отличие от азота, фосфор может быть пятивалентным. В этом случае атомы фосфора находятся в возбуждённом состоянии:

СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Элемент фосфор образует несколько простых веществ, среди которых наиболее известны белый, красный и чёрный фоcфоp.
Белый фосфор состоит из тетраэдрических молекул Р4. В молекуле все связи одинарные ковалентные неполярные. С Р4 связи Р – Р легко разрываются. Этим объясняется высокая химическая активность белого фосфора и его склонность переходить (при хранении или при нагревании) в более стабильные полимерные модификации.
При обычных условиях это твёрдое белое вещество, мягкое как воск (легко режется ножом), летучее при слабом нагревании, легкоплавкое (t°пл = 44 °С), практически нерастворимое в воде (его хранят под слоем воды), хорошо растворимое в неполярных растворителях (например, в сероуглероде CS2). Уже при обычных условиях легко испаряется и в газообразном состоянии окисляется кислородом воздуха, освобождающаяся в результате окисления энергия выделяется в виде света, что и является причиной свечения белого фосфора на воздухе.
Красный фocфор – это твёрдое аморфное вещество красного цвета (от тёмно-коричневого до красного и фиолетового), возгоняется при нагревании. При конденсации паров образуется белый фосфop. Красный фoсфoр нерастворим ни в воде, ни в сероуглероде, ни в других растворителях.
Чёрный фосфор представляет собой вещество немолекулярного строения, кристаллическая решётка атомно–слоистая, с характерным для фосфора пирамидальным расположением связей. Чёрный фосфор твёрдый, по внешнему виду похож на графит, проводит электрический ток, имеет высокую t°пл (587 °С).
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА

Фосфор – более активное вещество, чем азот. Фосфору присуща окислительно-восстановительная двойственность. По отношению к металлам фосфор выступает в роли окислителя, образуя фосфиды:
По отношению к большинству неметаллов фосфop выступает в роли восстановителя. При недостатке окислителя обычно образуются соединения фосфора(III), при избытке – соединения фосфора(V), например, РCl3 и РCl5.

Фосфор сгорает на воздухе и в кислороде. Белый фосфор самовоспламеняется в атмосфере кислорода. На воздухе белый фосфор воспламеняется при 50 °С, красный – при температуре выше 250 °С, чёрный – при температуре выше 400 °С. При этом образуются оксиды фосфора. В избытке кислорода образуется оксид фосфора (V):

При нагревании выше 100 °С фосфор бурно взаимодействует с серой с образованием смеси сульфидов (P2S5, P2S3):

Красный и белый фocфор самовозгораются в атмосфере фтора и хлора:
С водородом и азотом фосфор практически не взаимодействует.
Фосфор восстанавливает азотную и серную концентрированные кислоты, хлораты и некоторые другие окислители. Так, например, каждый раз, зажигая спичку, мы проводим реакцию между бертолетовой солью, которая входит в состав спичечной головки, и красным фосфором, нанесённым на спичечный коробок:
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ФОСФОРА

Сырьём для получения фосфора являются фосфориты, основной компонент которых – ортофосфат кальция. Фосфорит измельчают, смешивают с песком и углём и прокаливают в электропечах без доступа воздуха. Происходит восстановление фосфора:
Основная область использования фосфора – производство спичек. Кроме того, фocфор применяется в металлургии для синтеза фосфорорганических соединений, к числу которых относятся очень ядовитые средства для борьбы с вредителями–насекомыми (инсектициды). Фoсфор используется для получения некоторых полупроводников (фосфидов галлия GaP и индия InP). Фоcфoр также используется для получения оксида фосфора (V), который является сильным водоотнимающим реагентом.
Читайте также:

