Практическое использование ферментов в народном хозяйстве в научных исследованиях и медицине доклад
Обновлено: 05.07.2024
На сегодняшний день в различных отраслях хозяйства применение ферментов является передовым достижением. Особое значение ферменты нашли в пищевой промышленности. Ведь именно из-за наличия ферментов в тесте происходит его поднятие и разбухание. Как известно, разбухание теста происходит под действием углекислого газа CO2, который в свою очередь образуется в результате разложения крахмала под действием фермента амилазы, которая уже содержится в муке. Но в муке этого фермента не достаточно, его, обычно, добавляют. Ещё один фермент протеазы, придающий тесту клейковину, способствует удержанию углекислого газа в тесте.
Изготовление алкогольных напитков также не обходится без участия ферментов. В этом случае широко применяются ферменты, которые находятся в дрожжах. Разнообразие сортов пива получают именно различными комбинациями комплексных соединений ферментов. Ферменты, также участвуют в растворении осадков в спиртных напитках, например, чтобы в пиве не появлялся осадок в него добавляют протеазы (папаин, пепсин), которые растворяют выпадающие в осадок белковые соединения.
Производство кисломолочных продуктов, например, простокваши, основана на химическом превращении лактозы (то есть молочного сахара) в молочную кислоту. Кефир производят подобным образом, но производственной особенностью является то, что берут не только кисломолочные бактерии, но и дрожжи. В результата переработки лактозы образуется не только молочная кислоты, но ещё и этиловый спирт. При получении кефира происходит ещё одна достаточно полезная для организма человека реакция - это гидролиз белков, что в последствии употребления человеком кефира способствует его лучшему усвоению.
Производство сыра тоже связано с ферментами. Молоко содержит белок - казеин, который в процессе химической реакции под действием протеаз изменяется, и в результате реакции выпадает в осадок.
Протеазы широко используют для обработки кожевельного сырья. Его способность производить гидролиз белков (расщепление белков) широко применяют для выведения стойких пятен от шоколада, соусов, крови и т.д. Фермент целлюлаза - используется в стиральных порошках. Он способен удалять "катышки" с поверхности тканей. Важной особенностью стирки с порошками, содержащими целые комплексы ферментов, является то, что стирка в должна выполняться в тёплой, но не горячей воде, так как горячая вода для ферментов является губительной.
Применение ферментов в медицине связано с их способностью заживлять раны, растворять образующиеся тромбы. Иногда ферменты умышленно вводят в организм для их активизации, а иногда из-за излишней активности ферментов, могут вводить вещества, которые действуют как ингибиторы (вещества, замедляющие протекание химических реакций). Например, под действием отдельных ингибиторов, бактерии теряют способность размножаться и расти.
Применение ферментов в медицине также связано с проведением различных анализов по определению заболеваний. В этом случае ферменты играют роль веществ, вступающих в химическое взаимодействие или способствующие химическим превращениям в физиологических жидкостях организма. В результате получаются определённые продукты химических реакций, по которым в лабораториях распознают наличие того или иного возбудителя заболевания. Среди таких ферментов и их применения наиболее известен фермент глюкозооксидаза который позволяет определить наличие сахара в моче или крови человека. Кроме того, наравне с отмеченным, существуют ферменты, которые способны определять наличие алкоголя в крови. Этот фермент называется алкогольдегидрогеназа
Как отделить фермент от продуктов реакции
Представим себе, что у нас имеется фермент в жидком состоянии, он готов к проведению химической реакции. Но как же отделить фермент от продуктов реакции!? Для таких целей специально используются твёрдые катализаторы, тогда отделение продуктов реакции не составляет труда. Кроме того, ещё во второй половине 20 века научились прикреплять ферменты к твёрдым веществам – носителям. Такой процесс носить название - иммобилизация ферментов, то есть их неподвижность; он стал широко применяться в каталитических реакция.
Существует два способа прикрепления ферментов к носителю: первый способ – на физическом уровне, то есть фермент не образует химических связей с носителем; второй – химический – соответственно с образованием химических связей. В физическом методе используется адсорбция (связывание вещества с поверхность тела). В этом случае фермент прикрепляется к твёрдому телу-носителю с помощью, например, электростатических связей. Конечно такое крепление фермента не является прочным!
По-другому, существуют физические методы, которые крепко держат фермент возле носителя. Для этого нужно, чтобы структура носителя представляла собой решёточный вид, за которую попадает фермент и задерживается там. В процессе химической реакции реагенты попадают за решётку, подвергаются действию фермента, после чего продукты реакции свободно выходят из-за решётки.
Для иммобилизации фермента (его неподвижности) можно использовать гели, которые представляют собой один из видов дисперсных системы, состоящих из множества мелких частичек различных молекул. Путём водородных связей эти частицы удерживаются друг возле друга, таким образом формируя пространственную решётку (или структуру). Если в таком растворе будет содержаться фермент, то он удерживается такой структурой.
Иммобилизация фермента может осуществляться химическим способом: белок фермента прикрепляется химической связью к носителю и к соседнему ферменту, таким образом, образуя целые неподвижные цепочки больших размеров (снаружи - будто твёрдая частица). Соединённые таким способом ферменты в химических реакциях не соединяются с продуктами реакций. Кроме того, белок фермента менее подвержен денатурации из-за того, что его он теряет чрезмерную подвижность и к тому же в таком состоянии, как показали исследования, ферменты трудно разрушить.
Заказать 3D коврики EVA можно по каталогу нашего магазина

Перейти на английский
Use of enzymes
Научный руководитель: к.х.н., ст. преп. Куликова Л.Н.
ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ
Кафедра общей, биоорганической и фармацевтической химии
Успехи современной биохимии позволили учение о ферментах превратить в интенсивно развивающуюся область знания.
Ферменты (от лат. fermentum - закваска) – белковые катализаторы, которые с высокой специфичностью и эффективностью в миллионы раз ускоряют химические превращения при обмене веществ. Дыхание, пищеварение, мышечные сокращения и другие процессы в живом организме осуществляются с помощью ферментов.
Целью исследования было выяснить способы использования ферментов в медицинской практике и сравнить некоторые препараты по эффективности основного действия.
Применение ферментов в медицине разнообразно. Протеолитические ферменты (трипсин, фибринолизин) применяют для обработки гнойных ран с целью расщепления погибших клеток, для удаления сгустков крови или вязких секретов при воспалениях дыхательных путей, при тромбозах. Фермент гиалуронидазу, катализирующий расщепление гиалуроновой кислоты, используют для рассасывания рубцов после ожогов и операций. Аспарагиназа нашла применение для лечения лейкозов. Ферменты на твердом носителе применяют в анализе – ферментные электроды, тест-полоски и т.д.
При нарушении пищеварения применяются ферментные препараты, делимые на группы, в том числе:
1. Панкреатические энзимы, представленные амилазой, липазой и трипсином (панкреатин, мезим-форте, креон).
2. Комбинированные ферменты, содержащие панкреатин в комбинации с компонентами желчи, гемицеллюлозой (фестал, энзистал).
Для сравнения эффективности расщепления жиров нами были выбраны доступные препараты из 1 и 2 группы - панкреатин и фестал.
Методом исследования выбран титриметрический анализ. Он позволил оценить скорость расщепления жиров пищи липазой по скорости накопления кислот.
Скорость и эффективность воздействия на жир панкреатина оказалась выше, чем у фестала. Заявлено, что в организме фестал, за счет желчных кислот, увеличивает панкреатическую секрецию. В условиях опыта это недостижимо. Панкреатин же работает находящимися в нем панкреатическими ферментами, не дожидаясь помощи организма.
Вы можете изучить и скачать доклад-презентацию на тему Применение ферментов в медицине. Презентация на заданную тему содержит 27 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!



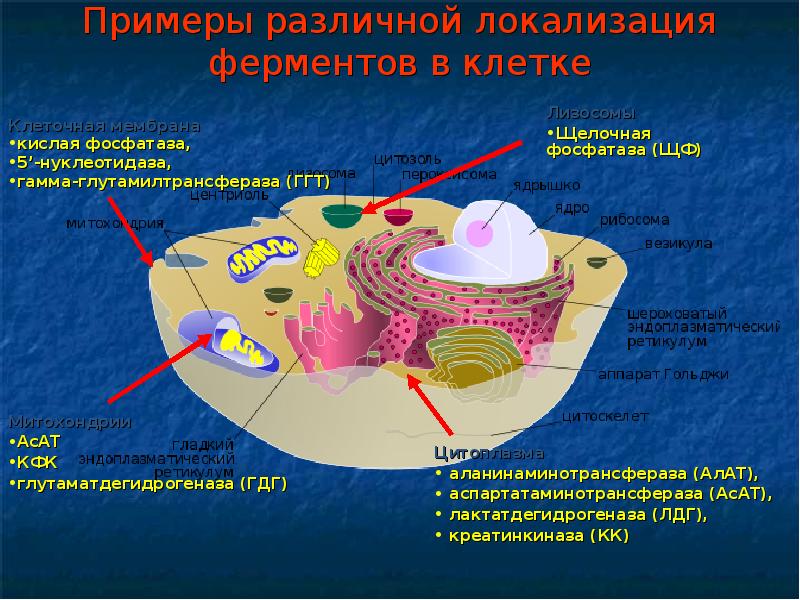






















Изоферменты фермент, существующий в виде нескольких изоформ ферменты из одного источника катализируют одну и ту же реакцию отличаются по а/к составу могут иметь различный молекуллярный вес разную электрофоретическую подвижность разные иммунологические/биохимические характеристики различный рН-оптимум разная стабильность разные способы регуляции ЛДГ – 5 изоформ – тетрамеры – комбинация 2 типов субъединиц КК – 2 субъединицы – 3 изоформы
ЕДИНИЦЫ АКТИВНОСТИ ФЕРМЕНТОВ За международную единицу активности принимается количество фермента, способного превратить один микромоль (мкмоль) субстрата за 1 мин. в стандартных условиях. Международные единицы количества фермента отражаются символом Е (U). 1 Е (U) = 1 мкмоль/мин = 16,67 нмоль/с. Удельная активность фермента равняется его массе (в миллиграммах), которая способна превратить 1 мкмоль субстрату за 1 мин в стандартных условиях, и выражается у мкмоль/(мин • мг) белка.
катал (символ – кат.), что являет собой количество фермента, способное осуществить превращение 1 моля субстрата за 1 сек в стандартных условиях (кат = моль/с). Исходя из этого, 1 Е (1 U) = 16,67 нкат. катал (символ – кат.), что являет собой количество фермента, способное осуществить превращение 1 моля субстрата за 1 сек в стандартных условиях (кат = моль/с). Исходя из этого, 1 Е (1 U) = 16,67 нкат. В пересчете на 1 л биологического материала активность фермента выражают в Е/л, (U/L), кат/л = моль/(с • л).
Принципы энзимодиагностики 1. Состав ферментов и их тканевое деление постоянны и могут изменяться при разных патологических состояниях 2. Для каждой ткани (органа) характерен свой качественный и количественный состав белков, что обусловливает функциональные особенности каждой ткани; 3. Метаболические пути в разных тканях очень похожи, потому существует немного тканьспецифичных ферментов (например, кислая фосфатаза предстательной железы, орнитинкарбамоил-трансфераза и гистидаза печени); 4. Более специфическим для тканей является соотношение разных ферментов и изоферментов.
Причины повышения активности клеточных ферментов в крови нарушение проницаемости мембраны клеток (при воспалительных процессах) нарушение целостности клеток (при некрозе) повышенная пролиферация клеток с ускорением клеточного цикла (например, при онкопролиферативных процессах) повышенный синтез ферментов обструкция путей секреции ферментов в полости снижение клиренса (например, активность амилазы в сыворотке повышается при острой почечной недостаточности)
Основные ферменты, которые исследуются в лабораториях аспартатаминотрансфераза (AcAT) аланинаминотрансфераза (АЛАТ) глутаматдегидрогеназа (ГЛД) лактатдегидрогеназа (ЛДГ) креатинкиназа (КК) щелочная фосфатаза (ЛФ) кислая фосфатаза (КФ) альдолаза (АЛД) холинестераза (ХЕ) ά-амилаза (AM) липаза (ЛП) аланинаминопептидаза (ААП) глюкозо-6-фосфатаза γ-глутамилтрансфераза (ГЛТ) аргиназа (Ар) сорбитолдегидрогеназа (СД) алкогольдегидрогеназа (АДГ)
Аминотрансферазы играют важную роль в азотистом обмене, принимают участие в расщеплении аминокислот, которые не используются в процессах биосинтеза, катализируют реакцию переаминирования, в которой происходит как бы обмен аминогруппы (Nh2) между аминокислотой и кетокислотой.
Аспартатаминотрансфераза (АСАТ) [КФ 2.6.1.1]. N 0,1-0,45 ммоль/(час/л) Основные источники: сердечная мышца, печень, скелетная мускулатура, головной мозг, почки. Изоферменты: митохондриальная АСАТ (м-АсАТ) и цитозольная АСАТ (ц-АсАТ). Активность АСАТ в сердечной мышце почти в 10 000 раз выше, чем в сыворотке крови. В эритроцитах АСАТ в 10 раз больше, чем в сыворотке. Поэтому при определении активности аминотрансфераз в сыворотке последняя не должна иметь даже следов гемолиза.
Аланинаминотрансфераза (АЛАТ) [КФ 2.6.1.2.]. N 0,1-0,68 ммоль/(час*л) Основные источники: печень, поджелудочная железа, сердце, скелетная мускулатура, почки. Изоферменты: митохондриальная АЛАТ (м-АлАТ) и цитозольна АЛАТ (ц-АлАТ). В печени активность АЛАТ в несколько тысяч раз выше, чем в сыворотке крови
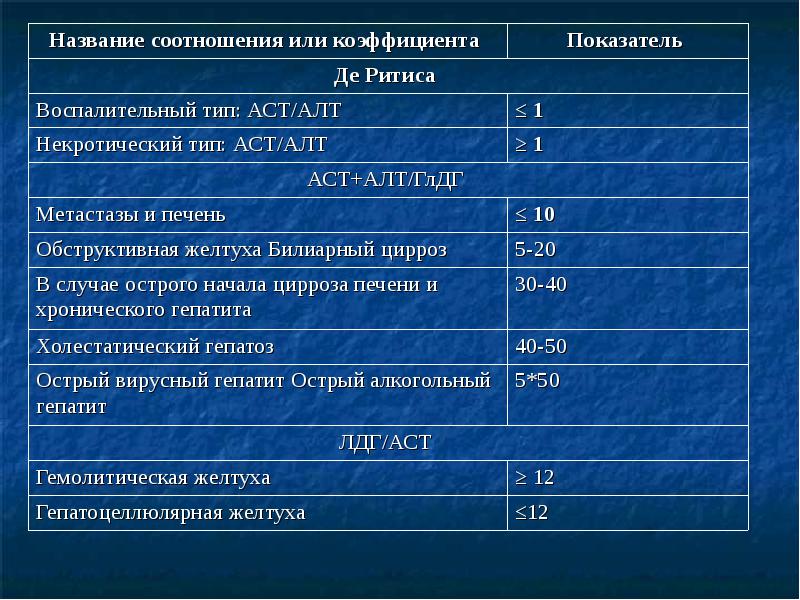
1. При остром ИМ активность АСАТ более высока, чем АЛАТ (коэффициент де-Ритиса больше 1,3). 1. При остром ИМ активность АСАТ более высока, чем АЛАТ (коэффициент де-Ритиса больше 1,3). 2. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛАТ более высока, чем АСАТ (коэффициент де-Ритиса менее 1,0). Тяжелое поражение печенки может изменить это соотношение. 3. При алкогольном гепатите нередко активность АСАТ оказывается выше чем АЛАТ (коэффициент де-Ритиса больше 1,3).
Фосфатазы - ферменты, которые катализируют отщепление фосфорной кислоты от органических соединений. Фосфатазы разделяют на фосфодиэстеразы I (щелочная фосфатаза (ЩФ), оптимум рН = 8,6-10,1) и фосфомоноэстеразы II (кислая фосфатаза (КФ), оптимум рН = 4,6-6,2).
Щелочная фосфатаза (ЩФ) [КФ 3.1.3.1.] N 0,5-1,3 ммоль/(час* л). Действие: фермент, который гидролизует эфиры ортофосфорной кислоты в щелочной среде. Щелочная фосфатаза содержится практически во всех органах, но максимальная ее активность оказывается в печени, костной тканини кишечнике и плаценте. Изоферменты ЩФ, которые отличаются по своим физико-химическими свойствами и относительной органоспецифичности: печеночный желчный, костный, кишечный, плацентный изоферменты.
Y-Глутамилтранспептидаза (ГГТП) КФ [2.3.2.2] N мужчины: 250-1767 нмоль/(с*л) или 15-106 МО, женщины: 167-1100 нмоль/(с*л) или 10-66 МО Основные источники: печень Значительное повышение активности наблюдается при: 1. обтурации внутрипеченочных и внепеченочных желчных путей (особенно значительное повышение ГГТП, которое идет параллельно с увеличением активности щелочной фосфатазы); 2. заболеваниях печени (гепатитах, циррозе печени, опухолях и метастазах в печень), которые протекают при явлениях холестаза; 3. панкреатите и опухолях поджелудочной железы; 4. интоксикациях этанолом (даже при умеренном употреблении алкоголя), наркотиками и седативнимы средствами (врачебная интоксикация).
Креатинкиназа (КК) КФ [2.7.3.2] N 0,152-0,305 ммоль/(час*л) Основные источники: миокард, скелетные мышцы, язык, селезенка, диафрагма, почки, легкие, печень. Изоферменти: мозговой тип (КК-ВВ) - I тип. сердечный тип (КК-МВ) - ІІ тип, мускульный тип (КК-ММ) - ІІІ тип.
Клиническое значение определения КК Физиологическое повышение активности креатинкиназы (КК) обнаружено в сыворотке крови: у новорожденных (небольшое), у родильниц в первые дни после родов, при физической нагрузке. Значительное повышение - при инфаркте миокарда, дистрофии мышц, травматических повреждениях мышц (раздроблениях), шоке и недостаточности кровообращения. Умеренное повышение - при инфаркте миокарда (мелкоочаговый), ограниченном повреждении скелетных мышц, судорогах, гипотиреозе, алкоголизме, расстройстве мозгового кровообращения, травмах мозга, остром психическом состоянии.
Энзимотерапия Как элемент комплексной терапии - применение ферментов в сочетании с другой терапией. В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов. Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы. Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани)
Применение ферментов в качестве специфических реактивов специфические эндонуклеазы, катализирующие разрывы межнуклеотидных связей ДНК, для диагностики фенилкетонурии, α- и β-талассемии и других наследственных болезней) глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например пируват, лактат, этиловый спирт и др.
Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток, поэтому их традиционно широко применяют в практике. Биологические катализаторы нетоксичны, работают в мягких условиях, используют доступное сырье (в том числе и отходы), в связи с чем их применение в промышленности выгодно с экономической и экологической точек зрения.
По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из более чем 2000 известных в настоящее время ферментов в промышленности используется около 30. Основная часть ферментов, поступающих на мировой рынок, приходится на долю гидролаз, из которых 60 % составляют пептидогидролазы (в основном щелочные и нейтральные протеазы), использующиеся в качестве детергентов в производстве синтетических моющих средств, а 30 % — гликозидазы, применяющиеся в производстве кондитерских изделий, фруктовых и овощных соков. Ферменты находят применение в текстильной, кожевенной, целлюлозо-бумажной, медицинской, химической промышленности (табл. 4.1).
По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают глюкоизомераза и глюкоами- лаза, применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50 % рынка пищевых энзиматических препаратов.
Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих коферменты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление а-кетокислот в а-гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфатазу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу. Применение сопряженных ферментативных реакций с участием алкогольоксидазы и катал азы дрожжей Hansenulla polimorpha и формальдегиддисмутазы бактерии Pseudomonas putidaпозволило осуществить окисление метанола в муравьиную кислоту с выходом 88 — 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе, в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре 100 “С. Препараты липазы используют для синтеза оптически чистых сложных эфиров и феромонов, применяющихся в парфюмерии и медицине.
Применение ферментов

Для деградации и модификации антропогенных органических соединений, поступающих в окружающую среду, используют ферменты разных классов и в том числе лакказу, лигниназу, тирозиназу, монооксигеназу, диоксигеназу и др. Перспективна для очистки сточных вод новая технология, основанная на использовании реакции пластеинообразования, открытой А.Я. Данилевским в 1886 г. Сущность работ Данилевского состоит в экспериментальном доказательстве обращения протеолиза и возможности синтеза белковоподобных веществ (пластеинов) под действием ряда протеолитических ферментов. Сточные воды содержат аминокислоты и пептиды, концентрация которых возрастает в результате гидролиза белковых компонентов отходов под воздействием пептидогидролаз микроорганизмов. Данная технология, активно внедряющаяся во
Франции, нацелена на производство в промышленных масштабах кормовых белков из аминокислот и пептидов сточных вод.
Важнейшую область применения ферментов в медицине составляет энзимодиагностика — тестирование патологии того или иного органа человека по уровню активности фермента или соотношению его множественных форм и изоферментов. Так, аспартатаминотрансфераза, изоцитратдегидрогеназа, лактатдегидрогеназа и альдолаза служат для выявления инфаркта миокарда; аланина- минотрансфераза, аспартатаминотрансфераза и лактатдегидрогеназа — для диагностики заболеваний печени; глутамилтрансфераза — для блокировки отторжения органов при их пересадке и т.д.
Таким образом, производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к тем ее отраслям, объем продукции которых постоянно растет, а сфера применения неуклонно расширяется. По объему производства ферментов доминируют страны Западной Европы. Резкий рост этой индустрии наблюдается в США и Японии.
4.2. ИСТОЧНИКИ ФЕРМЕНТОВ
Ферменты присущи всем живым существам, однако для их выделения используют те природные объекты, в которых содержание искомого энзима составляет не менее 1 %. Для крупномасштабного получения ферментов пригодны только некоторые растительные организмы на определенной фазе их развития (проросшее зерно различных злаков и бобовых, латекс и сок зеленой массы ряда растений), а также отдельные ткани и органы животных (поджелудочная железа, слизистая оболочка желудочно-ки- шечното тракта, сычуг крупного рогатого скота, семенники половозрелых животных). Практически неограниченный источник ферментов — микроорганизмы (бактерии, грибы, дрожжи), содержащие набор большинства известных в настоящее время энзимов, количество которых можно повысить в десятки и сотни раз методами мутагенеза, селекции и индукции биосинтеза.
4.3. ТЕХНОЛОГИЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ – ПРОДУЦЕНТОВ ФЕРМЕНТОВ
В зависимости от источника технология получения ферментных препаратов имеет свои особенности. При извлечении ферментов из растительного сырья и животных тканей технология сводится к экстракции энзимов и очистке их от сопутствующих балластных веществ. Технология ферментных препаратов микробного происхождения более сложная, так как дополнительно включает этапы культивирования микроорганизмов — продуцентов ферментов, в том числе этапы получения посевного материала и производственной культуры соответствующего микроорганизма.
Для производства посевного материала используют исходный штамм продуцентов, получаемый из лабораторных чистых культур, который выращивают разными способами на предварительно стерилизованной твердой или жидкой питательной среде до определенного возраста. Посевной материал консервируют (высушиванием или хранением при низких температурах) вплоть до дальнейшего использования. Производственные культуры продуцента получают, выращивая посевной материал микроорганизмов как на поверхности твердых или жидких сред, так и в глубине жидких питательных сред.,
Поверхностный метод выращивания продуцентов, предложенный И.Такамине еще в 1894 г., состоит в культивировании микроорганизмов на поверхности увлажненных стерилизованных отрубей, размещенных в кюветах, к которым иногда добавляют солодовые ростки, древесные опилки, свекловичный жом. Инкубацию микроорганизмов ведут в специальном термостатируемом цехе при постепенном контроле в нем температуры, влажности и подачи воздуха.
В последние 15 лет для выращивания продуцентов ферментов; чаще используют более экономный — глубинный метод культивирования (рис. 4.1). В промышленных условиях для этих целей применяют ферментеры из нержавеющей стали, снабженные приспособлениями для перемешивания и подачи в жидкую питательную среду стерильного воздуха. Сначала ферментер заполняют питательной средой, автоклавируют, а затем засевают чистой культурой, подаваемой из специального генератора. Для предотвращения инфекции в ферментере поддерживают повышенное давление наряду с оптимальными значениями рН, температуры, редокс-потенциала и другими условиями культивирования.

В настоящее время наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала. Размножение микроорганизмов и биосинтез фермента регулируют при использовании этого метода по мере поступления питательной смеси в ферментер. Такой ферментер представляет собой вращающийся трубкообразный реактор, через один конец которого в него поступает питательная среда и культура микроорганизмов, а из другого — выводятся ферменты, продукты жизнедеятельности и бактериальная масса. Основное достоинство метода — возможность длительное время поддерживать в автоматическом режиме рост культуры микроорганизма. Например, культура ацетонобутиловых бактерий находилась в таком реакторе в состоянии непрерывного размножения в течение 200 суток (И.Д.Иерусалимский с сотр., 1986).
Важнейшим фактором эффективности технологии ферментных препаратов является качество питательной среды. Основное требование к качеству питательной среды состоит в полноценности ее состава, обеспечивающей рост продуцента и биосинтез целевого фермента. Микроорганизмы нуждаются прежде всего в соединениях, содержащих углерод, азот, водород и кислород. К ним относятся органические вещества, соли аммония и вода. Кроме того, в состав питательной среды должны быть включены минеральные соединения, содержащие Mg, Са, Р, S, Fe, К и другие макро- и микроэлементы, витамины, ростовые вещества (биотин, инозит) и пр. Питательные среды в зависимости от состава делятся на синтетические и комплексные. Синтетическими считают те среды, которые состоят из определенного по качественному и количественному составу набора индивидуальных веществ. В комплексные среды входят различные природные продукты, часто отходы пищевых производств. К их числу относятся различные жмыхи, барда спиртовых заводов, картофельная мезга, кукурузный экстракт, меласса, отруби и прочие продукты. Благодаря использованию отходов комплексные питательные среды доступны, дешевы и обеспечивают безотходность биотехнологических производств.
4.4. ТЕХНОЛОГИЯ ВЫДЕЛЕНИЯ И ОЧИСТКИ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Выделение и очистка фермента как из культуры микроорганизма (выращенного любым способом), так и из других природных источников весьма трудоемкая и дорогостоящая процедура, поэтому, если фермент можно использовать в виде неочищенного препарата, его не очищают. В промышленности широко применяют коммерческие препараты ферментов, чистота которых составляет всего 0,1 % (т.е. 99,9 % составляют примеси). К таким отраслям относятся спиртовая, кожевенная, текстильная промышленность, а также сельское хозяйство, производство бытовой химии. Например, ферментный препарат, употребляемый в пивоварении, представляет собой высушенную биомассу плесневых грибов. В большинстве отраслей пищевой промышленности, практике научных исследований и особенно в медицине используют только очищенные препараты ферментов, частично или полностью освобожденные от балластных веществ и полностью охарактеризованные в отношении их специфичности и физико-химических свойств. Исходным материалом для получения препаратов ферментов служат: биомасса продуцента, фильтрат культуральной жидкости, экстракт из культуры микроорганизма или из тканей и органов растений и животных, из которых готовят препараты различной степени очистки.
Неочищенные ферментные препараты получают путем высушивания в мягком режиме культуры микроорганизмов вместе с остатками питательной среды. Такие препараты получают и путем упаривания экстракта из культуры продуцента, выращенного поверхностным способом, или из фильтрата культуральной жидкости (в случае глубинного выращивания микроорганизмов). Распространен также метод ацетоновых порошков, состоящий в осаждении и быстром обезвоживании при температуре не выше -10 °С тканей или вытяжек из них, содержащих ферменты. Технические препараты ферментов представляют собой либо высушенные до порошкообразного состояния продукты, либо жидкие концентраты, обычно характеризующиеся 50 %-м содержанием сухой массы веществ.
Для успешного выделения ферментов из клеточного содержимого необходимо очень тонкое измельчение исходного материала вплоть до разрушения субклеточных структур: лизосом, митохондрий, ядер и др., которые имеют в своем составе многие индивидуальные ферменты. Для этого используют специальные мельницы и гомогенизаторы, а также ультразвук, метод попеременного замораживания и оттаивания ткани. Для высвобождения ферментов из мембранных структур клетки к гомогенатам добавляют небольшие количества детергентов (твин, тритон Х-100) или обрабатывают их энзимами — лизоцимом, целлюлазой, лецитиназой С. Особое внимание при выделении ферментов уделяют проведению всех операций в условиях, исключающих денатурацию белка (нейтральные значения рН, стабилизирующие добавки в виде белков, солей и специальных соединений).
Пример, иллюстрирующий получение частично очищенного препарата (3-галактозидазы из мутанта Е. coli, представлен на рис. 4.2.

Схема очистки включает отделение клеток микроорганизма по выходе их из ферментера от культуральной жидкости посредством центрифугирования и последующее разрушение клеток в гомогенизаторе высокого давления. Для освобождения белков от нуклеиновых кислот полученный гомогенат обрабатывают сульфатом марганца до конечной концентрации этой соли в смеси, равной 0,05 М. Осадок нуклеиновых кислот отделяется с помощью ротационной вакуум-фильтрации, а в образовавшийся фильтрат добавляют сульфат аммония до 45 % от его насыщения. Возникший осадок белков, содержащий бетта-галактозидазу, собирают с помощью центрифугирования или вакуум-фильтрации. Вся процедура очистки энзима от момента подачи бактерий в систему до момента получения осадка (3-галактозидазы занимает всего 1 ч.
В зависимости от свойств выделяемого фермента и сопутствующих ему балластных веществ при получении очищенных препаратов ферментов комбинируют различные приемы и методы (рис. 4.3), такие, как термическое фракционирование, осаждение органическими растворителями, солями и тяжелыми металлами, фильтрация на молекулярных ситах, ионообменная хроматография, электрофорез, изоэлектрофокусирование.
На заключительных этапах очистки часто используют аффинную хроматографию (биоспецифическая хроматография, хроматография по сродству), которая основана на способности ферментов избирательно связывать те или иные лиганды — субстраты, коферменты, конкурентные ингибиторы, аллостерические эффекторы и т.п. Такое связывание весьма специфично (Кs -4 М), что позволяет выделить тот или иной энзим из множества других белков. Например, из желудочного сока человека методом одноэтапной аффинной хроматографии выделена кислая липаза, использующаяся в заместительной терапии при заболеваниях печени.
Для синтеза аффинного сорбента, соответствующего специфичности данного фермента, лиганд (субстрат или его аналог) присоединяют к инертной матрице (макропористые гидрофильные гели, синтетические полимеры, неорганические носители). Для уменьшения пространственных трудностей при взаимодействии фермента с матрицей лиганд присоединяют к носителю через промежуточное звено (вставку, ножку, спейсер). Присоединение лигандов к поперечносшитой агарозе — сефарозе обычно проводят, активируя ее бромцианом (см. с. 91). Связывание с сефарозой, активированной бромцианом, л-амино-бензилянтарной кислотой, используемой в качестве лиганда, обеспечивает взаимодействие сорбента с каталитическим центром только карбоксипептидаз благодаря сходству лиганда с субстратами карбоксипептидазы:


Сорбенты, содержащие цибакрон голубой и некоторые другие красители антрахинонового ряда, используют для аффинной хроматографии НАД-зависимых дегидрогеназ, а носители, имеющие цикло- пептидный антибиотик грамицидин, — для протеолитических ферментов:

Таблица 4.2 Схема очистки глюкоамилазы из культуры Endomycopsisssp. 20-9 (по И.М.Грачевой, 1987)

В процессе выделения повышается доля фермента в массе тотальных белков, т.е. увеличивается его удельная активность. В табл. 4.2 представлены данные, характеризующие процедуру очистки от сопутствующих ферментов и балластных белков глюкоамилазы из культуры Endomycopsis ssp. 20-9. Анализ таблицы показывает, что чистота глюкоамилазы в препарате возросла в 37 раз и в полученном препарате отсутствует активность двух ферментов углеводного обмена — гликозилтрансферазы и а-амилазы.
В производственных условиях активность получаемого ферментного препарата оценивается количеством субстрата, преобразованного 1 мг (1кг) препарата при оптимальных условиях за 1 мин, и измеряется в Е/мг, моль/мг или каталах/кг белка.
Очищенные ферментные препараты хранят при низкой температуре (до -80 °С). Для стабилизации ферментов в их препараты добавляют коферменты и субстраты. Ферментные препараты для промышленного применения стабилизируют, добавляя глицерин, моносахариды, дисахариды (глюкоза, сахароза, лактоза), HS-co- единения (цистеин, глутатион, меркаптоэтанол, дитиотреитол и др.), отдельные аминокислоты, желатину и другие белки-наполнители.
Существенно, что из 2003 включенных в список известных в настоящее время ферментов более 1500 выделено и в той или иной степени очищено; это служит не только базой для изучения физико-химических основ ферментативного катализа, но и фундаментом для совершенствования химического производства и промышленности.
4.5. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ, ЕЕ ЗАДАЧИ
Развитие прикладной энзимологии долгое время сдерживалось дороговизной чистых ферментных препаратов, неустойчивостью их при хранении и невозможностью многократного использования. Принципиально новые перспективы открылись перед прикладной энзимологией в 60-е годы XX в. в результате появления на стыке химии и биологии новой отрасли — инженерной энзимологии. Ее задачи заключаются в развитии прогрессивных методов выделения ферментов, их стабилизации и иммобилизации; конструировании катализаторов с нужными свойствами и разработке научных основ их применения.
В частности, методами белковой инженерии, сущность которых состоит в изменении первичной структуры природной молекулы фермента посредством химической модификации самого; энзима или его гена, удается принципиально трансформировать структуру активного центра и его функцию, модулировать субстратную специфичность и физико-химические свойства фермента. Так, замена остатка глутамина-102 в молекуле лактатдегидрогеназы на аргинин превратила фермент в высокоактивную малатдегидрогеназу. Описанным способом получены термостабильные формы лизоцима Т-4 и субтилизина (каталитическая константа субтилизина изменена в 100 раз), созданы гибридные формы ферментной системы, ценной в иммуноферментном анализе, сочетающие в себе свойства бета-галактозидазы и бета-галактокиназы.
Многие проблемы технологии синтеза органических соединений, пищевой и медицинской промышленности, мониторинга человека и окружающей среды, защиты окружающей среды, энергетики не могут быть решены без использования методов современной инженерной энзимологии.
Важным этапом развития инженерной энзимологии стала разработка способов получения и использования иммобилизованных ферментов.
Читайте также:

