Нитрон доклад по химии
Обновлено: 08.07.2024
Нитроны (азометиноксиды) - N-оксиды иминов общей формулы R 1 R 2 C=N + (O − )R 3 (R 3 ≠ H) [1] . В зависимости от степени замещения при атоме углерода различают альдонитроны (R 1 = Н, R 2 - органический радикал) и кетонитроны (R 1 , R 2 ≠ H). Изомерны с изонитронами (оксазиридинами).
Содержание
Свойства
Нитроны - кристаллические вещества, в ИК-спектрах присутствует характеристическая полоса связи C=N при 1550-1620 см -1 , в УФ-спектрах несопряженные нитроны поглощают в области λmax 240 нм. Слабые основания. Для нитронов, как и для оксимов, характерна цис — транс изомерия по связи C=N.
Реакционная способность
Строение нитронов может быть представлено как гибрид резонансных структур, основной вклад вносят 1,2-диполярная структура 1 и 1,3-диполярная структура 2:
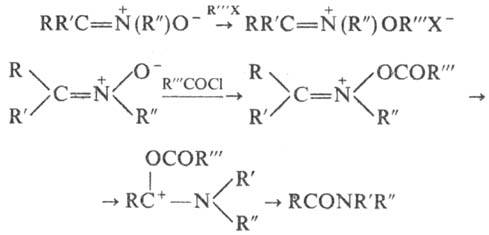
Кислородный атом нитронов является нуклеофильным центром, они протонируются по атому кислорода и образуют непрочные соли, алкилирование и ацилирование, продукты ацилирования обычно претерпевают перегруппировку в амиды:
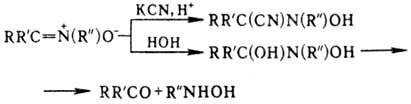
Атом углерода нитронов электрофилен, они реагируют с нуклеофилами, образуя продукты 1,3-присоединения - N,N'-замещенные гидроксиламины:

R 1 R 2 C=N + (O − )R 3 + HX R 1 R 2 C(X)-N(OH)R 3 X = CN, OH
Такое нуклеофильное присоединение воды к нитронам является первой стадией их гидролиза, ведущего к кетонам и замещенным гидроксиламинам.
Синтез
Классическими методами синтеза нитронов являются конденсация карбонильных соединений с N-замещенными оксимами и N-алкилирование оксимов, нитроны также могут быть синтезированы окислением вторичных аминов и дегидрированием N-замещенных гидроксиламинов соответствующих структур:
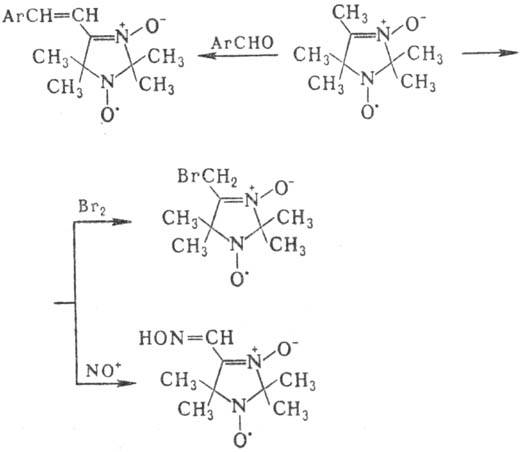
Специфическим методом синтеза N-арилзамещенных нитронов является конденсация ароматических нитрозосоединений с бензилгалогенидами или N-метиленпиридиниевыми солями:

RCH2X + O=N-Ar RCH=N + (O - )Ar + HX ,
образование нитронов конденсацией 4-нитрозо-N,N-диметиланилина с метиленпиридиниевыми солями с последующим гидролизом является препаративным методом синтеза альдегидов (реакция Крёнке).
Примечания
- Азотсодержащие органические соединения
- Терминология IUPAC
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Нитроны" в других словарях:
НИТРОНЫ — N оксиды азометинов, соед. общей ф лы . Различают альдонитроны (R H, R и R: орг. радикалы) и кетонитроны (R, R , R: орг. радикалы). По номенклатуре ИЮПАК Н. называют, добавляя слово оксид к назв. алкилиденамина, напр. N бензилиденметиламин N… … Химическая энциклопедия
НИТРОЗОСОЕДИНEНИЯ — (С нитрозосоединения), содержат в молекуле одну или неск. нитрозогрупп ЧN=O, связанных с атомами углерода. Известны также N и О нитрозосоединения (см. Нитрозамины и Нитриты органические). Обычно Н. существуют в виде равновесной смеси мономера и… … Химическая энциклопедия
Спиновая ловушка — 5,5 Диметилпирролин N оксид (DMPO) … Википедия
ГЕН — (от греч. genos род, происхождение), наследственный фа ктор, функционально неделимая единица генетич. материала; участок молекулы ДНК (у нек рых вирусов РНК), кодирующий первичную структуру полипептида, молекулы транспортной или ри босомальной… … Биологический энциклопедический словарь
РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ — РНК, нуклеиновые к ты, содержащие в качестве углеводного компонента рибозу, а в качестве азотистых оснований аденин, гуанин, урацил, цитозин, а также их модифицированные производные (напр., метилированные). Обязательные компоненты всех живых… … Биологический энциклопедический словарь
ГИДРОКСИЛАМИНА ПРОИЗВОДНЫЕ ОРГАНИЧЕСКИЕ — Среди производных ациклич. ряда (физ. св ва см. в табл.) различают N производные (общие ф лы RNHOH и RR NOH), О производные (NH2OR) и N,О производные (RNHOR и RR NOR ) гидроксиламина. Существуют также циклич. Г. п. о. (ф лы I и II, R H, орг.… … Химическая энциклопедия
МАЙЗЕНХАЙМЕРА ПЕРЕГРУППИРОВКА — изомеризация N оксидов третичных аминов в О замещенные гидроксиламины при нагр. в р ре щелочи или при фотолизе: обычно R CH2Ar, СНАr2, САr3, аллил, замещенный аллил, циклоалкенил, R и R: Alk, Аr. Выходы продуктов 40 80%. Механизм р ции зависит от … Химическая энциклопедия
ОКСАЗИРИДИН — мол. м. 45,04. Незамещенный О. не выделен. Св ва и стабильность замещенных О. зависят от природы заместителей при атоме N. О., незамещенные по атому N (изоксимы), а также 2 арилзамещенные разлагаются при комнатной т ре. 2 Алкилзамещенные… … Химическая энциклопедия
ОКСИМЫ — производные альдегидов или кетонов (соотв. альдоксимы RCH=NOH или кетоксимы RR C=NOH, где R, R opr. радикалы). О. жидкости или низкоплавкие твердые в ва (см. табл.), хорошо раств. во многих орг. р рителях, плохо в холодной воде. О. альдегидов и… … Химическая энциклопедия
СПИНОВЫХ ЛОВУШЕК МЕТОД — метод определения по спектрам электронного парамагнитного резонанса (ЭПР) короткоживущих радикалов после их присоединения к подходящим акцепторам спиновым ловушкам. Последние специально добавляют в реакц. смесь, где они реагируют с радикалами R Х … Химическая энциклопедия
НИТРОНЫ, N-оксиды азометинов, соед. общей ф-лы . Различают альдонитроны (R-H, R' и R : -орг. радикалы) и кетонитроны (R, R', R : - орг. радикалы). По номенклатуре ИЮПАК нитроны называют, добавляя слово "оксид" к назв. алкилиденамина, напр. N-бензилиденметиламин-N-оксид. Нитроны изомерны сазиридинам (изонитронам).
Н итроны, как правило, кристаллич. в-ва. ИК спектр имеет характеристич. полосу при 1550-1620 см -1 (C=N), в УФ спектрах несопряженных нитронов l макс 240 нм (lge ~ 4), в спектре ПМР альдонитронов хим. сдвиг (d) ~ 7 м.д. (a-Н), в спектре ЯМР 13 С хим. сдвиг a-С-атома ~ 142 м.д.
Электронное строение нитронов может быть представлено резонансными структурами:
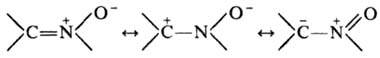
Н итроны-слабые основания, при действии к-т протонируются по атому О с образованием непрочных солей. Алкилирова-ние и ацилирование также происходят по атому О; ацили-рование обычно сопровождается перегруппировкой, приводящей к амидам:
Н итроны вступают в р-ции 1,3-присоединения с нуклеофилами, образуя производные М,М-дизамещенных гидроксиламина; при гидролизе образуются карбонильные соед. и гидро-ксиламины:
Атомы водорода С-алкильных групп обладают кислыми св-вами: легко обмениваются на дейтерий, галоген, нитро-зогруппу, вступают в конденсацию типа альдольной, напр.:
Н итроны легко вступают в р-ции диполярного [3 + 2]-цикло-присоединения с алкенами, диенами и др. Альдонитроны, особенно в случае цис-расположения атомов Н и О, более реакционноспособны, чем кетонитроны. Р-ции позволяют получать с высокими выходами разл. гетероциклич. соед., напр.:
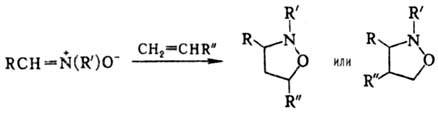
Под действием сильных оснований нитроны претерпевают 1,3-прототропный сдвиг:
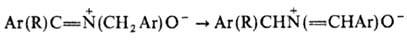
Нек-рые нитроны легко дают циклич. димеры; при УФ облучении изомеризуются в оксазиридины, при нагр. происходит обратная р-ция:
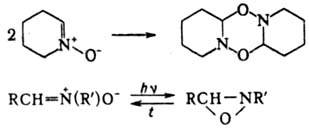
Н итроны устойчивы к действию большинства окислителей. Водный р-р периодата окисляет альдонитроны до N-гидрокси-амидов. Восстановление нитронов комплексными гидридами металлов приводит к N,N-дизамещенным гидроксиламина, а при каталитич. восстановлении образуются азометины и вторичные амины:
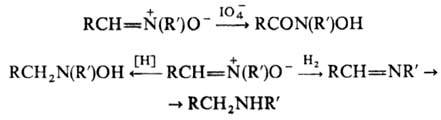
Н итроны реагируют со своб. радикалами с образованием нитро-ксильных радикалов, что используют в методе спиновых ловушек:
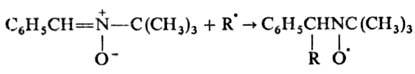
Осн. методы синтеза нитронов: 1) конденсация карбонильных соед. с N-замещенными гидроксиламина:
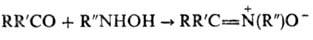
2) алкилирование оксимов алкилгалогенидами или непредельными карбонильными соед., напр.:
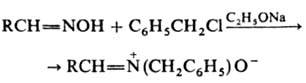
3) конденсация нитрозоароматич. соед. с бензилгалогени-дами или N-метиленпиридиниевыми солями:
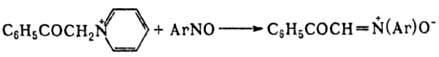
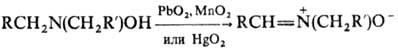
Благодаря доступности и многообразию превращений нитроны широко применяются для синтеза сложных прир. в-в, стабильных нитроксильных радикалов и в изучении механизмов р-ций.
Лит.: Общая органическая химия, пер. с англ., т. 3, М,, 1982, с. 613-18; Имидазолиновые нитроксильные радикалы, Новосиб., 1988; Breuer Eli, The chemistry of functional groups, ed. by S. Patai, pt 1, 1982. Л.Б. Володарский.
Нитрон – волокно нового поколения. Несмотря на то, что его получают химическим путем, нить обладает множеством положительных характеристик и по ряду параметров превосходит натуральные компоненты.

Содержание
История появления нитрона
Волокно нитрон известно на территории Российской Федерации. Впрочем, в других странах этот компонент называется по-другому. В Японии это кашмилон, в Великобритании – куртель, а в Германии вольпрюла. Считается, что базовое сырье изобрели в США. Первые опыты начались в 40-х годах прошлого века. Однако массово выпускать волокна стали лишь десять лет спустя. Кстати, в Штатах нитрон именуется акриловым волокном.
Производство нитрона
Наиболее крупные заводы, где выпускается нитрон, находятся в Узбекистане, России, Турции, Индии, Мексике и Китайской Народной Республике.
Технология изготовления нитрона
Данное волокно является синтетическим. Его получают из полимера полиакрилонитрила. Исходное сырье помещают в раствор натрия. Затем вещество пропускают через фильеры, вытягивают и помещают в водный раствор. Волокна выходят почти прозрачными и достаточно хрупкими. Такой способ прядения называется мокрым. Есть и другой - сухой метод. Сразу после прохождения фильер полуготовые нити высушивают в потоке разогретого инертного газа. Волокна затвердевают и становятся похожими на шелк.
Когда нити сформированы, их промывают, чтобы избавиться от растворителя и специально обрабатывают, да бы впоследствии волокна не электризовались.
Описание нитрона
Внешний вид нитрона напрямую зависит от структуры нити. Материал может быть похож на шерсть или быть шелковистым и гладким.
Состав нитрона
Ткани из чистого волокна нитрона встречаются достаточно редко. Как правило, к этим синтетическим нитям примешивают шерсть, хлопок, вискозу. Купить дополнительную пряжу возможно в России, Египте, Пакистане, Греции, Индии, Австралии.
Химические свойства нитрона
плохо поддается окрашиванию;
обладает низким процентом усадки во время стирки;
устойчив к органическим растворителям, неконцентрированным щелочам и кислотам. Однако, при воздействии сильного раствора щелочи материал начинает разлагаться;
не выгорает при длительном прибывании на солнце.
Физические свойства нитрона
обладает высокой прочностью;
практически не сминается;
в незначительной степени подвержен истиранию.
Характеристики нитрона
привлекательный внешний вид;
устойчивость к гниению, появлению плесени, поеданию молью;
высокий процент упругости;
комфорт при носке;


Виды нитрона
Характеристика волокна не позволяет нитрону иметь обширную классификацию. Тем не менее нитрон нередко разделяют в зависимости от структуры волокна. Он бывает:
- на основе штапеля. Такая ткань по своему внешнему виду очень напоминает шерстяной трикотаж;
- на основе филаментных нитей. Данный нитрон похож на шелк.
Отдельно выделяют модакрил. Это модифицированный вариант нитрона, где содержание акриловых волокон составляет 35%, а остальные 65% приходятся на акрилонитрильный мономер.
Печать на ткани
Для нитрона в большинстве случаев задействуют сублимационный метод печати.
Сочетаемость нитрона с другими тканями
Материал, созданный на основе волокон нитрона, подойдет к дениму, льну, коже или замше.
Область применения нитрона
Что это за волокно – нитрон – хорошо осведомлены почти во всех сферах легкой промышленности. Прежде всего из него изготавливают одежду. Это пальто, чулочно-носочные изделия, свитера. К тому же из чистого нитрона, без всяких примесей выпускают отличную по качеству пряжу. Из нее выходят великолепные теплые пуловеры. Незаменим нитрон в изготовлении теплозащитных тканей, которая затем идет на пошив униформы, экипировки спецодежды. Нередко из нитрона получают искусственный мех и даже делают парики. Еще волокно задействуют при производстве обивки для мебели, детских игрушек, обуви. Нередко из материалов, в состав которых входит нитрон, кроят постельное белье, покрывала, одеяла. А также делают шторы, гардины, ковры. За хорошие технические данные волокно используют при изготовлении чехлов, навесов, тентов, баннеров, рекламных растяжек.



Преимущества нитрона
Разработчики, создавая нитрон, позаботились, чтобы содержание полезных характеристик в волокне было максимальным.
Недостатки нитрона
Волокно, к сожалению, наделено и минусами.
- нитрон склонен образовывать катышки;
- жировые пятна глубоко проникают в структуру ткани и затем их достаточно сложно вывести
Рекомендации по уходу изделий из нитрона
Как ухаживать за тканями из нитрона, подробно описано в инструкции, которая прилагается к каждому изделию. Материал не требует особых хлопот и является легким в использовании.
Как стирать
Стирать ткани из нитрона рекомендуют в прохладной воде. Стирать можно как в машинке, так и ручным способом. При этом моющие средства можно применять любые.
Как отжимать
Изделия с содержанием нитрона можно отжимать в центрифуге при небольшом количестве оборотов.
Как сушить
Сушат материи из нитрона, разложив их на горизонтальной поверхности в дали от включенных обогревательных приборов.
Можно ли гладить
Изделия на основе нитрона практически не мнутся. Поэтому гладить их необязательно.
Отзывы о нитроне
Нитрон в основном имеет положительные комментарии пользователей. Их привлекает тот факт, что не нужно больших хлопот, как правильно ухаживать за тканями. К тому же они неплохо дышат, теплые и прочные.

А нитрон это функциональная группа в органическая химия состоящий из N-окись из я добываю. Общая структура R1р2C = NR3 + О − где R3 не является H. Нитрон - это 1,3-диполь, и используется в 1,3-диполярные циклоприсоединения. Известны и другие реакции нитронов, [1] в том числе формальный [3 + 3] циклоприсоединения с образованием 6-членных колец, а также формальных [5 + 2] циклоприсоединений с образованием 7-членных колец. [2] Нитроны не следует путать с нитрены.
Содержание
Генерация нитронов
Нитроны чаще всего образуются при окислении гидроксиламинов или конденсации монозамещенных гидроксиламинов с карбонильными соединениями (кетонами или альдегидами). Наиболее распространенным реагентом, используемым для окисления гидроксиламинов, является оксид ртути (II). [3]

Методы карбонильной конденсации позволяют избежать проблем селективности по центру, связанных с окислением гидроксиламинов двумя наборами (альфа) атомов водорода. [4]

Существенной проблемой, связанной со многими реактивными нитронами, является димеризация. [5] Эта проблема решается экспериментально за счет использования избытка нитрона или увеличения температуры реакции для преувеличения энтропийных факторов.

Реакции
1,3-диполярные циклоприсоединения
В качестве 1,3-диполей нитроны используются в 1,3-диполярные циклоприсоединения. [2] При реакции нитрона с алкен диполярофил, изоксазолидин сформирован:
Читайте также:

