Многоликий углерод доклад химия 9 класс
Обновлено: 02.07.2024
Образовательные – обобщить и систематизировать знания о характерных особенностях углерода и его соединений; значении этих соединений в природе и жизни человека.
Развивающие – развивать самостоятельность в работе с учебником, материалами периодической печати, с научно-популярной литературой.
Воспитательные – воспитывать умение работать в атмосфере поиска, творчеств успеха. Способствовать воспитанию личности с высоким уровнем экологической культуры.
Иллюстративный материал.
Оборудование и реактивы.
Химические стаканы, колбы, лабораторный штатив, прибор для получения газов.
Соляная кислота, активированный уголь, раствор йода, раствор перманганата калия или чернил, раствор гидроксида кальция, мрамор, минеральная вода.
План урока:
- Вступительное слово учителя.
- Представление журналистов.
- Работа исследовательских групп.
- Подведение итогов урока.
Подготовка к уроку:
Эпиграф к уроку:
Ход урока
Учитель:
Трудно найти химический элемент, который в виде простого вещества был бы столь же многолик, как углерод. Алмаз, графит, сажа, кокс и активированный уголь – все эти совершенно непохожие друг на друга вещества состоят из одних и тех же атомов углерода, по-разному соединённых друг с другом.
Углерод способен образовывать миллионы органических соединений. Его называют царём живой природы, на его основе построена жизнь.
Почему же углерод является жизненно важным для нас?
В чём уникальность этого элемента по сравнению с другими?
Мы с вами попытаемся разобраться в этом вопросе и помочь нашим гостям – журналистам. Основательный ответ на этот вопрос вы сможете дать, если будете внимательны, сосредоточены и активны во время нашей работы.
Екатерина:
Итак, основной вопрос – это:
Почему же именно углерод взял на себя труднейшую задачу быть основой всего живого на Земле?
Владимир:
Катя, но чтобы ответить на такой вроде бы простой вопрос, необходимо рассмотреть его со всех сторон, так как он является глобальным.
Екатерина:
Согласна. Так с чего начнём наше интервью?
Владимир:
Думаю, у нас нет исторической информации. Когда и кем был открыт углерод на Земле?
Екатерина:
Группа историков.
Ещё несколько десятилетий назад уголь считали третьей, аморфной формой углерода. Лишь во второй четверти XX века структурный анализ показал, что аморфный углерод – это по существу тот же графит.
В наши дни не только не утрачено веками сложившееся значение алмаза, но и наметились новые пути его использования.
Екатерина:
Спасибо. Теперь нам необходимо найти причины уникальности свойств алмаза и посмотреть на углерод глазами кристаллохимика.
Группа кристаллохимиков.
● Алмаз и графит имеют атомные кристаллические решётки, которые различаются расположением в них атомов (демонстрация моделей решёток графита и алмаза).
В атомных кристаллах атомы связаны ковалентной неполярной связью.
Графит отличается от алмаза своим слоистым строением. В каждом слое атомы углерода прочно связаны между собой и образуют непрерывную сетку из правильных шестиугольников, наподобие пчелиных сот. Каждый атом в таком слое имеет трёх соседей. Связи между слоями значительно слабее, чем внутри них. Графит мягкий и непрозрачный, хорошо проводит тепло и электрический ток.
Но при определённых условиях алмаз может превращаться в графит, а последний – в алмаз.
Владимир:
Итак, если мы вас правильно поняли, строение вещества определяет его свойства. А где эти свойства находят применение?
Екатерина: Продолжайте, пожалуйста.
● Техника XXI века с её высокими требованиями к качеству немыслима без алмазов. Так как алмаз – самый твёрдый минерал на Земле из него делают режущие инструменты (например, для резки стекла); алмазными коронками бурят сверхглубокие скважины. Обработанные специально огранённые алмазы, сверкающие всеми цветами радуги – это очень дорогие драгоценные камни – бриллианты.
Немецкий профессор Батеман подсчитал: алмазы стоимостью 10 миллионов долларов может перенести один человек, тогда как золото на эту сумму будет иметь массу 12 тонн.
Собрание исторических бриллиантов и изделий из них хранится в Алмазном фонде Оружейной палаты Московского Кремля.
● Графит используется в производстве смазочных материалов, для изготовления электродов электрических печей, в качестве блоков для атомных реакторов и добавок в антикоррозионные краски.
Сажа используется для изготовления типографской краски, картриджей, резины, косметической туши.
Екатерина:
Можно мне задать вам ещё один вопрос?
Вот все мы знаем активированный уголь, который продаётся в аптеках, но, думаю, многие не знают, что это такое и на каких свойствах основано его применение?
● На этот вопрос отвечу я.
Уголь благодаря своей пористой поверхности обладает замечательной способностью поглощать газы и растворённые вещества. Это свойство называется адсорбцией. Чем больше пористость древесного угля, тем эффективнее адсорбция. Чтобы увеличить поглотительную способность, древесный уголь обрабатывают горячим водяным паром. Обработанный таким способом уголь называется активированным.
В аптеках его продают в виде чёрных таблеток, которые принимают для удаления из желудка и кишечника вредных веществ, при пищевых отравлениях.
Впервые предложил применять активированный уголь для очистки питьевой воды и спирта Петербургский фармацевт Товий Егорович Ловиц.
Способность угля к адсорбции была использована Николаем Николаевичем Зелинским в противогазе, изобретённом им в период первой мировой войны.
Владимир:
Интересно было бы увидеть, как происходит адсорбция?
Екатерина:
Тогда нам необходима помощь химиков.
Группа химиков.
● Демонстрационный опыт. Адсорбция углём растворов йода и чернил, оксида азота (IV).
Владимир:
Да, это убедительно, но мне кажется, что пора познакомиться с химическими свойствами углерода.
На внешнем энергетическом уровне содержит 4 е и до его завершения также не хватает 4е, поэтому тенденция к отдаче и принятию е у него выражена одинаково.
[Таблица приведена в полном тексте статьи.]
Екатерина: Спасибо.
Владимир:
А почему его так назвали? И каково физиологическое действие угарного газа на живой организм?
Екатерина:
Давай, обратимся к экспертам – физиологам и почерпнём у них нужную информацию
Группа физиологов.
● Оксид углерода (II) опасен тем, что не имеет ни цвета, ни запаха, поэтому его присутствие в воздухе незаметно для человека. Его называют угарным газом, так как он очень ядовит. Его отравляющее действие вызвано тем, что оксид углерода(II) легко соединяется с гемоглобином крови (в 200-300 раз быстрее кислорода) и делает его неспособным переносить кислород от лёгких к тканям.
При отравлении угарным газом пострадавшего необходимо вынести на свежий воздух или открыть в помещении окна.
Число случаев отравления увеличивается зимой, когда водители прогревают мотор и салон автомобиля при закрытых окнах. В результате неполного сгорания бензина, образуется угарный газ и как следствие – смерть людей, находящихся в машине. И люди виноваты сами, так как плохо знают химию. А такие знания крайне необходимы.
А курильщики должны знать, что угарный газ является главным отравляющим веществом табачного дыма и должны думать об окружающих. Курящий во время затяжек вдыхает угарный газ. Между затяжками горящая сигарета выделяет его в 4-5 раз больше.
Длительное нахождение в помещении, где концентрация угарного газа в воздухе составляет всего 0,4 %, может привести к смерти.
Екатерина (обращаясь к химикам):
А вы хотите что-то добавить?
● Оксид углерода (II) приносит не только вред, но и много пользы. Он активный восстановитель. Это свойство, позволяет, человечеству получать миллионы тонн чугуна и стали.
Владимир (обращаясь к физиологам):
А действительно ли то, что небольшое содержание углекислого газа в воздухе даже полезно для живых организмов?
● Да, в небольшой концентрации оксид углерода (IV) не оказывает отравляющего действия на организм и даже стимулирует деятельность дыхательного центра.
Но если содержание газа повышается, то это губительно для человека и животных. При наличии в воздухе 3% СО2 наблюдается головокружение, шум в ушах, быстрая утомляемость, сонливость.
При повышении концентрации до 10%, человек начинает задыхаться, и возможен смертельный исход. Так в 1986 году в Камеруне на берегах озера Ниос погибло 1800 сельских жителей. Вот как это случилось, стояла безветренная погода, и вдруг со дна озера произошёл выброс колоссального количества углекислого газа.
● А вы слышали об эффекте собачьей пещеры в Италии?
Она знаменита тем, что собаки в ней не могут находиться, погибают через несколько минут. Человек может там пребывать в нормальном состоянии.
Владимир:
А почему так происходит?
● Дело в том, что в этой пещере из земли выделяется углекислый газ, а так как он в 1,5 раза тяжелее воздуха, то он располагается внизу примерно на высоте роста собаки. В таком воздухе, где углекислого газа 14% собаки и другие животные, разумеется, дышать не могут. Но стоящий на ногах взрослый человек не ощущает избытка газа в пещере.
Владимир:
Катя, по-моему, я скоро лопну от такого количества сведений. И всё-таки мой аппетит только возрастает.
Екатерина:
Какие вопросы тебя ещё волнуют?
Владимир:
Диоксид углерода способен под землёй перемещать тысячи тонн известняка, образуя огромные полости – карстовые пещеры.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Студента 10 группы
Скрипова Кирилла Олеговича
Гребенщикова Антонина Алексеевна
Одним из самых важных химических элементов является углерод - отчасти потому, что он составляет одну пятую человеческого тела. Углерод лежит в основе всех живых организмов. Он содержит в нашей коже, волосах, крови, мышцах, костях и мозге, а также в организмах птиц, рыб, насекомых, червей и в растениях. Даже в образующем наши гены химическом соединении, называемом ДНК, главным элементом является углерод. Вот почему химию углерода часто называют “химией жизни”. Весь живой мир основан на углероде. Соединяясь с другими веществами, он образует раковину улитки, ножки паука, муравьиные яйца, корни растений и бесчисленное множество других частей организмов.
Актуальность темы: Углерод является основным элементом в строении всех живых организмов и шестым по распространенности во Вселенной.
Объект: углерод.
Предмет: аллотропные видоизменения углерода.
Цель работы: выяснить, почему углерод является одним из важных химических элементов.
1. Подобрать литературу и интернет-источники по теме;
2. Изучить строение атома углерода;
3. Выяснить какие аллотропные видоизменения углерод может образовать,
4. Выяснить свойства аллотропных видоизменений углерода и области их применения.
5. Создать информационный стенд по теме.
Методы: изучение литературы и интернет-ресурсов; анализ информации; обобщение и систематизация информации.
Теоретическая значимость работы состоит в том, что она повышает образовательный уровень обучающихся и расширяет кругозор.
Практическая значимость работы состоит в том, что обнаружение новых форм углерода приведёт к созданию новых материалов, необходимых для человечества.
1. 1. История открытия углерода
Двадцать лет спустя Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту [4].
1.2. Природный углерод
Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С, сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате бомбардировки нейтронами ядер азота, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На основе распада 14С основан метод радиоуглеродного датирования, который широко применяется в археологии и палеонтологии.
Всего существует 15 различных изотопов углерода.
Образование атома углерода требует почти одновременного столкновения трех альфа-частиц, то есть ядер атома гелия. Такой процесс, известный как тройной альфа-процесс, может происходить только в недрах звезд-гигантов или сверхгигантов с большой плотностью и высокой температурой (около 100 тыс. К). Чтобы попасть на Землю, углерод сначала должен оставить материнскую звезду, где он образовался (например, в результате взрыва сверхновой) и попасть в межзвездное пространство. Звездные системы третьего поколения, к которым относится Солнечная система, образовались из межзвездной среды, которая была обогащена элементами тяжелее гелия [4].
Углерод (химический символ - C, (международное название Carboneum происходит от лат. Carbo-уголь.) - химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса - 12,0107
Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических.
А способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, называемых органическими, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия [6].
1.3. Гибридизация атома углерода
В органических веществах атом углерода образует четыре химические связи, хотя строение атома указывает, что существует возможность образовать только две.
Для объяснения этого феномена была выдвинута теория гибридизации, хорошо согласующаяся с экспериментальными данными. В соответствии с теорией гибридизации при образовании молекулы метана и молекул других предельных углеводородов одна s - и три p - орбитали взаимодействуют между собой, образуя четыре новые совершенно равноценные орбитали. Такой процесс называют sp 3-гибридизацией, а образующиеся орбитали – sp 3-гибридизованными.
Каждая sp 3-гибридизованная орбиталь содержит по одному неспаренному электрону и имеет форму объемной восьмерки с неравноценными сферами. Точкой пересечения осей всех четырех гибридизованных орбиталей является центр ядра атома углерода; данная точка называется узлом; электронная плотность здесь имеет нулевое значение. В результате взаимного отталкивания электронов орбитали занимают в пространстве наиболее выгодное положение. В этом случае угол между их осями равен 109 градусов 28 минут, и они направлены к вершинам правильного тетраэдра.
Электронное состояние атома углерода определяет пространственное строение молекулы метана. Каждая связь между атомами углерода и водорода образованна за счет перекрывания s - орбитали атома водорода и sp 3- орбитали атома углерода. Центры ядер атомов водорода лежат в вершинах тетраэдра, валентный угол H - C - H составляет 109 градусов 28 минут. Все связи в молекуле метана относятся o -типу. Длина связи C - H в молекуле метана и других предельных углеводородов составляет 0,1 нм; все четыре атома водорода равноценны [1. c 72].
В молекуле этилена атомы углерода имеют иной тип гибридизации по сравнению с молекулой метана. В гибридизации участвуют одна s - и две p - орбитали; третья p -орбиталь остается без изменения. Такое состояние атома углерода называют sp 2-гибридизацией.
В результате атом углерода имеет 4 орбиталей: три гибридизированные sp2- орбитали и одна негибридизированная p - орбиталь. На каждой орбитали находится по одному неспаренному электрону, за счёт которых атом углерода образует четыре ковалентные связи. В результате взаимного отталкивание электронов орбитали располагаются пространственно в максимальном удаление друг от друга. При этом все орбитали имеют одну общую точку ( узел) — центр ядра атома углерода. Максимальное удаление орбиталей друг от друга достигается в том случае, если оси sp2- орбиталей лежат в одной плоскости под углом 120 градусов, а ось p- орбитали перпендикулярна этой плоскости.
Любой атом углерода, образующих химические связи с тремя другими атомами, находятся в состоянии sp2- гибридизации. Это относится и к обоим атомам углерода в молекуле этилена. Каждый атом за счет перекрывания sp2- орбитали образуют три o- связи: с двумя атомами водорода и соседним атомом углерода. При параллельном расположение осей p- орбиталей двух атомов углерода происходит их боковое перекрывание с образованием второй углерод-углеродной связи П- типа. П-Связь является менее прочной и более доступной для атаки реагентов по сравнению с o- связью. Однако суммарная энергия двойной связи больше, чем одинарной.
Электронное строение молекулы этилена определяет и ее пространственное строение. Центры ядер всех шести атомов расположены в одной плоскости, перпендикулярной плоскости П- связи. Все валентные углы НСС,НСН близкий к 120 градусам. Длина двойной связи значительно меньше длины одинарной связи и составляет 0,133нм. Из-за двойной связи между атомами углерода свободное вращение относительно связи С=С невозможно[1.с 89].
Орбитали атомов углерода, связаны тройной связью, находятся в состоянии sp- гибридизации. В гибридизации участвуют одна s- и одна p- орбиталь, при этом образуются две новые гибридизованные sp- орбитали; две p- орбитали остаются без изменения.
В результате атомы углерода в состоянии sp- гибридизации имеет четыре орбитали: две гибридизованные sp- орбитали и две негибридизованные p- орбитали. На каждой из них имеется по одному неспаренному электрону. В результате взаимного отталкивания орбитали располагаются в пространстве следующим образом: оси sp- орбиталей совпадают(т.е. Угол между ними составляет 180 градусов), оси p-орбиталей взаимно перпендикулярны и перпендикулярны оси sp- орбиталей. o-Связи в молекуле ацетилена образованы за счёт взаимного перекрывания s- орбиталей атомов водорода и sp- орбиталей атомов углерода. Кроме того, атомы углерода образуют друг с другом две П- связи за счёт бокового перекрывания p- орбиталей.
Таким образом, молекула ацетилена линейная, т.е. Центры ядер всех четырех атомов лежат на одной прямой. Валентные углы НСС равны 180 градусов. Это исключает существование для алкинов цис-транс-изомерии. Наличие третьей связи между атомами углерода значительно укорачивает тройную углерод-углеродную связь по сравнению с двойной связью; ее длина составляет всего 0,120 нм [1.с 109].
1.4. Аллотропные видоизменения углерода
Алмаз — прозрачное, бесцветное или слегка окрашенное примесями в различные оттенки кристаллическое вещество. Алмаз — самое твердое вещество среди всех известных, даже прочнее обсидиана. Благодаря своей чрезвычайной твердости он широко применяется при бурении твердых горных пород, обработке твердых металлов, производстве абразивов и т. п. Для отшлифованных алмазов, бриллиантов, характерна особая игра света, обусловленная сильным преломлением на гранях. Бриллианты используются как драгоценные украшения.
В алмазе каждый атом углерода образует ковалентные связи с четырьмя другими атомами. В результате образуется гранецентрированная кубическая структура из двух подрешеток, получившей название структуры алмаза.
Крупнейшие месторождения алмазов расположены в Южной Африке и в Якутии. Ежегодная мировая добыча алмаза составляет примерно 300 кг. В последние годы алмаз начали получать искусственно при очень высоких давлениях и высокой температуре.
Коренное месторождение алмазов им. М. В.Ломоносова было открыто в марте 1980 года на территории Приморского района в 100 километрах к северу от Архангельска. На сегодняшний день это месторождение крупнейшее в Европе, а по качеству “царские камни” не уступают кристаллам других месторождений [7].
Графит — темно-серое непрозрачное мелкокристаллическое вещество, жирное на ощупь. В отличие от алмаза, графит хорошо проводит электрический ток и тепло и очень мягкий.
Графит в больших количествах получают искусственно — нагревом кокса или антрацита в специальных электрических печах при температуре около 3000 °C и повышенном давлении без доступа воздуха. Искусственный графит отличается высокой чистотой и мягкостью. По своим качествам он лучше природного. Графит широко применяется для изготовления электродов, в смеси с глиной для производства огнеупорных тиглей. Из графита делают обычные карандаши. В смеси с минеральными маслами его используют в качестве смазки для машин, работающих при повышенных температурах.
Большая разница в физических свойствах алмаза и графита обусловлена разным кристаллическим строением. В кристаллах алмаза каждый атом углерода окружен четырьмя другими атомами, расположенными на одинаковом расстоянии друг от друга. В кристаллах графита атомы углерода расположены в углах правильных шестиугольников в одной плоскости и образуют отдельные слои. Расстояние между отдельными слоями больше, чем между атомами в том же слое. В результате связь между отдельными слоями значительно слабее, чем между атомами того же слоя. Поэтому кристаллы графита легко расщепляются на отдельные чешуйки, которые сами по себе достаточно крепкие. Графит используется в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его высокая температура плавления позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды [8].
Графен по своему строению — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных с помощью sp² связей в гексагональную двумерную кристаллическую решетку (отдельный атомный слой со структурой графита) — атомы углерода образуют сотовую структуру с межатомных расстоянием 142 пм. Без опоры графен имеет тенденцию сворачиваться, но может быть устойчивым на подложке [11].
Карбин. Кристаллическая модификация углерода гексагональной сингонии с цепным строением молекул называется карбин. На вид — мелкокристаллический порошок черного цвета (плотность 1,9-2 г/см³). Карбин — линейный полимер углерода. Кристаллическая структура карбина характеризуется наличием длинных цепочек из атомов углерода, расположенных параллельно. Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите), а также получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу — окислительной дигидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме. Это вещество впервые было получено советскими химиками В. В. Коршаком, А. М. Сладковой, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 1960-х годов в Институте элементоорганических соединений Академии наук СССР.[3] Карбин обладает полупроводниковыми свойствами, причем под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах [9] .
Фуллерен — специфическая структура из атомов углерода, открытая в середине 1980-х, молекула которого имеет вид мяча. Как в графите, каждый атом углерода на поверхности соединен с тремя другими. В отличие от графита, атомы образуют не только шести-, но и пятиугольники. Внутренняя часть молекулы пуста, что дает широкие возможности для получения на основе фуллерена соединений включения [5].
Углеродные нанотрубки — это ещё одна недавно открытая специфическая структура, состоящая из одного или нескольких скрученных в трубку графитовых слоев. Диаметр таких трубок — 1-10 нанометров. Нанотрубки обладают уникальными физическими свойствами, в частности, высокой прочностью на разрыв, адсорбционной способностью. Они активно исследуются и имеют большие перспективы для использования. Углеродные нанотрубки обнаружены в природе (шунгит), их также искусственно выращивают в лабораториях [12].
Древесный уголь добывают нагреванием дерева без доступа воздуха в специальных печах. Его применяют в металлургии для получения высоких сортов чугуна и стали, в кузнечном деле, для изготовления черного пороха и как адсорбент. Древесный уголь обладает способностью адсорбировать (поглощать) на своей поверхности различные газы и некоторые вещества из растворов. Адсорбция происходит поверхностью угля, поэтому он способнен поглощать (адсорбировать) тем большее количество веществ, чем больше его суммарная поверхность, то есть чем больше он измельчен или пористый. Пористость, а вместе с тем и адсорбционная способность древесного угля, резко увеличивается при предварительном нагреве в струе водяного пара. При этом поры угля очищаются от смолистых веществ, и его внутренняя поверхность резко увеличивается. Такой уголь называется активированным.
Активированный древесный уголь широко используется в сахарном производстве для очистки сахарного сиропа от примесей, оказывающих ему желтой окраски, в спиртовом производстве - для очистки винного спирта от сивушных масел, в некоторых производствах - для улавливания паров ценных летучих веществ: бензина, эфира, сероуглерода, бензола и т. п. с последующим удалением при нагревании.
В Первую мировую войну активированный уголь по предложению академика М. Д. Зелинского был применен в противогазах для защиты органов дыхания от отравляющих газов, в частности от хлора, который немцы впервые применили в 1915 году. Активированный уголь как адсорбент применяется и в современных противогазах.
Лонсдейлит обнаружен в метеоритах и получен искусственно, считается, что в отсутствии примесей он тверже алмаза. Решётки алмаза и лонсдейлита отличаются способом упаковки. Для лонсдейлита характерна двухслойная упаковка типа (…АВАВ…), где каждый последующий тетраэдрический слой повёрнут на 60° по отношению к предыдущему. Для алмаза — трёхслойная типа (…АВСАВС…), где все слои построены из одинаковых координационных тетраэдров [10].
- домашний эксперимент направленный на изучение адсорбционных свойств активированного угля.
| Вложение | Размер |
|---|---|
| uglerod.doc | 619.5 КБ |
Предварительный просмотр:
Муниципальное общеобразовательное учреждение
Ученица 8 класса А
МОУ сш р.п.Сурское
Цель. Задачи. Гипотеза.
I . Теоретическая часть. Информационный этап.
2.1. Историческая справка.
2.2. Нахождение в природе.
2.3. Положение в периодической системе химических элементов.
2.4. Аллотропные видоизменения.
2.5. Применение аллотропных видоизменений и биологическое применение.
II. Практическая часть. Экспериментальный этап.
1. Можно ли в домашних (химическая лаборатория в школе) получить древесный уголь. И затем сделать его активированным.
2. Адсорбционная способность активированного угля.
Из меня состоит все живое,
Я графит, антрацит и алмаз,
Я на улице, в поле и в школе
Я в деревьях и в каждом из вас!
Актуальность выбранной темы:
В этом году мы начали изучать химию. Я решила поближе познакомиться с элементом, обладающим удивительными свойствами – углеродом!
Трудно найти химический элемент, который в виде простого вещества был бы столь же многолик, как углерод. Алмаз, графит, сажа, кокс и активированный уголь – все эти совершенно непохожие друг на друга вещества состоят из одних и тех же атомов углерода, по-разному соединённых друг с другом. Углерод способен образовывать миллионы органических соединений. Его называют царём живой природы, на его основе построена жизнь.
Мне стало очень интересно, почему же углерод является жизненно важным для нас? В чём уникальность этого элемента по сравнению с другими?
Изучение аллотропных видоизменений углерода, его строение и свойства.
- Изучить и систематизировать информацию о аллотропных видоизменениях углерода.
- Получить аморфный углерод – древесный уголь.
- Исследовать адсорбционную способность древесного угля (активированного угля)
Основной вопрос проекта:
Почему вещества, имеющие одинаковый качественный состав обладают разными свойствами.
Для достижения поставленных задач использовали следующие приёмы и методы :
- наблюдение и анализ явлений адсорбции
Я предположила, что…
Гипотеза : Причина многообразия веществ в атоме углерода.
Теоретическая часть. Информационный этап
На этапе сбора материала, я хотела узнать, что ребята знают об углероде.
Я подготовила небольшую анкету.
- Знаете ли вы, что углерод составляет основу всех живых организмов?
15 человек дали положительный ответ, 1 учащийся – отрицательный.
Повсюду – ответили 13% опрошенных
Составляет основу живых организмов – 87% опрошенных
- Алмаз, графит, сажа, древесный уголь – это углерод?
Ответ на этот вопрос был 100% да
6 человек дали определение явления адсорбция, это составило 38% опрошенных
9 человек знают что это за явление – 56% опрошенных
1 человек (6% опрошенных) не знает что такое адсорбция
- Какое значение имеет и где используется адсорбция?
Адсорбция используется в медицине – ответили 15 человек,
везде – 1 человек
Определить ее значение участники опроса затруднились
2.1. Историческая справка.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 г. германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод.
2.2 Нахождение в природе.
Природный углерод состоит из двух стабильных изотопов — 12 С (98,93 %) и 13 С (1,07 %) и одного радиоактивного изотопа 14 С (β-излучатель, Т ½ = 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14 N (n, p) 14 C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб .
Содержание углерода в земной коре 0,15555555 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов ( известняки и доломиты ), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана ), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО 2 , в воздухе 0,046 % СО 2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~17,5 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом ( углекислый газ ) и мочой ( мочевина ).
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия . Среди них наиболее обширные группы: углеводороды , белки , жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
2.3. Положение а периодической системе химических элементов.
2.4. Аллотропные изменения.
Вспомним, что такое аллотропия? Это с пособность атомов одного элемента образовывать несколько простых веществ. Явление аллотропии обусловлено в одних случаях тем, что молекулы простого вещества состоят из различного числа атомов (О, О 2 , О 3 ), в других - тем, что их кристаллы имеют различное строение (алмаз, графит, карбин). То есть один и тот же элемент образует разные вещества.
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
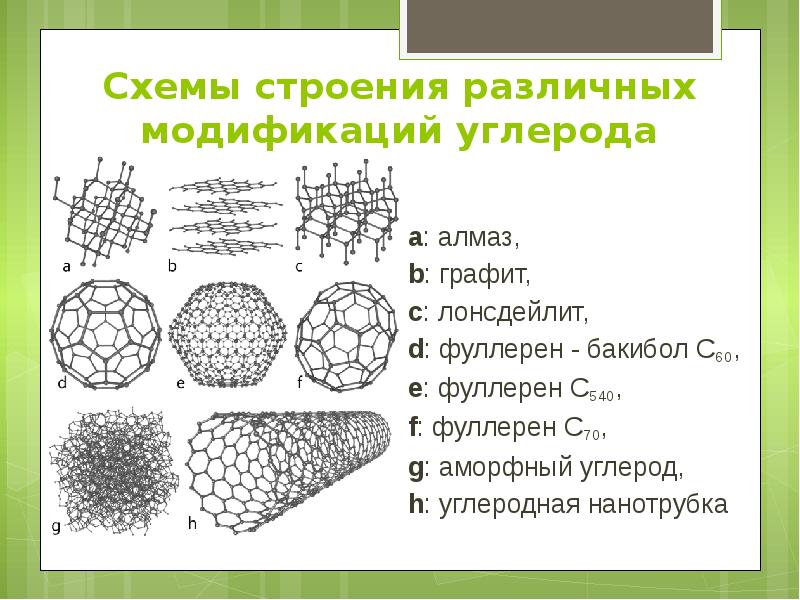
a: алмаз , b: графит , c: лонсдейлит , d: фуллерен — бакибол C 60 , e: фуллерен C 540 ,
f: фуллерен C 70, g: аморфный углерод, h: углеродная нанотрубка
- Активированный уголь
- Древесный уголь
- Ископаемый уголь: антрацит
- Кокс каменноугольный , нефтяной
- Стеклоуглерод
- Техуглерод
- Сажа
- Углеродная нанопена
На практике, как правило, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода.
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит . Более и менее изучены карбин и фуллерен.
Алмаз – прозрачное кристаллическое вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая по десятибалльной системе оценивается высшим баллом 10. Такая твердость алмаза обусловлена особой структурой его атомной кристаллической решетки. В ней каждый атом углерода окружен такими же атомами, расположенными в вершинах правильного тетраэдра.
Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности.
Алмаз известен людям с незапамятных времен. Старинные легенды позволяют предполагать, что первые находки алмазов в Индии относятся к третьему тысячелетию до нашей эры. Не менее чем за пять веков до начала современного летосчисления с алмазом познакомились древние греки, поскольку к этому времени относится греческая бронзовая статуэтка, глазами которой служат два неотшлифованных алмаза. Высказываются предположения, что в Грецию алмазы были завезены из Индии. В Европу заметное количество индийских алмазов начало поступать только в XIII в. Долгое время исключительно высокая твердость камня являлась непреодолимым препятствием для европейских ювелиров, и все попытки обработать этот минерал терпели неудачу. Лишь в середине XV в. голландцу Ван-Беркену удалось огранить алмазы, шлифуя их друг о друга. Долго оставался неизвестным и химический состав таинственного камня, не поддававшегося воздействию самых сильных кислот и щелочей. Некоторые ученые даже думали, что алмаз состоит из особого химического элемента - алмазной земли. В середине XVII в. во Флоренции ставились опыты по нагреванию в закрытых сосудах алмазов и рубинов. При этом было установлено, что рубины не претерпевали никаких изменений, а от алмазов не оставалось "ни малейшего следа". Это казалось совершенно необъяснимым, и лишь много позднее выяснилось, что кристаллы алмаза, нагреваемые в окружении кислорода, попросту сгорают.
Показательное сжигание алмаза в конце XVIII в. было проведено в Петербургском горном училище (ныне Ленинградский горный институт). Этот опыт, по-видимому, имел целью доказать невозможность искусственного получения крупных алмазов путем сплавления мелких кристаллов. К этому же времени относятся многочисленные опыты по сжиганию алмазов, проводившиеся в различных странах Западной Европы.
Большое внимание этим опытам уделял и знаменитый французский химик А. Лавуазье, поскольку "бесследное" исчезновение алмаза при нагревании противоречило закону сохранения материи. Он смог определенно сказать лишь то, что алмаз принадлежит к классу горючих тел и что продуктом сгорания его является газообразное вещество. Отметив возможное родство алмаза с углеродом, ученый все же не решился отождествить сверкающий камень с углем и не сделал окончательного вывода о составе алмаза. Он писал, что, может быть, никогда нельзя будет определить состав этого минерала.
Однако уже на рубеже XVIII и XIX вв. химическая природа алмаза была точно установлена. Английский химик П. Теннан в 1797 г. сжег алмаз в плотно закрытом золотом сосуде, заполненном кислородом, и установил, что образовавшийся при этом газ является двуокисью углерода. Поскольку первоначально в сосуде кроме алмаза и кислорода ничего не было, то, следовательно, алмаз в химическом отношении является чистым углеродом. Чтобы окончательно убедиться в правильности сделанного вывода, П. Теннан определил количество углерода в заполняющем сосуд углекислом газе. Оказалось, что оно в точности соответствует массе сгоревшего алмаза.
Исключительную по своей прозорливости мысль высказал М. В. Ломоносов: причиной необычайной твердости алмаза является "сложение его из частиц, тесно соединенных". Предвидение гениального ученого подтвердилось почти через два столетия, в начале XX в., когда с помощью рентгеновских лучей удалось расшифровать атомную структуру алмаза и графита. Были установлены существенные различия в пространственном расположении слагающих эти вещества элементарных частиц - атомов.
В алмазе атомы углерода размещаются очень плотно, причем каждый из них прочно связан с четырьмя окружающими его атомами (рис. 1).
Рис. 1. Атомная структура алмаза
Хотя алмаз в чистом виде состоит только из атомов углерода, реальные природные кристаллы этого минерала постоянно содержат примеси других веществ. Минимальные количества примесей характерны для бесцветных и слабоокрашенных прозрачных алмазов. При сжигании таких камней количество золы не превышает 0,02-0,05% от их массы. В замутненных и особенно в непрозрачных разновидностях алмаза содержание золы достигает нескольких процентов.
Спектральным анализом в составе золы установлены кремний, магний, кальций, алюминий, железо, титан и некоторые другие химические элементы.
Наряду с мельчайшими включениями в алмазах нередко присутствуют и сравнительно крупные посторонние частицы: чаще всего графит, несколько реже минералы, являющиеся по химическому составу силикатами (оливин, пироксены), алюмосиликатами (гранаты) и сложными окислами (хромшпинелиды). В крупных кристаллах алмаза довольно обычны также включения его мелких кристалликов.
Плотность алмаза около 3,52. Эта величина типична для чистых хорошо образованных кристаллов. У мелкозернистых агрегатов, часто содержащих включения графита и обладающих не вполне массивным сложением, плотность существенно ниже и у отдельных разновидностей карбонадо опускается до 3,0. Для сравнения укажем, что плотность графита не превышает 2,23. Таким образом, "рыхлость" атомной структуры графита привела к более чем полуторакратному снижению плотности.
Цвет и особенности светопреломления алмаза рассмотрены в предыдущей главе, а здесь мы остановимся еще на одном весьма интересном и важном его свойстве, которое также тесно связано с внутренним строением. Речь пойдет о люминесценции. Люминесценцией называется способность некоторых природных и синтетических веществ светиться под действием рентгеновских, ультрафиолетовых и катодных лучей, что принято обозначать специальными терминами: рентгенолюминесценция, фотолюминесценция, катодолюминесценция.
Наиболее изучены рентгено- и фотолюминесценция алмаза, которые используются при проведении геологопоисковых работ, о чем подробнее рассказывается в заключительных главах. Некоторые исследователи связывают люминесценцию с присутствием посторонних примесей, другие указывают на причинную связь этого явления со специфическими особенностями кристаллической решетки минерала.
Чистые кристаллы прозрачны не только для световых, но и для рентгеновских лучей, что позволяет легко определять алмазы среди сходных по внешнему облику минералов, а также отличать бриллианты от всевозможных подделок. А вот ультрафиолетовые лучи многие алмазы совершенно не пропускают.
Твердость является, как уже отмечалось, весьма важным свойством алмаза, определяющим его исключительно большую роль в производственной деятельности человека. Под твердостью обычно подразумевается сопротивление одного тела проникновению в него другого. Для качественного определения относительной твердости минералов широко используется так называемая шкала твердости (шкала Мооса), предложенная в начале XIX в. Шкала включает десять минералов-эталонов, расположенных в порядке возрастания твердости. При этом порядковые номера эталонов принимаются в качестве баллов твердости.

Научные доклады
Углерод является химическим элементом IV группы периодической системы Менделеева. О его существовании было известно еще в глубокой древности, а вот имя человека, открывшего углерод, до сих пор является тайной.
Благодаря способности атомов углерода соединяться не только друг с другом, но и с атомами других элементов, многообразие его соединений поражает.
Углерод в природе
Также много минералов и ископаемых содержат углерод. Среди углеродсодержащих минералов выделяют кальцит СаСО3, СаМg(СО3)2 и магнезит МgСО3. А вот горючие ископаемые практически все построены на углеродной основе. Некоторые угли на 99% состоят из углерода. Кроме того этот элемент на 0,1% составляет земную кору и является частью атмосферы и гидросферы, где растворен СО2.
Модификации химического элемента углерода
Элементарный углерод образует 3 модификации:
- Алмаз. Это прозрачное, кристаллическое, бесцветное вещество. Оно сильно преломляет солнечные лучи. Находясь в возбужденном состоянии, валентные атомы углерода распариваются и образовываются 4-ре неспаренных электрона. Также при возникновении ковалентных связей под определенным углом образуется кристаллическая атомная решетка, которая есть только у алмаза. В алмазе каждый углеродный атом окружен еще 4-ьмя другими атомами. Исключительная твердость камня объясняется плотным размещением атомов. Кстати электрический ток он плохо проводит. В 1961 году запустили производство синтетических алмазов из графита. Основная масса, из которой образуются алмазы – это алмазная пыль и небольшие кристаллы. Если его нагреть до температуры выше 1000°С, то он превращается в графит.
- Графит. Представляет собой кристаллическое серо-черное вещество, жирное на ощупь, с металлическим блеском, не слишком твердое. Его атомы образовывают с соседними атомами 3 ковалентных σ-связи. Так образовывается сетка из шестиугольников. Элемент обладает низкой механической прочностью и с легкостью распадается на чешуйки, которые прочны. Между слоями атомов существует связь, частично металлического характера. Графит прекрасно проводит электрический ток.
- Карбин. Представляет мелкокристаллический порошок черного окраса. Атомы имеют кристаллическую структуру и соединены тройными и одинарными связями в виде линейные цепочки. Существует в разных формах. Ученые обнаружили, что карбин есть и в космосе: его нашли в метеоритном веществе. Характеризуется полупроводниковыми свойствами. При температуре 2300°С переходит в гранит.
- Уголь. Являет собой измельченный графит. Образуется без доступа воздуха при термическом разложении соединений, содержащих углерод. Самые важные сорта это древесный уголь, кокс, сажа. Структура углей пористая.
Химические свойства углерода
Уголь, алмаз и графит при обычных температурах химически инертны. Их активность увеличивается с повышением температуры. Окислителями углерода являются некоторые металлы, которые образуют карбиды при высоких температурах. Графит и уголь с водородом образовывают углеводороды, например, метан. С кислородом элемент проявляет восстановительные свойства, а когда он полностью сгорает, то образует оксид углерода. Уголь может окисляться концентрированными горячими азотными и серными кислотами. Примечательно, что углерод крайне устойчив к щелочам.
Где применяется углерод?
Алмазами обрабатываются твердые металлы – они режутся и шлифуются. Также им можно сверить и гравировать стекло, бурить горные породы. Если сам элемент отшлифовать и огранить, то получиться бриллиант, который используется в ювелирной сфере. Графит является ценным материалом для промышленности. Из него делают плавильные тигли, литейные формы, огнеупорные изделия, трубы и аппараты, карандаши, краски и смазочный материал. Чистейший гранит используют для замедления нейтронов в ядерных реакторах. Из карбина изготавливают полупроводники. Кокс применяется при выплавке руд и металлов, древесный уголь важный для кузнечного дела и металлургической промышленности. Сажей наполняют резины для того, чтобы повысить их прочность, она выступает компонентом печатных красок, крема для обуви, туши.
Вы можете изучить и скачать доклад-презентацию на тему 29. Углерод. Презентация на заданную тему содержит 32 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!



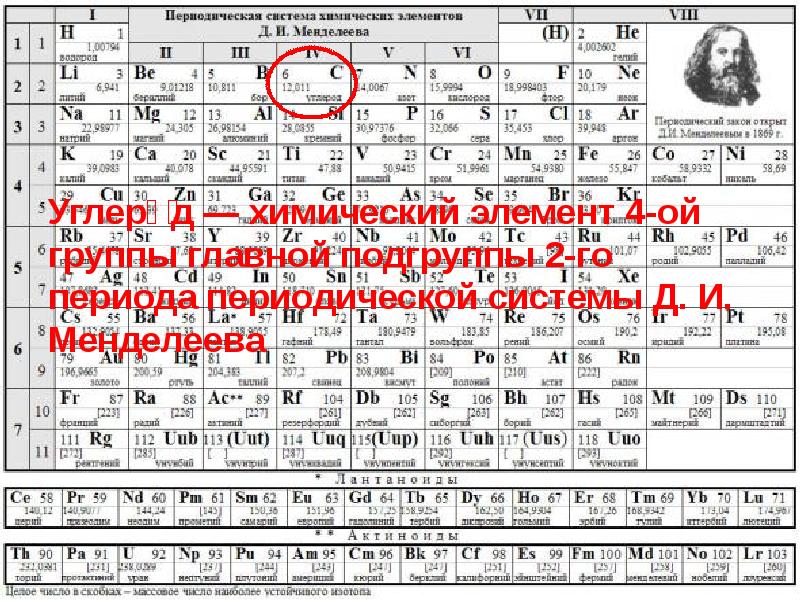























Углеро́д — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Д. И. Менделеева
Основные характеристики Имя, : Углерод / Carboneum Символ, номер:(С) , 6 Электронная конфигурация: [He] 2s2 2p2 Температура кипения: 4 827°C Атомная масса: 12,0107 ± 0,0008 а. е. м. Степень окисления -4 , +2, +4
Физические свойства Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа. Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит.
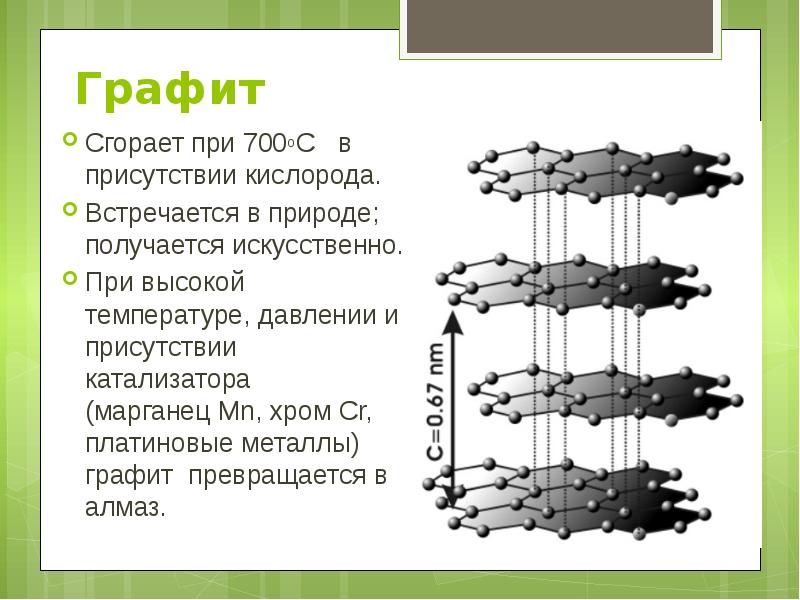
Графит Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском, обладает электропроводимостью Атомы расположены параллельными слоями, образуя гексагональную решетку. Внутри слоя атомы связаны сильнее, чем один слой с другим, поэтому графит может расслаиваться.
Графит Сгорает при 700оС в присутствии кислорода. Встречается в природе; получается искусственно. При высокой температуре, давлении и присутствии катализатора (марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз.
Алмаз Алмаз - минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черный цвет. Не проводит электрический ток, но имеет высокую теплопроводность. В кристалле атомы углерода образуют непрерывный трехмерный каркас, состоящий из сочлененных тетраэдров, что обеспечивает высокую прочность связей.
Алмаз Алмаз - это самое твердое вещество из всех известных. Температура плавления выше 3500оС. Химически стоек. Сгорает при 870оС в присутствии кислорода. При 1800оС в отсутствие кислорода превращается в графит.
Карбин Карбин получен искусственно. Он представляет собой мелкокристаллический порошок чёрного цвета. Построен из длинных цепочек атомов С, уложенных параллельно друг другу.
Лонсдейлит Лонсдейлит найден в метеоритах и получен искусственно; Его структура и свойства окончательно не установлены.
Схемы строения различных модификаций углерода a: алмаз, b: графит, c: лонсдейлит, d: фуллерен - бакибол C60, e: фуллерен C540, f: фуллерен C70, g: аморфный углерод, h: углеродная нанотрубка
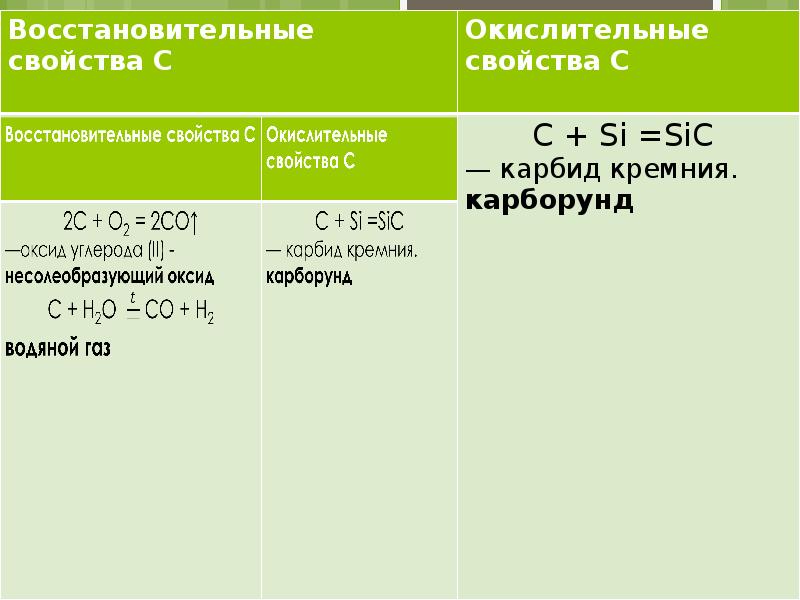
Химические свойства При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.). “Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании. С бромом и йодом углерод не реагирует
Получение углерода Сухая перегонка древесины, каменного угля, древесный уголь, кокс, активированный уголь. Самый чистый углерод – сажа: CH4 → C + 2H2 при 1000о С Неполное сжигание метана и др. углеводородов: СН4+О2=С+2Н2О
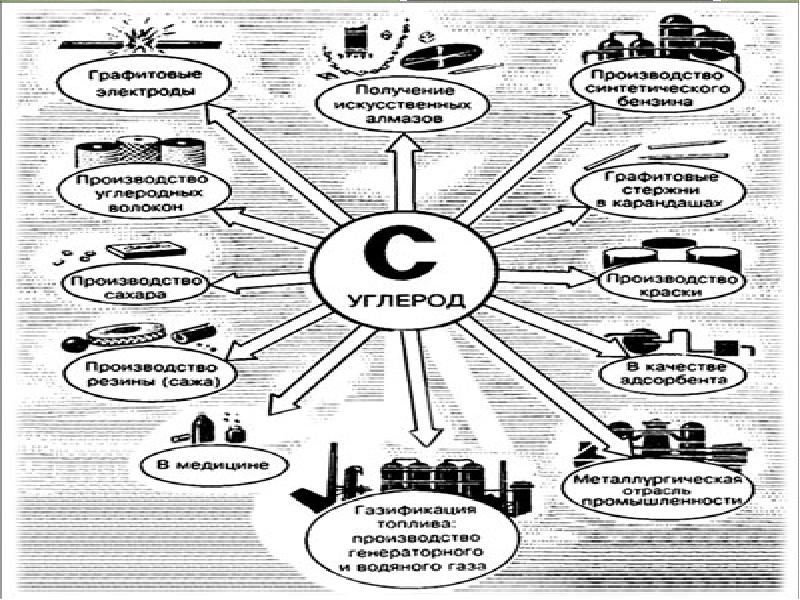
Применение углерода С Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Применение углерода С Графит используется в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления, позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Применение углерода С Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы - бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров.
Применение углерода С В фармакологии и медицине широко используются различные соединения углерода. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний
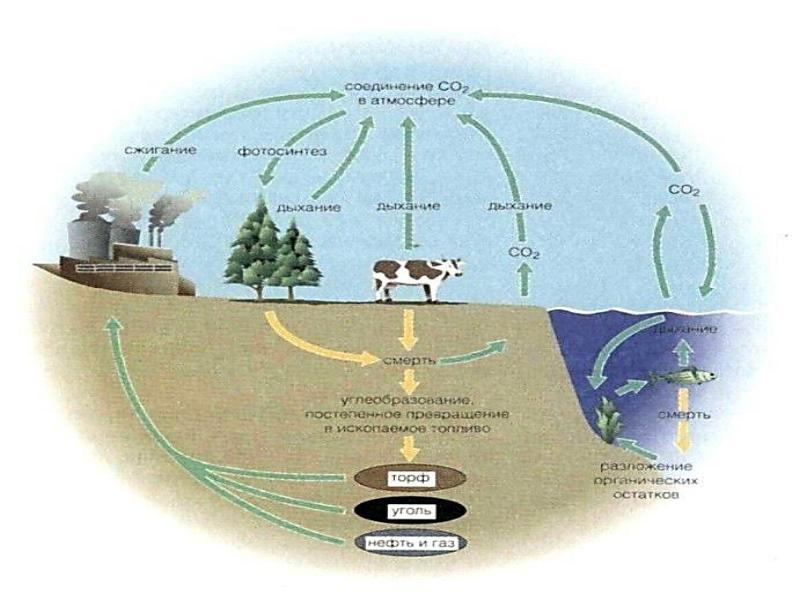
Круговорот углерода в природе Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Круговорот углерода в природе Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Читайте также:

