Кристаллы в природе доклад
Обновлено: 11.05.2024
Понятие кристалла, его основные свойства, строение и формы. Характеристика жидких кристаллов и их область применения в науке, технике и современной жизни. Изучение материала по выращиванию кристалла в обычных и лабораторных условиях, описание наблюдений.
| Рубрика | Химия |
| Вид | практическая работа |
| Язык | русский |
| Дата добавления | 12.05.2014 |
| Размер файла | 21,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Исследовательская работа
КРИСТАЛЛЫ И ИХ ПРИМЕНЕНИЕ
Г.Завитинска Амурской области
учитель физики МБОУСОШ №1
Г.Завитинска Амурской области
Завитинск.
2013г.
Содержание
- Введение
- 1. Кристалл. Его свойства, строение и форма
- 2. Жидкие кристаллы
- 3. Применение ЖК
- 4. Применение кристаллов в науке и технике
- 5. Практическая часть
- Заключение
- Список литературы
- ВведениеАктуальность работы:
- Так как кристаллы имеют широкое применение в науке и технике, то трудно назвать такую отрасль производства, где не использовались бы кристаллы. Поэтому знать и разбираться в свойствах кристаллов очень важно для каждого человека.
- Цель исследования: Выращивание кристалла из раствора в домашних условиях, изучение практического применения кристаллов в науке и технике.
- Задачи: 1.Изучение теории о кристаллах.
- 2.Изучение материала по выращиванию кристалла в обычных условиях и в лабораторных условиях.
- 3.Наблюдение за образованием кристалла.
- 4.Описание наблюдений.
- 5.Изучение области применения кристаллов в современной жизни.
1. Кристалл. Его свойства, строение и форма
Образование кристаллов.
Кристаллы образуются тремя путями: из расплава, из раствора и из паров. Примером кристаллизации из расплава может служить образование льда из воды. кристалл жидкий выращивание лабораторный
В окружающем нас мире часто можно наблюдать образование кристаллов непосредственно из газовой среды, из растворов и из расплава. В тихую морозную ночь при ясном небе, в ярком свете луны или фонаря, мы иногда видим поблескивающие искорками медленно опускающиеся чешуйки инея. Это пластинчатые кристаллики льда, образующиеся тут же около нас из влажного и остывшего воздуха.
Структура твердых тел зависит от условий, в которых происходит переход из жидкого в твёрдое состояние. Если такой переход происходит очень быстро, например, при резком охлаждении жидкости, то частицы не успевают выстроиться в правильную структуру и образуется мелкокристаллическое тело. При медленном охлаждении жидкости получаются крупные и правильной формы кристаллы. В некоторых случаях, для того чтобы вещество закристаллизовалось, его приходиться выдерживать при различных температурах. Также на рост кристалла влияет внешнее давление. Кроме того, значительная часть кристаллов, имевших в далеком прошлом совершенную огранку, успела утратить ее под действием воды, ветра, трения о другие твердые тела. Так, многие округлые прозрачные зерна, которые можно найти в прибрежном песке, являются кристаллами кварца, лишившимися граней в результате длительного трения друг о друга.
Строение кристаллов
Разнообразие кристаллов по форме очень велико.
Кристаллы могут иметь от четырех до нескольких сотен граней. Но при этом они обладают замечательным свойством - какими бы ни были размеры, форма и число граней одного и того же кристалла, все плоские грани пересекаются друг с другом под определенными углами. Углы между соответственными гранями всегда одинаковы. На форму оказывают влияние такие факторы, как температура, давление, частота, концентрация и направление движения раствора. Поэтому кристаллы одного и того же вещества могут обнаруживать большое разнообразие форм.
Кристаллы каменной соли, например, могут иметь форму куба, параллелепипеда, призмы или тела более сложной формы, но всегда их грани пересекаются под прямыми углами. Грани кварца имеют форму неправильных шестиугольников, но углы между гранями всегда одни и те же -- 120°.
Закон постоянства углов, открытый в 1669 г. датчанином Николаем Стено, является важнейшим законом науки о кристаллах -- кристаллографии.
Измерение углов между гранями кристаллов имеет очень большое практическое значение, так как по результатам этих измерений во многих случаях может быть достоверно определена природа минерала.
Простейшим прибором для измерения углов кристаллов является прикладной гониометр.
Виды кристаллов
Кроме того различают монокристаллы и поликристаллы.
Монокристалл представляет собой монолит с единой ненарушенной кристаллической решеткой. Природные монокристаллы больших размеров встречаются очень редко.
Монокристаллами являются кварц, алмаз, рубин и многие другие драгоценные камни.
Большинство кристаллических тел являются поликристаллическими, то есть состоят из множества мелких кристалликов, иногда видных только при сильном увеличении.
Поликристаллами являются все металлы.
2. Жидкие кристаллы
Жидкий кристалл - это особое состояние вещества, промежуточное между жидким и твердым состояниями. В жидкости молекулы могут свободно вращаться и перемещаться в любых направлениях. В жидком кристалле имеется некоторая степень геометрической упорядоченности в расположении молекул, но допускается и некоторая свобода перемещения.
Консистенция жидких кристаллов может быть разной - от легкотекучей жидкой до пастообразной. Жидкие кристаллы имеют необычные оптические свойства, что используется в технике.Жидкие кристаллы образуются из молекул, имеющих разную геометрическую форму. таких, как цвет, прозрачность и др. На всем этом основаны многочисленные применения жидких кристаллов.
3. Применение ЖК
Расположение молекул в жидких кристаллах изменяется под действием таких факторов, как температура, давление, электрические и магнитные поля; изменения же расположения молекул приводят к изменению оптических свойств, таких, как цвет, прозрачность и способность к вращению плоскости поляризации проходящего света. На всем этом основаны многочисленные применения жидких кристаллов. Например, зависимость цвета от температуры используется для медицинской диагностики. Нанося на тело пациента некоторые жидкокристаллические материалы, врач может легко выявлять затронутые болезнью ткани по изменению цвета в тех местах, где эти ткани выделяют повышенные количества тепла. Температурная зависимость цвета позволяет также контролировать качество изделий без их разрушения. Если металлическое изделие нагревать, то его внутренний дефект изменит распределение температуры на поверхности. Эти дефекты выявляются по изменению цвета нанесенного на поверхность жидкокристаллического материала.
Тонкие пленки жидких кристаллов, заключенные между стеклами или листками пластмассы, нашли широкое применение в качестве индикаторных устройств. Жидкие кристаллы широко применяются в производстве наручных часов и небольших калькуляторов. Создаются плоские телевизоры с тонким жидкокристаллическим экраном.
4. Применение кристаллов в науке и технике
В наше время кристаллы имеют очень широкое применение в науке, технике и медицине.
Алмазными пилами распиливают камни. Алмазная пила - это большой (до 2-х метров в диаметре) вращающийся стальной диск, на краях которого сделаны надрезы или зарубки. Мелкий порошок алмаза, смешанный с каким-нибудь клейким веществом, втирают в эти надрезы. Такой диск, вращаясь с большой скоростью, быстро распиливает любой камень.
Огромное значение имеет алмаз при бурении горных пород, в горных работах. В граверных инструментах, делительных машинах, аппаратах для испытания твердости, сверлах для камня и металла вставлены алмазные острия. Алмазным порошком шлифуют и полируют твердые камни, закаленную сталь, твердые и сверхтвёрдые сплавы. Сам алмаз можно резать, шлифовать и гравировать только самим же алмазом. Наиболее ответственные детали двигателей в автомобильном и авиационном производстве обрабатывают алмазными резцами и сверлами.
Корундом можно сверлить, шлифовать, полировать, точить камень и металл. Из корунда и наждака делают точильные круги и бруски, шлифовальные порошки и пасты. На полупроводниковых заводах тончайшие схемы рисуют рубиновыми иглами.
Гранат также используется в абразивной промышленности. Из гранатов изготовляют шлифовальные порошки, точильные круги, шкурки. Они иногда заменяют в приборостроении рубин.
Флюорит используется для изготовления линз телескопов и микроскопов, для изготовления призм спектрографов и в других оптических приборах.
5. Практическая часть
Выращивание кристаллов медного купороса.
Медный купорос -- пятиводный сульфат меди, так как крупные кристаллы напоминают цветное синее стекло. Медный купорос применяют в сельском хозяйстве для борьбы с вредителями и болезнями растений, в промышленности при производстве искусственных волокон, органических красителей, минеральных красок, мышьяковистых химикатов.
Способ выращивания в домашних условиях:
1) Для начала приготовим раствор концентрированного купороса. После этого слегка подогреем смесь, чтобы добиться полного растворения соли. Для этого стакан поставим в кастрюлю с теплой водой.
2) Полученный концентрированный раствор перельем в банку или химический стакан; туда же подвесим на нитке кристаллическую "затравку" - маленький кристаллик той же соли - так, чтобы он был погружен в раствор. На этой "затравке" и предстоит расти будущему экспонату вашей коллекции кристаллов.
3) Сосуд с раствором поставим в открытом виде в теплое место. Когда кристалл вырастет достаточно большим, вынем его из раствора, обсушим мягкой тряпочкой или бумажной салфеткой, обрежем нитку и покроем грани кристалла бесцветным лаком, чтобы предохранить от "выветривания" на воздухе.
Наблюдение за процессом роста кристаллов медного купороса.
Для начала мы налили в химический стакан раствор медного купороса, привязали на нитку затравку. И опустили в стакан кристалл. Уже на следующий день у нас появился поликристалл довольно больших размеров, около 2 сантиметров в длине. Сам кристалл был очень неровный, с небольшими столбцами. Дальше кристаллизация не продолжалась, сколько бы мы не ждали.
Но мы на этом не останавливались и сделали ещё два кристалла медного купороса. Только затравку мы взяли из столбца неполучившегося кристалла. В одном растворе температура постоянно менялась, а в другом стакане была неизменной. Через несколько суток у нас получились два полноценных монокристалла медного купороса. Они получились с ровными гранями, абсолютно симметричные. Так я понял что для того чтобы сделать ровный кристалл надо чтобы затравка тоже была ровной и симметричной.
Наблюдение за процессом роста кристаллов в растворах солей под микроскопом.
Рассматривать кристаллы под микроскопом очень интересно, так как чем "моложе" кристалл, тем более правильную форму он имеет. Изучение кристаллов под микроскопом не занимает много времени и ресурсов: для приготовления раствора необходимо всего несколько грамм соли, да и времени на рост кристалла уходит не так много.
Наносили на предметное стекло микроскопа несколько капель насыщенного раствора различных солей. Стекло слегка подогревали пламенем спиртовки и помещали на столик микроскопа. Перемещением предметного стекла и регулированием увеличения добивались такого положения, чтобы капля заняла все поле зрения микроскопа. Через небольшой промежуток времени (около 1 мин) на краю капли, где она высыхает быстрее, начиналась кристаллизация. Возникшие мелкие кристаллы образовывали по краям капли сплошную непрозрачную корку, которая в проходящем свете кажется темной. Постепенно из этой массы кристаллов начинали проступать направленные внутрь капли отдельные острия индивидуальных кристаллов, которые, разрастаясь, образуют разнообразные формы. Чаще всего новые центры кристаллизации в свободном пространстве внутри капли, как правило, самопроизвольно не возникали. Через некоторое время все поле зрения заполнялось кристаллами, и кристаллизация практически заканчивалась.
Таким образом, кристаллы одни из самых красивых и загадочных творений природы. Мы живем в мире, состоящем из кристаллов, строим из них, обрабатываем их, едим их, лечимся ими… Изучением многообразия кристаллов занимается наука кристаллография. Она всесторонне рассматривает кристаллические вещества, исследует их свойства и строение. В давние времена считалось, что кристаллы представляют собой редкость. Действительно, нахождение в природе крупных однородных кристаллов - явление нечастое. Однако мелкокристаллические вещества встречаются весьма часто. Так, например, почти все горные породы: гранит, песчаники, известняк - кристалличны. Даже некоторые части организма кристалличны, например, роговица глаза, витамины, оболочка нервов. Долгий путь поисков и открытий, от измерения внешней формы кристаллов вглубь, в тонкости их атомного строения еще не завершен. Но теперь исследователи довольно хорошо изучили его структуру и учатся управлять свойствами кристаллов.
В результате проведенной работы я могу сделать следующие выводы:
1. Кристалл - это твердое состояние вещества. Он имеет определенную форму и определенное количество граней.
2. Кристаллы бывают разных цветов, но в большинстве своём прозрачны.
3. Кристаллы - совсем не музейная редкость. Кристаллы окружают нас повсюду. Твёрдые тела, из которых мы строим дома и делаем станки, вещества, которые мы употребляем в быту, - почти все они относятся к кристаллам. Песок и гранит, поваренная соль и сахар, алмаз и изумруд, медь и железо - всё это кристаллические тела.
4. Самые ценные среди кристаллов - драгоценные камни.
5. Я вырастил кристалл в домашних условиях из насыщенного раствора медного купороса.
Таким образом, цели и задачи, которые были обозначены мной в начале работы, достигнуты. В результате проведенной работы я опытным путём нашёл доказательство для предположения, которое было высказано английским кристаллографом Франком о ступенчатом росте кристаллов.
Проведенная работа была очень интересной и занимательной. Мне бы хотелось ещё вырастить кристаллы из других веществ, ведь их так много вокруг нас…
Подобные документы
Твёрдые кристаллы: структура, рост, свойства. "Наличие порядка" пространственной ориентации молекул как свойство жидких кристаллов. Линейно поляризованный свет. Нематические, смектические и холестерические кристаллы. Общее понятие о сегнетоэлектриках.
курсовая работа [55,4 K], добавлен 17.11.2012
Примеры применения монокристаллов. Семь кристаллических систем: триклинная, моноклинная, ромбическая, тетрагональная, ромбоэдрическая, гексагональная и кубическая. Простые формы кристаллов. Получение перенасыщенного раствора и выращивание кристалла.
презентация [391,6 K], добавлен 09.04.2012
История открытия жидких кристаллов, особенности их молекулярного строения, структура. Классификация и разновидности жидких кристаллов, их свойства, оценка преимуществ и недостатков практического использования. Способы управления жидкими кристаллами.
курсовая работа [58,4 K], добавлен 08.05.2012
Общая характеристика поверхностных явлений в жидких кристаллах. Рассмотрение отличительных особенностей смектических жидких кристаллов, различных степеней их упорядочения. Исследование анизотропии физических свойств мезофазы, степени упорядочения.
реферат [655,6 K], добавлен 10.10.2015
Жидкокристаллическое (мезоморфное) состояние вещества. Образование новой фазы. Типы жидких кристаллов: смекатические, нематические и холестерические. Термотропные и лиотропные жидкие кристаллы. Работы Д. Форлендера, способствовавшие синтезу соединений.
Эти удивительные вещества, созданные природой, до такой степени стали частью нашей жизни, что, сталкиваясь с ними практически ежедневно, мы не всегда задумываемся об их происхождении. Может, тебе приходилось обращать внимание на белый налет в кастрюле или на дне стакана после испарения соленой воды или очень сладкого чая? Если внимательно рассмотреть этот налет под лупой, то можно увидеть очень мелкие кристаллики соли или сахара. Крупинки соли и сахара, песок и снежинки, минералы и драгоценные камни — вот далеко не полный список кристаллов.
Что такое кристалл?
Кристалл — это твердое вещество, все мельчайшие частицы которого (молекулы, атомы или ионы) находятся в строго определенном, повторяющемся порядке. Именно такая структура позволяет формировать кристаллы уникальной формы.

Почему у каждого кристалла своя форма?
Все кристаллы растут, но каждый из них растет со своей скоростью и в определенном направлении. Во время роста любого кристалла на его поверхности самопроизвольно образуются плоские грани, а сам кристалл принимает какую-либо геометрическую форму. Это означает, что грани кристалла растут в строго определенном направлении. Ученые неоднократно убеждались в этом в ходе следующего опыта. У стандартного кристалла геометрической формы они обрезали все углы, превратив его в шар, и поместили в раствор или расплав того же вещества.
Спустя некоторое время на поверхности шара стали образовываться ровные площадки граней кристалла. По мере роста граней площадки становились все больше и больше и постепенно соединились в многогранник неправильной формы. Чаще всего кристаллы вынужденно принимают такую форму. А происходит это потому, что одни грани растут быстрее других и мешают их свободному росту.

Правильный многогранник может образоваться только в том случае, если ничто не мешает его росту. А если один кристалл столкнулся с другим, то больше расти в сторону этого кристалла он не может, поэтому меняет направление. В результате такого роста и образуются многогранники разной формы.
Как образуются кристаллы?
В недрах Земли находится магма, в процессе медленного остывания и затвердевания которой образуются кристаллы различных минералов с разным кристаллическим строением. Почему так происходит? Ты уже знаешь, что у каждого вещества своя температура плавления, или кристаллизации, или затвердевания. Поэтому все вещества, находящиеся в магме, затвердевают по очереди, в соответствии с той температурой, при которой они способны принять кристаллическую форму. Большинство из таких кристаллов является драгоценными камнями.

Кристаллы также могут образовываться из пара. Так, например, пар, который ты выдыхаешь во время сильных морозов, превращается в небольшие белые хлопья. Во время первых осенних заморозков трава и ветви низкорослых кустарников могут покрыться удивительными кристаллами инея, который исчезает по мере повышения температуры.
Испарение из раствора — еще один способ образования кристаллов. Например, после испарения воды из насыщенного соляного раствора на дне емкости останутся кристаллы соли. Подобные процессы происходят и в природе. Под лучами жаркого летнего солнца вода в морях и соляных озерах начинает испаряться. Кристаллы соли сначала плавают на поверхности воды, а затем оседают на дно.
Так образуются природные месторождения солей.
В чем секрет уникальности кристаллов?
Уникальность кристаллов заключается в их особой форме и гранях, которые они образуют. Если внимательно присмотреться к кристаллам соли и сахара, то разницу можно увидеть даже без микроскопа.
Все кристаллические решетки представляют собой различные геометрические фигуры: треугольники, прямоугольники, квадраты, ромбы и т.д., причем форма зависит от типа молекул и атомов каждого вещества.
ЗАПОМНИ! Процесс образования кристалла называется кристаллизация. В природе кристаллы довольно часто образуются в момент охлаждения жидкости и ее последующего затвердевания: определенные молекулы жидкости собираются вместе в виде особой решетки, которая неоднократно повторяется.
Снежинкa
Одними из самых интересных и необычных кристаллов являются снежинки. Снежинки — это кристаллы льда в форме игл, призм, шестиугольников, пластинок и др.
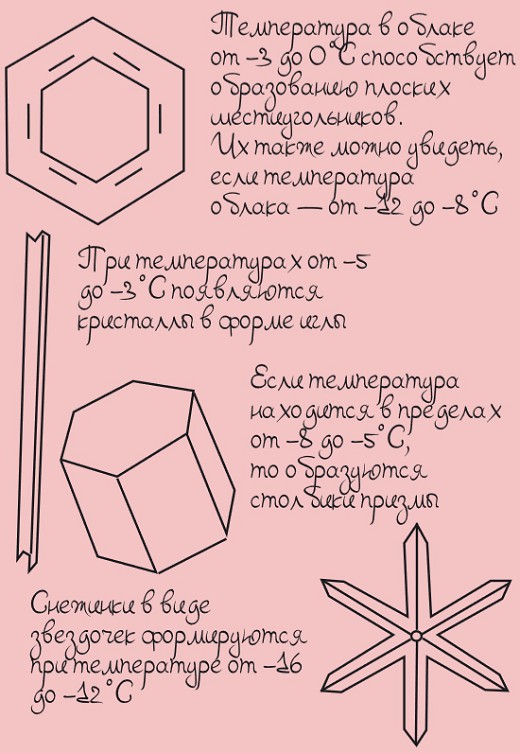
Когда молекулы воды кристаллизуются, они могут образовывать только трех или шестиугольные фигуры. Вот в этом и заключается основная причина шестиугольной формы снежинок!
От чего зависит форма снежинок?
Форма снежинок зависит от нескольких факторов:
- температуры, при которой снежинка образуется,
- высоты над уровнем моря,
- содержания водяного пара в облаке, в котором эта снежинка образовалась.
Жеода - чудо природы
Природа создала множество удивительных творений, и одно из них — жеоды. Жеоды — это необычные, полые внутри камни, полностью или частично заполненные разросшимися кристаллами. Жеоды бывают любой формы, но чаще всего встречаются округлые или овальные.

Размеры жеод варьируются от 1 см до 1 м, самые маленькие экземпляры (менее 1 см) называют миндалинами. Кристаллы, образовавшиеся в жеодах, зависят от минерального вещества, изначально попавшего в подземные пустоты. Чаще всего встречаются жеоды кварца, аметиста, горного хрусталя, агата, халцедона.
Применение кристаллов
Кристаллы находят довольно широкое применение в технике и быту.
Так, благодаря высочайшей твердости алмазы, природные и искусственные, используются в промышленности для изготовления высокопрочных режущих инструментов, специальных опорных элементов для особо точных хронометров и других приборов, а ограненные алмазы (бриллианты) считаются одними из самых дорогих драгоценных камней. Рубины также являются драгоценными камнями. Они, как и алмазы, широко применяются в часовой промышленности, на фабриках по изготовлению химического волокна.

Кристаллы - удивительное и непредсказуемое явление природы. Размеры, цвета и формы кристаллов иногда просто поражают своей необычностью. Это и снежинки зимой, и драгоценные камни в ювелирных изделиях. Мы строим дома из кристаллов, также едим кристаллы, лечимся ими, но, что самое главное – мы сами частично состоим из кристаллов. Соль, сахар, снег, лед, глина и песок, сотни других веществ – все это не что иное, как кристаллы.
| Вложение | Размер |
|---|---|
| kristally_v_prirode.pptx | 2.59 МБ |
| kristally_v_prirode_i_zhizne_lyudey.docx | 1.28 МБ |
Предварительный просмотр:
Подписи к слайдам:
Кристаллы в природе и жизни людей. Работу выполнил: Ученик 6б класса Ибрагимов Шамиль МБОУ СОШ мкр. Вынгапуровский. Руководитель: учитель географии Ускова Юлия Владимировна.
Актуальность: Данная тема является актуальной в связи с тем, что выращивание кристаллов очень интересное и увлекательное занятие. Я очень люблю узнавать все новое и интересное, мне нравится экспериментировать, наблюдать и собирать коллекции. У меня есть своя небольшая коллекция разных камней, которые, оказывается, тоже являются кристаллами. Мне стало интересно узнать, можно ли вырастить кристаллы в домашних условиях. Гипотеза: я предполагаю, что в домашних условиях действительно можно вырастить некоторые виды кристаллов.
цель проекта –узнать, что такое кристаллы, откуда они возникают, их значимость для человека.
Задачи проекта: 1. Изучить литературу о кристаллах и их фотографии; 2. Изучить природу кристаллов; 3. Узнать, какое значение имеют кристаллы в жизни человека; 4. Попытаться вырастить кристалл в домашних условиях, если это возможно.
Виды кристаллов Идеальный. Абсолютно симметричный с идеализированно ровными гладкими гранями Реальный. Имеющий различные дефекты внутренней структуры решетки, искажения и неровности на гранях, пониженную симметрию вследствие специфики условий роста, неоднородности питающей среды, повреждений и деформаций.
Кристаллы по происхождению Естественные: выросшие в природе без участия человека Искусственные: выращенные человеком в специальных условиях
Кристаллы в природе. По размерам природные кристаллы могут быть самыми разными: от микроскопических до весьма крупных вплоть до нескольких метров длиной и в поперечном сечении. Внешний облик кристаллов зависит от того, насколько спокойно происходил их рост. Большинство кристаллов в природе растут медленно - тысячи и миллионы лет. Некоторые кристаллы растут очень быстро, например, кристаллы растворимых солей (сера, таблички гематита) в кратерах действующих вулканов.
Кристаллы в жизни людей. Применения кристаллов в науке и технике так многочисленны и разнообразны, что их трудно перечислить. Поэтому ограничусь несколькими примерами. Например, каменная соль давно и навечно вошла в жизнь человека. Мы называем ее в быту просто солью, в технике - поваренной, или пищевой, солью. Ни с чем несравнимый вкус соли человек оценил давно. В древности страны, куда ее завозили, платили цену, равную золоту: за килограмм соли – килограмм золотого песка.
Самый твердый и самый редкий из природных минералов - алмаз. Сегодня алмаз в первую очередь камень-работник, а не камень-украшение. Благодаря своей исключительной твердости алмаз играет громадную роль в технике. Алмазными пилами распиливают камни.
Выращиваем кристалл в домашних условиях. Чтобы вырастить кристалл из соли мне потребуется: Соль; Вода (дистиллированная или обычная кипяченая); Стеклянная банка; Столовая ложка; Нитка; Деревянная палочка.
А кто не любовался снежинками, разнообразие которых поистине бесконечно! Еще в 17 в. знаменитый астроном Иоганн Кеплер написал трактат О шестиугольных снежинках, а спустя три столетия были изданы альбомы, в которых представлены коллекции увеличенных фотографий тысяч снежинок, причем ни одна из них не повторяет другую.
Ярой альпийской зимой лед превращается в камень.
Солнце не в силах затем камень такой растопить.
Аналогичный вывод сделали в древности в Китае и Японии – лед и горный хрусталь обозначали там одним и тем же словом. И даже в 19 в. поэты нередко соединяли воедино эти образы:
Едва прозрачный лед, над озером тускнея,
Кристаллом покрывал недвижные струи.
А.С.Пушкин. К Овидию
Особое место среди кристаллов занимают драгоценные камни, которые с древнейших времен привлекают внимание человека. Люди научились получать искусственно очень многие драгоценные камни. Например, подшипники для часов и других точных приборов уже давно делают из искусственных рубинов. Получают искусственно и прекрасные кристаллы, которые в природе вообще не существуют. Например, фианиты – их название происходит от сокращения ФИАН – Физический институт Академии наук, где они впервые были получены. Фианиты – кристаллы кубического оксида циркония ZrO2, которые внешне очень похожи на бриллианты.
Строение кристаллов.
В зависимости от строения, кристаллы делятся на ионные, ковалентные, молекулярные и металлические. Ионные кристаллы построены из чередующихся катионов и анионов, которые удерживаются в определенном порядке силами электростатического притяжения и отталкивания. Электростатические силы ненаправленные: каждый ион может удержать вокруг себя столько ионов противоположного знака, сколько помещается. Но при этом силы притяжения и отталкивания должны быть уравновешены и должна сохраняться общая электронейтральность кристалла. Все это с учетом размеров ионов приводит к различным кристаллическим структурам. Так, при взаимодействии ионов Na + (их радиус 0,1 нм) и Cl – (радиус 0,18 нм) возникает октаэдрическая координация: каждый ион удерживает около себя шесть ионов противоположного знака, расположенных по вершинам октаэдра. При этом все катионы и анионы образуют простейшую кубическую кристаллическую решетку, в которой вершины куба попеременно заняты ионами Na + и Cl – . Аналогично устроены кристаллы KCl, BaO, CaO, ряда других веществ.
Ионы Cs + (радиус 0,165 нм) по размерам близки ионам Cl – , и возникает кубическая координация: каждый ион окружен восемью ионами противоположного знака, расположенными в вершинах куба. При этом образуется объемноцентрированная кристаллическая решетка: в центре каждого куба, образованного восемью катионами, расположен один анион, и наоборот. (Интересно, что при 445° С CsCl переходит в простую кубическую решетку типа NaCl.) Более сложно устроены кристаллические решетки CaF2 (флюорита), многих других ионных соединений. В некоторых ионных кристаллах сложные многоатомные анионы могут соединяться в цепи, слои или образовывать трехмерный каркас, в полостях которого располагаются катионы. Так, например, устроены силикаты. Ионные кристаллы образуют большинство солей неорганических и органических кислот, оксиды, гидроксиды, соли. В ионных кристаллах связи между ионами прочные, поэтому такие кристаллы имеют высокие температуры плавления (801° С для NaCl, 2627° С для СаО).
В ковалентных кристаллах (их еще называют атомными) в узлах кристаллической решетки находятся атомы, одинаковые или разные, которые связаны ковалентными связями. Эти связи прочные и направлены под определенными углами. Типичным примером является алмаз; в его кристалле каждый атом углерода связан с четырьмя другими атомами, находящимися в вершинах тетраэдра. Ковалентные кристаллы образуют бор, кремний, германий, мышьяк, ZnS, SiO2, ReO3, TiO2, CuNCS. Поскольку между полярной ковалентной и ионной связью нет резкой границы, то же справедливо и для ионных и ковалентных кристаллов. Так, заряд на атоме алюминия в Al2O3 равен не +3, а лишь +0,4, что свидетельствует о большом вкладе ковалентной структуры. В то же время в алюминате кобальта CoAl2O4 заряд на атомах алюминия увеличивается до +2,8, что означает преобладание ионных сил. Ковалентные кристаллы, как правило, твердые и тугоплавкие.
Молекулярные кристаллы построены из изолированных молекул, между которыми действуют сравнительно слабые силы притяжения. В результате такие кристаллы имеют намного меньшие температуры плавления и кипения, твердость их низка. Так, кристаллы благородных газов (они построены из изолированных атомов) плавятся уже при очень низких температурах. Из неорганических соединений молекулярные кристаллы образуют многие неметаллы (благородные газы, водород, азот, белый фосфор, кислород, сера, галогены), соединения, молекулы которых образованы только ковалентными связями (H2O, HCl, NH3, CO2 и др.). Этот тип кристаллов характерен также почти для всех органических соединений. Прочность молекулярных кристаллов зависит от размеров и сложности молекул. Так, кристаллы гелия (радиус атома 0,12 нм) плавятся при –271,4°С (под давлением 30 атм), а ксенона (радиус 0,22 нм) – при –111,8° С; кристаллы фтора плавятся при –219,6° С, а иода – при +113,6° С; метана СН4 – при –182,5° С, а триаконтана С30Н62 – при +65,8° С.
Все кристаллические соединения можно разделить на моно- и поликристаллические. Монокристалл представляет собой монолит с единой ненарушенной кристаллической решеткой. Природные монокристаллы больших размеров встречаются очень редко. Большинство кристаллических тел являются поликристаллическими, то есть состоят из множества мелких кристалликов, иногда видных только при сильном увеличении.
Рост кристаллов.
Многие видные ученые, внесшие большой вклад в развитие химии, минералогии, других наук, начинали свои первые опыты именно с выращивания кристаллов. Помимо чисто внешних эффектов, эти опыты заставляют задумываться на тем, как устроены кристаллы и как они образуются, почему разные вещества дают кристаллы разной формы, а некоторые вовсе не образуют кристаллов, что надо сделать, чтобы кристаллы получились большими и красивыми.
Вот простая модель, поясняющая суть кристаллизации. Представим, что в большом зале укладывают паркет. Легче всего работать с плитками квадратной формы – как ни поверни такую плитку, она все равно подойдет к своему месту, и работа пойдет быстро. Именно поэтому легко кристаллизуются соединения, состоящие из атомов (металлы, благородные газы) или небольших симметричных молекул. Такие соединения, как правило, не образуют некристаллических (аморфных) веществ.
Труднее выложить паркет из прямоугольных дощечек, особенно если у них с боков имеются пазы и выступы – тогда каждую дощечку можно уложить на свое место одним единственным способом. Особенно трудно выложить паркетный узор из дощечек сложной формы.
Способы выращивания кристаллов.
Кристаллизацию можно вести разными способами. Один из них – охлаждение насыщенного горячего раствора. При каждой температуре в данном количестве растворителя (например, в воде) может раствориться не более определенного количества вещества. Например, в 100 г воды при 90° С может раствориться 200 г алюмокалиевых квасцов. Такой раствор называется насыщенным. Будем теперь охлаждать раствор. С понижением температуры растворимость большинства веществ уменьшается. Так, при 80° С в 100 г воды можно растворить уже не более 130 г квасцов. Куда же денутся остальные 70 г? Если охлаждение вести быстро, избыток вещество просто выпадет в осадок. Если этот осадок высушить и рассмотреть в сильную лупу, то можно увидеть множество мелких кристалликов.
Охладив насыщенный при 90° С раствор квасцов до комнатной температуры, мы получим в осадке уже 190 г, потому что при 20° С в 100 г воды растворяется только 10 г квасцов. Получится ли при этом один большой кристалл правильной формы массой 190 г? К сожалению, нет: даже в очень чистом растворе вряд ли начнет расти один-единственный кристалл: масса кристалликов может образоваться на поверхности остывающего раствора, где температура немного ниже, чем в объеме, а также на стенках и дне сосуда.
Метод выращивания кристаллов путем постепенного охлаждения насыщенного раствора неприменим к веществам, растворимость которых мало зависит от температуры. К таким веществам относятся, например, хлориды натрия и алюминия, ацетат кальция.
Третий способ – выращивание кристаллов из расплавленных веществ при медленном охлаждении жидкости. При использовании всех способов наилучшие результаты получаются, если используется затравка – небольшой кристалл правильной формы, который помещают в раствор или расплав. Таким способом получают, например, кристаллы рубина. Выращивание кристаллов драгоценных камней проводят очень медленно, иногда годами. Если же ускорить кристаллизацию, то вместо одного кристалла получится масса мелких.
Кристаллы могут также расти при конденсации паров – так получаются снежинки и узоры на холодном стекле. При вытеснении металлов из растворов их солей с помощью более активных металлов также образуются кристаллы. Например, если в раствор медного купороса опустить железный гвоздь, он покроется красным слоем меди. Но образовавшиеся кристаллы меди настолько мелкие, что их можно разглядеть только под микроскопом. На поверхности гвоздя медь выделяется очень быстро, поэтому и кристаллы ее слишком мелкие. Но если процесс замедлить, кристаллы получатся большими. Для этого медный купорос надо засыпать толстым слоем поваренной соли, положить на него кружок фильтровальной бумаги, а сверху – железную пластинку диаметром чуть поменьше. Осталось налить в сосуд насыщенный раствор поваренной соли. Медный купорос начнет медленно растворяться в рассоле (растворимость в нем меньше, чем в чистой воде). Ионы меди (в виде комплексных анионов CuCl4 2– зеленого цвета) будут очень медленно, в течение многих дней, диффундировать вверх; за процессом можно наблюдать по движению окрашенной границы.
Достигнув железной пластинки, ионы меди восстанавливаются до нейтральных атомов. Но так как процесс этот происходит очень медленно, атомы меди выстраиваются в красивые блестящие кристаллы металлической меди. Иногда эти кристаллы образуют разветвления – дендриты. Меняя условия опыта (температура, размер кристаллов купороса, толщина слоя соли и т.п.), можно менять условия кристаллизации меди.
Переохлажденные растворы.
Если пробирку с переохлажденным раствором тиосульфата поставить в ледяную воду, кристаллы будут расти медленнее, а сами будут крупнее. Кристаллизация пересыщенного раствора сопровождается его нагреванием – это выделяется тепловая энергия, полученная кристаллогидратом при его плавлении.
Кристаллы широко применяются в науке и технике: полупроводники, призмы и линзы для оптических приборов, твердотельные лазеры, пьезоэлектрики, сегнетоэлектрики, оптические и электрооптические кристаллы, ферромагнетики и ферриты, монокристаллы металлов высокой чистоты.
Рентгеноструктурные исследования кристаллов позволили установить строение многих молекул, в том числе и биологически активных – белков, нуклеиновых кислот.
Ограненные кристаллы драгоценных камней, в том числе выращенных искусственно, используются как украшения.
Илья Леенсон

Твердые тела разделяют на аморфные тела и кристаллы. Отличие вторых от первых состоит в том, что атомы кристаллов располагаются согласно некоторому закону, образуя тем самым трехмерную периодическую укладку, что называется – кристаллическая решетка.
Этимология

Кристаллическая структура и решетка
Идеальный кристалл представляется в виде периодически повторяющихся одинаковых структур – так называемых элементарных ячеек кристалла. В общем случае, форма такой ячейки – косоугольный параллелепипед.
Следует различать такие понятия как кристаллическая решетка и кристаллическая структура. Первая – это математическая абстракция, изображающая регулярное расположение неких точек в пространстве. В то время как кристаллическая структура – это реальный физический объект, кристалл, в котором с каждой точкой кристаллической решетки связана определенная группа атомов или молекул.

Кристаллическая структура граната — ромб и додекаэдр
Основным фактором, определяющим электромагнитные и механические свойства кристалла, является строение элементарной ячейки и атомов (молекул), связанных с ней.
Анизотропия кристаллов
Главное свойство кристаллов, отличающее их от аморфных тел – это анизотропия. Это означает, что свойства кристалла различны, в зависимости от направления. Так, например, неупругая (необратимая) деформация осуществляется лишь по определенным плоскостям кристалла, и в определенном направлении. В связи с анизотропией кристаллы по-разному реагируют на деформацию в зависимости от ее направления.
Однако, существуют кристаллы, которые не обладают анизотропией.
Виды кристаллов

Сравнение структур монокристаллов и поликристаллов
Кристаллы разделяют на монокристаллы и поликристаллы. Монокристаллами называют вещества, кристаллическая структура которых распространяется на все тело. Такие тела являются однородными и имеют непрерывную кристаллическую решетку. Обычно, такой кристалл обладает ярко выраженной огранкой. Примерами природного монокристалла являются монокристаллы каменной соли, алмаза и топаза, а также кварца.

Сульфат алюминия-калия монокристалл
Немало веществ имеют кристаллическую структуру, хотя обычно не имеют характерной для кристаллов формы. К таким веществам относятся, например, металлы. Исследования показывают, что такие вещества состоят из большого количества очень маленьких монокристаллов — кристаллических зерен или кристаллитов. Вещество, состоящее из множества таких разноориентированных монокристаллов, называется поликристаллическим. Поликристаллы зачастую не имеют огранки, а их свойства зависят от среднего размера кристаллических зерен, их взаимного расположения, а также строения межзеренных границу. К поликристаллам относятся такие вещества как металлы и сплавы, керамики и минералы, а также другие.

Возможные способы роста и образования
- Кристаллизация путем возгонки. Подобный метод кристаллизации подразумевает переход вещества из газообразного состояния к твердому, минуя жидкую фазу. Подобный процесс в природе имеет место в вулканических трещинах или кратерах, когда вещество быстро остывает. Однако простейший пример – образование зимой снежинок из воды.

Кристалл воды — снежинка
- Первый – переход вещества из аморфного твердого тела в кристаллическое. Так, например, происходит кристаллизация стекла, в том числе кристаллизация вулканических пород, содержащих стекло.
- Второй – перекристаллизация вещества с разрушением старой структуры и образованием новой. Большинство горных пород образуются именно таким способом. Известные примеры перекристаллизации: переход известняка в мрамор, кварцевых песчаников в кварциты или глинистых пород в филлиты.

Монокристалл рубина (корунд)
Другие факты
- Имеет место такое явление как прорастание кристаллов. Это означает процесс, когда индивиды взаимно пересекаются и прорастают друг друга.
- Существуют так называемые ионные кристаллы, которые состоят в основном из ионов, связь которых образуется за счет электростатического притяжения. К таким телам относят фторид калия и натрия, хлорид и бромид калия и др.
- Существует 47 простых форм, из которых может состоять кристалл. Среди них: призма, пирамида, тетраедр, трапецоедр, ромбоедр и т.п.

Читайте также:

