Эндокринная часть поджелудочной железы гистология доклад
Обновлено: 18.05.2024
Основные органо-генетические процессы, связанные с закладкой органов и дифференцировкой тканей, происходят в первом триместре внутриутробного развития. Некоторые исследователи считают, что поджелудочная железа развивается из трех зачатков: одного дорсального и двух вентральных. Другие авторы отмечают, что этот орган образуется из двух зачатков: дорсального и вентрального. На 3 неделе развития из энтодермы дорсальной стенки двенадцатиперстной кишки развивается дорсальный зачаток. Вентральный зачаток формируется на 4 неделе и растет в каудальном направлении. Эндокринные клетки в поджелудочной железе появляются в 5–6 недель развития, первые ацинусы появляются на 8–9 неделе развития. Островки обособляются на 10–12 неделе эмбрионального развития. У плодов 13 недель наблюдается процесс образования выводных протоков, формируются дольки. В 20 недель экзокринный отдел железы представляет собой развитую часть органа, в которой есть все условия для выполнения специфической секреторной функции. У новорожденных основные морфологические структуры поджелудочной железы сформированы. Эндокринный аппарат поджелудочной железы новорожденного хорошо развит. Особенностями развития поджелудочной железы в раннем постнатальном онтогенезе является относительная незрелость экзокринной части после рождения и мощное раннее развитие функционирующего эндокринного аппарата.

1. Афферентная иннервация стромы поджелудочной железы плодов человека и новорождённых / С.А. Лапутьев // Функциональная морфология человека и животных. – Симферополь, 1979. – С. 73–74.
3. Бархина Т.Г. Ультраскопические аспекты становления клеток пищеварительной системы в эмбриогенезе человека: докл. Конгр. Ассоц. морфологов, Тюмень, 1994 // Морфология. – 1993. – 105, № 9–10. – 46 с.
4. Башкин А.Д. Сенситивные периоды развития поджелудочной железы человека в пренатальном и раннем постнатальном онтогенезе // Влияние антропог. факторов на морфогенез и структур, преобраз. органов: материалы Всерос. конференции. Всерос. науч. общ-во анатомов, гистологов, эмбриологов. – Астрахань, 1991. – С. 11–12.
5. Бобрик И.И., Шевченко Е.А., Черкасов В.Г.. Закономерности дифференцировки и специализации эндотелия микрососудов функционально различных органов человека в пренатальном периоде онтогенеза // Морфология. – 1992. – Т. 102, В.2. – С. 107–115.
6. Бойко Ю.Г., Прокопчик Н.И. Возрастная морфометрическая характеристика поджелудочной железы человека // Архив анатомии, гистологии и эмбриологии. – 1987. – Т. ХСIII, № 12. – С. 79–81.
7. Волкова О.В., Пекарский М.И. Эмбриогенез и возрастная гистология внутренних органов человека. – М.: Медицина, 1976. – С. 166–192.
8. Гвоздухин А.П. Морфологические и цитохимические особенности дифференцировки соединительнотканной стромы поджелудочной железы человека в эмбриогенезе // Функциональная анатомия человека и животных. – 1979. – Т.78. – С. 63–65.
10. Глущенко Илья Леонидович. Морфометрическая характеристика поджелудочной железы человека в эмбриогенезе: автореф. дис. . канд. мед. наук. – Тюмень, 2004. – С. 3–17.
11. Гречко O.A. Морфология сосудистого русла инкреторного отдела поджелудочной железы плода человека // Закономерности морфогенеза и регенерации в норме, патологии и индивидуальном развитии. – Свердловск, 1978. – С. 150.
12. Грищенко В.И., Яковцева А.Ф. Крупный плод / В.И. Грищенко, А.Ф. Яковцева. – Киев: Здоровья, 1991. – С. 3–124.
13. Давиденко Л.М. Морфогенез поджелудочной железы человека в пренатальном периоде // Морфология. – 1993. – Т. 105, Вып. 9–10. – С. 69–70.
14. Давиденко Л.М. Последовательность дифференцировки эндокриноцитов поджелудочной железы человека в пренатальном периоде развития // Морфология. – 1996. – 109, № 2. – 47 с.
15. Каган И.И., Железнов Л.М. Поджелудочная железа: микрохирургическая и компьютерно-томографическая анатомия. – М.: Медицина, 2004. – 152 с.
16. Калигин М.С. Клетки-мишени фактора стволовых клеток во внутренних органах человека в ходе онтогенеза: автореф. дис. … канд мед. наук. – Казань, 2009.
18. Козырь Н.Н. Количественное распределение инсулярной ткани в поджелудочной железе плодов человека // Материалы 9-й научной конференции по возрастной морфологии, физиологии и биохимии. – М., 1969. – Т.1. – С. 214–215.
19. Молдавская А.А., Савищев А.В. Современные тенденции в изучении морфологии поджелудочной железы в эмбриогенезе // Фундаментальные исследования. – 2011. – № 5. – С. 211–217.
20. Пузырев А.А., Иванова В.Ф., Костюкевич С.В. Эндокринная гастроэнтеропанкреатическая система человека при патологии // Морфология. – 1996. – Т. 109, Вып. 2. – С. 82.
21. Савищев А.В. Морфогенез и функциональная анатомия поджелудочной железы в пренатальном онтогенезе человека и при экспериментальном моделировании: автореф. дис. … д-ра мед. наук. – М., 2009. – 26 с.
22. Сайфулин М.Х. Васкуляризация поджелудочной железы: варианты строения ангиоархитектоники в плодном периоде гестации // Биомедицинские и биосоциальные проблемы интегративной антропологии. – СПб.: СПбГМУ, 1998. – Вып. 2. – С. 201–204.
23. Ставрова Н.П. развитие нервных и паренхиматозных компонентов поджелудочной железы человека в эмбриогенезе: автореф. дис. … канд. мед. наук. – Ставрополь, 1972. – 20 с.
25. Цитологические аспекты морфофункциональных взаимодействий экзокринных клеток поджелудочной железы в процессе постнатального роста / Б.А. Хидоятов, Н.Ш. Шарафитдинходжаев, З.В. Маликов, Д.Х. Рахманова; под ред. Д.Х. Хамидова. – Ташкент: ФАН, 1983. – С. 188–190.
26. Шадрина Н.С. К анатомии артериального русла поджелудочной железы: автореф. дис. . канд. мед. наук. – Горький, 1961. – 15 с.
27. Шевчук И.А., Мардарь А.И. Развитие поджелудочной железы человека в эмбриональном периоде // Функциональная морфология эмбрионального развития человека и млекопитающих: Труды П МГМИ. Серия – гистология. – М., 1981. – CXIV, № 2. – С. 157–159.
28. Шмидт Г.А. Некоторые новые вопросы периодизации индивидуального развития человека // Материалы VI науч. конф. по вопросам возрастной морфологии, физиологии, биохимии. – М., 1963. – С. 241–243.
29. Beta cell proliferation and growth factors / J.H. Nielsen, C. Svensson, E.D. Galsgaard et all. // J. Molecular Medicine. – 1999. – 77, № 1. – Р. 62–66.
30. Bocian-Sobkowska J., Zabel M., Wozniak W. Polygormonal aspect of the endocrine cells of the human fetal pancreas // Histochem-Cell-Biol. – 1999. – Aug. 112 (2). – Р. 147–153.
31. Bock P. Development of pancreas / P. Bock, M. Abdel-Moneim, M. Egerbacher // Microsc. Res. and Techn. – 1997. – 37, № 5–6. – pp. 374–383.
32. Detection of proinsulin, C-peptide, insulin-A-chain, and Glicentin in pancreatic islet cells of early human fetogenesis / H.H. Dorsche, K. Fait, O. Mad- sen, et al. //Acta histochem. – 1991. – № 91, no. 1. – Р. 39–42.
33. Developmental gene expression and immunogistochemikal study of the human endocrine pancreas during fetal life / D.Sanches, C.Moriscot, S.Marchand // Horm-Res. – 1998. – 50 (5). – Р. 258–263.
34. Endocrine cells in intraductal papillaiy-mucinous neoplasms of the pancreas. A histochemical and immunohistohemical study / T. Terada, T. Ohta, Y. Kitamura, et al. // J. Virchows Archiv. – 1997. – 431, № 1. – Р. 31–36.
35. Herrera P.L., Huarte J., Zufferey R. Ablation of islet endocrine cells by targeted expression of hormone-promoter-driven toxigenes // Proc. Natl. Acad. Sci. – USA, 1994. – v. 91. – Р. 12999–13003.
36. Larsson L.I. On the development of the islets of Langergans // Microsc-Res-Tech. – 1998. – Nov. 15, 43 (4). – Р. 284–291.
37. Miralles F., Czernichow P., Scharfmann R. Follistatin regulates the relative proportions of endocrine ver¬sus exocrine tissue during pancreatic development //J. Development. – 1998. – 125, № 6. – Р. 52–59.
38. Nishimori I., Kamakura M., Fujikawa-Adachi K. Cholecystokinin A and B receptor m RNA expression in human pancreas // Pancreas. – 1999. – Aug. 19(2). – Р. 109–113.
39. Pancreatic development and maturation of the islet P-cell studies of pluri potent islet cultures / Ole D. Madsen, J. Jensen, N. Blum, et al. //Eur. J. Bio- chem. – 1996. – 242, № 3. – Р. 435–445.
40. Sander M., German S. The cell transcription factors and development of the pancreas // J. Molecular Medicine. – 1997. – 75, № 5. – Р. 327–340.
Основные органо-генетические процессы, связанные с закладкой органов и дифференцировкой тканей, происходят в первом триместре внутриутробного развития [8, 24, 28]. Этот период считается определяющим для последующего формирования и дифференцировки органов и систем человеческого организма не только во внутриутробном развитии, но и в постнатальном онтогенезе. Относительно закладки поджелудочной железы у человека нет единой точки зрения. Одни исследователи считают, что она развивается из трех зачатков: одного дорсального и двух вентральных [7, 17]. Другие отмечают, что этот орган образуется из двух зачатков: дорсального и вентрального [39, 40].
На 3-й неделе развития из энтодермы дорсальной стенки двенадцатиперстной кишки в гепатопанкреатической зоне развивается дорсальный зачаток. Вентральный зачаток формируется на 4-й неделе, в углу, образованном стенкой кишки и зачатком печени, и растет в каудальном направлении. При появлении двух вентральных зачатков возможно формирование кольцевидной поджелудочной железы [7].
В результате вращения первичной кишки и неравномерности роста кишечной стенки зачатки поджелудочной железы у эмбриона длиной 8 мм сближаются. Слияние зачатков и образование единого органа происходит у эмбриона длиной 12–16 мм [7, 24]. Проток поджелудочной железы (Вирсунгов) формируется в результате анастомоза дистальной части дорсального протока с протоком вентральной закладки, образование добавочного протока поджелудочной железы происходит из вентрального зачатка. После слияния закладок железы происходит обособление ее капсулы. Передняя часть головки, тело и хвост дефинитивной поджелудочной железы формируются из дорсального отдела, а задняя часть головки и крючковидный отросток из вентрального отдела закладки железы.
Интерес представляет развитие сложной гистологической структуры поджелудочной железы. На ранних этапах развития экзокринная часть поджелудочной железы формируется в тесном единстве с элементами мезенхимы [15, 37]. Основные процессы дифференцировки морфологических структур поджелудочной железы происходят в период от 5,5 до 12 недель внутриутробного развития. В 5,5 недель – образование зачатков железистых альвеол, в 6 недель – появление зачатков островков, в 6,5 недель – начало слияния вентрального и дорсального отделов железы, в 9 недель – формирование долек железы, в 10,5 недель – формирование крючковидного отростка железы [10]. В 7–8 недель характерной особенностью тканей фетальной железы являются секреторные гранулы, появляющиеся по периферии скопления эпителиальных клеток, что свидетельствует о начале дифференцировки поджелудочной железы на экзокринный и эндокринный отделы [21].
В начале 7 недели в закладку железы врастают нервные волокна [1, 4, 13, 14, 23], в 12 недель она богато снабжена нервами [23, 27]. В начале 3 месяца развития в междольковой соединительной ткани и между закладками железы волокна образуют довольно выраженные пучки, формируется каркас органа [8]. В начале четвертого месяца внутриутробного развития происходит коллагенизация волокнистых структур соединительной ткани, а в междольковой соединительной ткани и по ходу кровеносных сосудов образование коллагеновых волокон не происходит.
У плодов 13 недель наблюдается процесс массового образования выводных протоков, а в отдельных участках железистые структуры образуют дольки. Увеличивается количество островков Лангерганса, которые имеют различную величину: часть из них локализована обособленно, а часть еще полностью не отделена от стенки выводных протоков. Между эндокринными клетками внутри островков располагаются синусоидные кровеносные капилляры. В островковых клетках поджелудочной железы плодов человека 10–14 недель В-клетки выполняют свою биологическую функцию. В течение плодного периода у человека определяются две совокупности эндокринных клеток, одна из которых составляет островки Лангерганса, а другая – свободно рассредоточенные клетки, расположенные в стенках протоков железы. Свободные клетки полигормональны и содержат инсулин, глюкагон, соматостатин и панкреатический полипептид [32]. Некоторые авторы в своих исследованиях указывают на асинхронность появления гормонов и ферментов в развивающейся поджелудочной железе плода человека [31, 34]. В развитии островков было выявлено несколько стадий:
1) выборочная полигормональная в 9–10 недель;
2) повсеместная полигормональная в 11–15 недель;
3) моногормональная по инсулину очаговую стадию в островках 16–29 недель с зонулярными или плащевидной формы островками;
4) полиморфная островковая стадия после 30 недель, характеризующаяся наличием клеток, образующих глюкагон или соматостатин. В последнюю стадию в ткани железы обнаруживаются так называемые биполярные островки [30].
С пяти месяцев внутриутробного развития происходит активизация процессов морфофункционального становления внешнесекреторной паренхимы органа. Параллельно этому происходит оформление внутриорганных выводных протоков, дифференцировка их эпителия. В этот период наблюдается большое количество островков. В середине пятого месяца экзокринный отдел железы представляет собой развитую часть органа, в которой есть все условия для выполнения специфической секреторной функции [8]. При компьютерной трехмерной реконструкции срезов поджелудочной железы у плодов 24 недель гестации установлено наличие контактов клеток формирующихся островков с протоками железы [41].
В 24–25 недель отмечается довольно четкая дифференцировка на дольки, увеличивается количество ацинусов, возрастает число концевых отделов. Наряду со зрелыми ацинусами в составе долек железы встречаются малодифференцированные концевые элементы. Возникновение и становление ацинусов в поджелудочной железе происходит не одновременно и продолжается весь внутриутробный период [9, 12]. В период с 22 до 28 недель в дольках железы преобладают зрелые ацинусы, в которых имеются все признаки секреторного процесса. Вокруг ацинусов сформирована околоацинозная соединительная ткань. В капсуле, междолевых, междольковых прослойках происходит коллагенизация аргирофильных волокон, появляется значительное количество фиброцитов. Сосудистая система фетальной железы считается сформированной к 7 месяцу развития [11, 22, 25, 26]. В этот период в поджелудочной железе плодов содержится наибольшее количество инсулярной ткани на 1 мм2 [18]. Наиболее многочисленными у плода человека до 7 месяцев развития являются А-клетки, которые образуют глюкагон и выводят его. В период эмбриогенеза глюкагон является специфическим стимулятором секреции инсулина и выступает как местный индуктор цитодифференцировки В-клеток. Дифференцировка А- и В-эндокриноцитов характеризуется асинхронностью [5, 6].
В конце позднефетального периода на экспериментальном материале выявлены ацинарно-островковые клетки, расположенные между экзокринным и эндокринным отделами железы [3,9]. Большинство морфологов придерживаются мнения о том, что эти клетки образуются в процессе трансформации, которой обладает паренхима поджелудочной железы [21]. В возрасте 33–40 недель гестации поджелудочная железа имеет выраженное дольчатое строение. В дольках преобладают зрелые ацинусы, вокруг которых сформирована околоацинозная соединительная ткань.
Становление паренхимы железы продолжается и после рождения, что связано с изменениями условий функционирования железы, совершенствованием нейрогуморальных механизмов регуляции. Поджелудочная железа новорожденного отличается хорошо развитой междольковой соединительной тканью, богатой лимфогистиоцитарными элементами и фибробластами [1, 19, 20, 25]. На периферии долек, особенно в субкапсулярной зоне, продолжается активное новообразование островков Лангерганса, постепенно вытесняющих вместе с ацинусами нежноволокнистую соединительную ткань. Они отличаются различной величиной и формой, часть из них локализована обособленно, а некоторые из них еще полностью не отделены от стенки выводных протоков. Между эндокриноцитами внутри островков располагаются синусоидные кровеносные капилляры. Паренхима островков представлена дифференцированными В-клетками, цитоплазма которых заполнена секреторными гранулами, а также дифференцирующимися клетками, не содержащими секреторных гранул. В этот период большинство островков теряют непосредственный контакт с протоковой частью и распределяются дисперсно [21]. В поджелудочной железе новорожденного Д-клеток в 20 раз больше, чем у взрослых [2]. Механизмы высвобождения инсулина поджелудочной железой плода становятся полноценными в конце беременности или сразу после родов. Содержание инсулина в сыворотке крови плода человека повышено, но очень быстро падает после перевязки пуповины и поступления к плоду пищевых веществ. Полный ответ А-клеток на воздействие стимуляторов секреции глюкагона или угнетение его секреции инсулином и глюкозой наблюдается в конце беременности либо после рождения ребенка. Считается, что эти эндокринные изменения обусловлены активацией А-адренэргической системы новорожденного с одновременным снижением чувствительности В-клеток к инсулиногенным стимулам, а также повышение чувствительности А-клеток к аминокислотам или стимуляцией А-клеток глюкозой [2]. Только к 2 годам гистологическое строение поджелудочной железы начинает приближаться к таковому у взрослых. В-клеточная популяция и соотношение с другими типами клеток панкреатических островков устанавливается до 5 лет возраста [33]. Таким образом особенностью развития поджелудочной железы в раннем постнатальном онтогенезе является относительная незрелость экзокринной части и мощное раннее развитие функционирующего эндокринного аппарата.
Рецензенты:
Мартынова Н.А., д.м.н., профессор, заведующая кафедрой оперативной хирургии и топографической анатомии, ГБОУ ВПО СГМУ Минздрава России, г. Архангельск;
Болдуев В.А., д.м.н., доцент кафедры гистологии, цитологии и эмбриологии ГБОУ ВПО СГМУ Минздрава России, г. Архангельск.
Островки состоят из эпителиальных клеток — панкреатических эндокриноцитов, или инсулоцитов. Величина островков, их форма и число входящих в состав клеток очень различны. Общее количество островков в поджелудочной железе достигает 1-2 млн. Средний размер островка 0,1-0,3 мм. Общий объем эндокринной части составляет около 3% всего объема железы. Островки пронизаны кровеносными капиллярами, окруженными перикапиллярным пространством. Эндотелий капилляров имеет фенестры, облегчающие поступление гормонов от инсулоцитов в кровь через перикапиллярное пространство.
В островковом эпителии различают 5 видов клеток: А-клетки, В-клетки, D-клетки, ВИП-клетки, РР-клетки.
А-клетки (альфа-клетки, или ацидофильные инсулоциты) — это крупные округлые клетки с бледным крупным ядром и цитоплазмой, содержащей ацидофильные гранулы. Гранулы обладают и аргирофилией. В состав этих гранул входит гормон глюкагон, расщепляющий гликоген и повышающий содержание сахара в крови.
А-клетки рассеяны по всему островку, образуя нередко небольшие скопления в центральной части. Они составляют около 20-25% от всех инсулоцитов.
В-клетки (бета-клетки, или базофильные инсулоциты) имеют кубическую или призматическую форму, крупное темное, богатое гетерохроматином ядро. Доля В-клеток достигает 70-75% от общего числа инсулоцитов. В цитоплазме В-клеток накапливаются осмиофильные гранулы, содержащие гормон инсулин. Инсулин регулирует синтез гликогена из глюкозы. При недостатке продукции инсулина глюкоза не превращается в гликоген, содержание ее в крови повышается и создаются условия для развития заболевания, называемого сахарным диабетом.
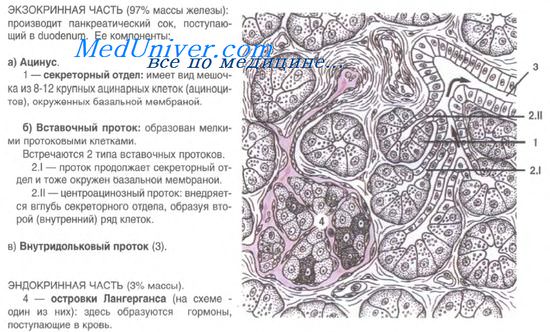
D-клетки (дельта-клетки, или дендритические инсулоциты) составляют 5-10% среди всех островковых клеток. Форма их иногда звездчатая с отростками. В цитоплазме определяются гранулы средних размеров и плотности. В гранулах накапливается гормон соматостатин. Он тормозит секрецию инсулина и глюкагона, снижает продукцию ряда гормонов желудочно-кишечного тракта — гастрина, секретина, энтероглюкагона, холецистокинина и др., подавляет секрецию соматотропного гормона в гипофизе.
ВИП-клетки (аргирофильные клетки) встречаются в островках в небольшом количестве. В цитоплазме выявляются плотные аргирофильные гранулы, содержащие вазоактиеный интестиналъный полипептид. Он обладает выраженным сосудорасширяющим дейтвием, снижает кровяное давление, угнетает секрецию соляной кислоты в желудке, стимулирует выделение глюкагона и инсулина.
РР-клетки — полигональной формы инсулоциты, расположенные преимущественно по периферии островка. Количество их — 2-5% от общего числа клеток островка. В цитоплазме РР-клеток выявляются мелкие гранулы, содержащие панкреатический полипептид. Основная роль панкреатического полипептида в организме — регуляция скорости и количества экзокринной секреции поджелудочной железы и желчи в печени. Таков клеточный состав островкового эпителия, представляющего собой мозаику дивергентно развивающихся клеточных дифферонов.
В дольках поджелудочной железы встречаются еще ацинозно-инсулярные клетки, в цитоплазме которых одновременно содержатся гранулы, характерные как для ацинозных, так и для островковых клеток.
Ткани поджелудочной железы иннервируют блуждающий и симпатический нервы. В интрамуральных вегетативных ганглиях находятся холинергические и пептидергические нейроны, волокна которых заканчиваются на клетках ацинусов и островков. Между нервными клетками ганглиев и островковыми клетками устанавливается тесная связь с образованием нейроинсулярных комплексов.
С возрастом в поджелудочной железе постепенно уменьшается количество островков. В островках наблюдаются закономерные возрастные изменения клеточных взаимоотношений, заключающиеся в быстрой смене после рождения преобладания А-клеток над В-клетками на преобладание В-клеток над А-клетками у взрослых. Затем происходит постепенное увеличение количества А-клеток, которое наряду с одновременным, хотя и незначительным, уменьшением числа В-клеток приводит нередко в пожилом и особенно старческом возрасте вновь к преобладанию А-клеток над В-клетками.
Регенерация поджелудочной железы. В эмбриогенезе островки растут благодаря пролиферации исходных клеток-предшественниц и их дивергентной дифференцировке в соответствующие клеточные диффероны. У взрослых физиологическая регенерация ацинозных и островковых клеток происходит в основном путем внутриклеточного обновления органелл. Митотическая активность клеток в связи с высокой специализацией низкая. После резекции части или повреждения органа наблюдается некоторое повышение уровня пролиферативной активности клеток ацинусов, протоков и островков, последующее образование новых ацинусов. Однако ведущей формой регенерации экзокринной части железы является регенерационная гипертрофия.
Восстановительные процессы в эндокринной части железы происходят за счет пролиферативной активности инсулоцитов и клеток эпителия протоков путем ацино-инсулярной трансформации.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Строение поджелудочной железы и её эндокринной части. Действие инсулина на обменные процессы в организме. Роль инсулина, глюкагона и соматостатина в гомеостазе. Сущность и клинические проявления гипергликемии и гипогликемии. Типы сахарного диабета.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 11.12.2013 |
| Размер файла | 46,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Кафедра нормальной физиологии
На тему: Эндокринная функция поджелудочной железы
Выполнил: Алексеенко Ю.О.
Преподаватель: Сукач Е.С.
2. Эндокринная часть
4. Роль инсулина, глюкагона и соматостатина в гомеостазе
5.1 Степени тяжести гипергликемии
6.3 Клинические проявления
6.4 Первая помощь и лечение
Поджелудочная железа расположена на задней стенке брюшной полости, позади желудка и простирается от двенадцатиперстной кишки до ворот селезенки. Длина ее составляет около 15 см, масса - около 100 г. В поджелудочной железе различают головку, располагающуюся в дуге двенадцатиперстной кишки, тело и хвост, достигающий ворот селезенки и лежащий ретроперитонеально. Кровоснабжение поджелудочной железы осуществляется селезеночной и верхней мезентериальной артерией. Венозная кровь поступает в селезеночную и верхнюю мезентериальную вены. Иннервируется поджелудочная железа симпатическими и парасимпатическими нервами, терминальные волокна которых контактируют с клеточной мембраной островковых клеток.
2. Эндокринная часть
Эндокринная часть поджелудочной железы образована лежащими между ацинусов панкреатическими островками, или островками Лангерганса.
Островки состоят из клеток -- инсулоцитов, среди которых на основании наличия в них различных по физико-химическим и морфологическим свойствам гранул выделяют 5 основных видов:
· бета-клетки, синтезирующие инсулин;
· альфа-клетки, продуцирующие глюкагон;
· дельта-клетки, образующие соматостатин;
· D1-клетки, выделяющие ВИП (Вазоактимвный интестинамльный пептимд);
· PP-клетки, вырабатывающие панкреатический полипептид.
Островки Лангерганса, составляют около 1-3 % массы железы (от 1 до 1,5 млн.). Диаметр каждого - около 150 мкм. В одном островке содержится от 80 до 200 клеток. В-клетки локализуются в центре островка, а остальные - по его периферии. Основную массу - 60 % клеток - составляют В-клетки, 25 % - А-клетки, 10 % - D-клетки, остальные - 5 % массы.
Он образуется в В-клетках из его предшественника - проинсулина, который синтезируется на рибосомах грубой эндоплазматической сети. Предшественником проинсулина в процессе его биосинтеза является препроинсулин. Он быстро превращается в проинсулин на полисомах.
Самый мощный стимулятор секреции инсулина - глюкоза, которая взаимодействует с рецепторами цитоплазматической мембраны. Ответ инсулина на ее воздействие является двухфазным: первая фаза - быстрая - соответствует выбросу запасов синтезированного инсулина (1-й пул), вторая - медленная - характеризует скорость его синтеза (2-й пул). Сигнал от цитоплазматического фермента - аденилатциклазы - передается на систему цАМФ, мобилизующую из митохондрий кальция, который принимает участие в освобождении инсулина. Кроме глюкозы, стимулирующим влиянием на освобождение и секрецию инсулина обладают: аминокислоты (аргинин, лейцин), глюкагон, гастрин, секретин, панкреозимин, желудочный ингибирующий полипептид, неиротензин, бомбезин, сульфаниламидные препараты, бета-адреностимуляторы, глюкокортикоиды, СТГ, АКТГ. Подавляют секрецию и освобождение инсулина: гипогликемия, соматостатин, никотиновая кислота, диазоксид, альфа-адреностимуляция, фенитоин, фенотиазины.
Инсулин в крови находится в свободном (иммунореактивный инсулин, ИРИ) и связанном с белками плазмы состоянии. Деградация инсулина происходит в печени (до 80 %), почках и жировой ткани под влиянием глютатионтрансферазы и глютатионредуктазы (в печени), инсулиназы (в почках), протеолитических ферментов (в жировой ткани). Проинсулин также подвергаются деградации в печени, но значительно медленнее.
Инсулин дает множественный эффект на инсулинзависимые ткани (печень, мышцы, жировая ткань). На почечную и нервную ткани, хрусталик, эритроциты он не оказывает непосредственного действия. Инсулин является анаболическим гормоном, усиливающим синтез углеводов, белков, нуклеиновых кислот и жира.
Действие инсулина на углеводный обмен проявляется:
1) повышением проницаемости мембран в мышцах и жировой ткани для глюкозы,
2) активацией утилизации глюкозы клетками;
3) усилением процессов фосфорилирования;
4) подавлением распада и стимуляцией синтеза гликогена;
5) угнетением глюконеогенеза;
6) активацией процессов гликолиза;
Действие инсулина на белковый обмен состоит в:
1) повышении проницаемости мембран для аминокислот;
2) усилении синтеза иРНК;
3) активации в печени синтеза аминокислот;
4) повышении синтеза и подавлении распада белков.
Основные эффекты инсулина на липидный обмен:
1) стимуляция синтеза свободных жирных кислот из глюкозы;
2) стимуляция синтеза триглицеридов;
3) подавление распада жира;
4) активация окисления кетоновых тел в печени.
Биологический эффект инсулина обусловлен его способностью связываться со специфическими рецепторами клеточной цитоплазматической мембраны. После соединения с ними сигнал через встроенный в оболочку клетки фермент - аденилатциклазу - передается на систему АМФ, которая при участии кальция и магния регулирует синтез белка и утилизацию глюкозы.
Базальная концентрация инсулина, определяемая радиоиммунологически, составляет у здоровых 15-20 мкЕД/мл. После пероральной нагрузки глюкозой (100 г) уровень его через 1 ч повышается в 5-10 раз по сравнению с исходным. Скорость секреции инсулина натощак составляет 0,5-1 ЕД/ч, а после приема пищи увеличивается до 2,5-5 ЕД/ч. Секрецию инсулина увеличивает парасимпатическая и уменьшает симпатическая стимуляция.
сахарный диабет гипергликемия гипогликемия инсулин
Он расщепляется в организме при помощи протеолитических ферментов. Секрецию глюкагона регулируют: глюкоза, аминокислоты, гастроинтестинальные гормоны и симпатическая нервная система. Ее усиливают: гипогликемия, аргинин, гастроинтестинальные гормоны, особенно панкреозимин, факторы, стимулирующие симпатическую нервную систему (физическая нагрузка и др.), уменьшение содержания в крови СЖК.
Угнетают продукцию глюкагона: соматостатин, гипергликемия, повышенный уровень СЖК в крови. Содержание глюкагона в крови повышается при декомпенсированном сахарном диабете, глюкагономе. Период полураспада глюкагона составляет 10 мин. Инактивируется он преимущественно в печени и почках путем расщепления на неактивные фрагменты под влиянием ферментов карбоксипептидазы, трипсина, хемотрипсина и др.
Основной механизм действия глюкагона характеризуется увеличением продукции глюкозы печенью путем стимуляции его распада и активации глюконеогенеза. Глюкагон связывается с рецепторами мембраны гепатоцитов и активирует фермент аденилатциклазу, которая стимулирует образование цАМФ. При этом происходит накопление активной формы фосфорилазы, участвующей в процессе глюконеогенеза. Кроме того, подавляется образование ключевых гликолитических ферментов и стимулируется выделение энзимов, участвующих в процессе глюконеогенеза. Другая глюкагонзависимая ткань - жировая. Связываясь с рецепторами адипоцитов, глюкагон способствует гидролизу триглицеридов с образованием глицерина и СЖК. Этот эффект осуществляется путем стимуляции цАМФ и активации гормоночувствительной липазы. Усиление липолизы сопровождается повышением в крови СЖК, включением их в печень и образованием кетокислот. Глюкагон стимулирует гликогенолиз в сердечной мышце, что способствует увеличению сердечного выброса, расширению артериол и уменьшению общего периферического сопротивления, уменьшает агрегацию тромбоцитов, секрецию гастрина, панкреозимина и панкреатических ферментов. Образование инсулина, соматотропного гормона, кальцитонина, катехоламинов, выделение жидкости и электролитов с мочой под влиянием глюкагона увеличиваются. Его базальный уровень в плазме крови составляет 50-70 пг/мл. После приема белковой пищи, во время голодания, при хронических заболеваниях печени, хронической почечной недостаточности, глюкагономе содержание глюкагона увеличивается.
Впервые он был обнаружен в переднем гипоталамусе, а затем - в нервных окончаниях, синаптических пузырьках, поджелудочной железе, желудочно-кишечном тракте, щитовидной железе, сетчатке. Наибольшее количество гормона образуется в переднем гипоталамусе и D-клетках поджелудочной железы. Биологическая роль соматостатина заключается в подавлении секреции соматотропного гормона, АКТГ, ТТГ, гастрина, глюкагона, инсулина, ренина, секретина, вазоактивного желудочного пептида (ВЖП), желудочного сока, панкреатических ферментов и электролитов. Он понижает абсорбцию ксилозы, сократимость желчного пузыря, кровоток внутренних органов (на 30-40 %), перистальтику кишечника, а также уменьшает освобождение ацетилхолина из нервных окончаний и электровозбудимость нервов. Период полураспада парентерально введенного соматостатина составляет 1-2 мин, что позволяет рассматривать его как гормон и нейротрансмиттер. Многие эффекты соматостатина опосредуются через его влияние на вышеперечисленные органы и ткани. Механизм же его действия на клеточном уровне пока неясен. Содержание соматостатина в плазме крови здоровых лиц составляет 10-25 пг/л и повышается у больных сахарным диабетом I типа, акромегалией и при D-клеточной опухоли поджелудочной железы (соматостатиноме).
4. Роль инсулина, глюкагона и соматостатина в гомеостазе
В энергетическом балансе организма основную роль играют инсулин и глюкагон, которые поддерживают его на определенном уровне при различных состояниях организма. Во время голодания уровень инсулина в крови понижается, а глюкагона - повышается, особенно на 3-5-й день голодания (примерно в 3-5 раз). Увеличение секреции глюкагона вызывает повышенный распад белка в мышцах и увеличивает процесс глюконеогенеза, что способствует пополнению запасов гликогена в печени. Таким образом, постоянный уровень глюкозы в крови, необходимый для функционирования мозга, эритроцитов, мозгового слоя почек, поддерживается за счет усиления глюконеогенеза, гликогенолиза, подавления утилизации глюкозы другими тканями под влиянием увеличения секреции глюкагона и уменьшения потребления глюкозы инсулинзависимыми тканями в результате снижения продукции инсулина. В течение суток мозговая ткань поглощает от 100 до 150 г глюкозы. Гиперпродукция глюкагона стимулирует липолиз, что повышает в крови уровень СЖК, которые используются сердечной и другими мышцами, печенью, почками в качестве энергетического материала. При длительном голодании источником энергии становятся и кетокислоты, образующиеся в печени. При естественном голодании (в течение ночи) или при длительных перерывах в приеме пищи (6-12 ч) энергетические потребности инсулинзависимых тканей организма поддерживаются за счет жирных кислот, образующихся во время липолиза.
После приема пищи (углеводистой) наблюдаются быстрое повышение уровня инсулина и уменьшение содержания глюкагона в крови. Первый вызывает ускорение синтеза гликогена и утилизацию глюкозы инсулинзависимыми тканями.
Белковая пища (например, 200 г мяса) стимулирует резкий подъем концентрации в крови глюкагона (на 50-100 %) и незначительный - инсулина, что способствует усилению глюконеогенеза и увеличению продукции глюкозы печенью.
Гимпергликемимя (от др.-греч. хрес -- сверху, над; глхкэт -- сладкий; б?мб -- кровь)-- клинический симптом, обозначающий увеличение содержания глюкозы в сыворотке крови по сравнению с нормой в 3,3--5,5 ммоль/л.
5.1 Степени тяжести гипергликемии
Степени тяжести гипергликемии:
· лёгкая гипергликемия -- 6,7--8,2 ммоль/л;
· средней тяжести -- 8,3--11,0 ммоль/л;
· тяжёлая -- свыше 11,1 ммоль/л;
· при показателе свыше 16,5 ммоль/л развивается прекома;
· при показателе свыше 55,5 наступает гиперосмолярная кома.
Для лиц с длительно текущими нарушениями углеводного обмена эти значения могут несколько отличаться.
Сахарный диабет.
Хроническая гипергликемия, которая персистирует независимо от состояния больного, чаще всего бывает в случае сахарного диабета, и фактически является основной характеристикой этого заболевания.
Острый эпизод гипергликемии без видимой причины может показывать на манифестацию сахарного диабета или предрасположению к нему. Эта форма гипергликемии вызвана недостаточным уровнем инсулина. Этот низкий уровень инсулина ингибирует транспорт глюкозы через клеточные мембраны, благодаря чему уровень свободного сахара в крови повышается.
Расстройства питания.
Нарушения в питании могут привести к острой недиабетической гипергликемии, например, при нервной булимии, когда человек не контролирует количество съеденной пищи и, соответственно, получает огромную калорийность за один прием пищи. Таким образом, из пищи поступает большое количество простых и сложных углеводов.
Некоторые лекарственные вещества способны увеличивать риск развития гипергликемии: в-блокаторы, тиазидные диуретики, кортикостероиды, ниацин, фентамидин, ингибиторы протеаз, L-аспарагиназа и некоторые антидепрессанты.
Биотин-авитаминоз также увеличивает риск развития гипергликемии.
Стресс.
Гипергликемия может развиваться на фоне инфекции и воспалительного процесса или стресса. Запускают этот процесс эндогенные контринсулиновые гормоны (катехоламины, глюкокортикоиды и другие). Поэтому повышение уровня глюкозы в крови не должно сразу расцениваться как сахарный диабет 2-го типа -- для начала следует исключить все другие причины (в том числе и сахарный диабет у детей, который часто манифестирует именно в подобных ситуациях).
Уровни глюкозы измеряются в миллиграммах на децилитр (мг/дл) в некоторых странах (например, США, Германия, Япония, Франция, Израиль, Египет, Колумбия); или в миллимолях на литр (ммоль/л), как в странах бывшего СССР.
В публикациях в научных журналах обычно используется ммоль/л. Коэффициент перерасчёта из ммоль/л в мг/дл равен 18. Некоторые примеры соответствия:
· 72 мг/дл = 4 ммоль/л (норма)
· 90 мг/дл = 5 ммоль/л (норма)
· 108 мг/дл = 6 ммоль/л (норма)
· 126 мг/дл = 7 ммоль/л
· 144 мг/дл = 8 ммоль/л
· 180 мг/дл = 10 ммоль/л
· 270 мг/дл = 15 ммоль/л
· 288 мг/дл = 16 ммоль/л
· 360 мг/дл = 20 ммоль/л
· 396 мг/дл = 22 ммоль/л
· 594 мг/дл = 33 ммоль/л.
Следующие признаки могут быть связаны с острой или хронической гипергликемией, первые три включены в классическую гипергликемическую триаду:
· Полидипсия -- жажда, особенно чрезмерная жажда
· Полиурия -- частое мочеиспускание
· Плохое заживление ран (порезы, царапины, и т.д.)
· Сухость или зуд кожи
· Вялотекущие инфекции, плохо поддающиеся стандартной терапии, такие как влагалищный кандидоз или наружный отит
Признаки острой гипергликемии могут включать:
· Обезвоживание из-за глюкозурии и осмотического диуреза.
В большинстве случаев лечение предусматривает введение инсулина, а также лечение основного заболевания, вызвавшего гипергликемию.
Гипогликемимя (от др.-греч. ?рь -- снизу, под + глхкэт -- сладкий + б?мб --кровь) -- патологическое состояние, характеризующееся снижением концентрации глюкозы в крови ниже 3,5 ммоль/л, периферической крови ниже нормы (3,3 ммоль/л), вследствие чего возникает гипогликемический синдром.
· нерациональное питание со злоупотреблением рафинированными углеводами, с резко выраженным дефицитом клетчатки, витаминов, минеральных солей;
· лечение сахарного диабета инсулином, пероральными сахароснижающими препаратами при передозировке;
· недостаточный или поздний прием пищи;
· необычная физическая нагрузка;
· менструация у женщин;
· критическая недостаточность органа: почечная, печеночная или сердечная недостаточность, сепсис, истощение;
· гормональная недостаточность: кортизол, гормон роста или они оба, глюкагон + адреналин;
· не р-клеточная опухоль;
· опухоль (инсулинома) или врождённые аномалии -- клеточная гиперсекреция, аутоиммунная гипогликемия, эктопическая секреция инсулина;
· гипогликемии у новорожденных и детей;
· внутривенное введение физраствора капельницей.
Механизм развития гипогликемии может значительно отличаться в зависимости от этиологии. Так, например, при употреблении этанола, наблюдается следующая картина.
Метаболизм этанола в печени катализируется алкогольдегидрогеназой. Кофактором этого фермента служит НАД -- вещество, необходимое для глюконеогенеза. Прием этанола приводит к быстрому расходованию НАД и резкому торможению глюконеогенеза в печени. Поэтому алкогольная гипогликемия возникает при истощении запасов гликогена, когда для поддержания нормогликемии особенно необходим глюконеогенез. Такая ситуация наиболее вероятна при недостаточном питании. Чаще всего алкогольная гипогликемия наблюдается у истощенных больных алкоголизмом, но бывает и у здоровых людей после эпизодических приемов большого количества алкоголя или даже небольшой дозы алкоголя, но натощак. Необходимо подчеркнуть, что алкоголь снижает концентрацию глюкозы в плазме больных с нормальной функцией печени. Особенно чувствительны к алкоголю дети.
Экзокринно-эндокринная железа расположена так, что ее стенки граничат с желудком, двенадцатиперстной кишкой, поперечно-ободочной кишкой, печенью, аортой, левой почкой, селезенкой, солнечным сплетением.
Вдоль задней поверхности поджелудочной железы к селезенке проходит селезеночная артерия и селезеночная вена (arteria et vena lienalis). Поджелудочную железу, между ее головкой и телом, пересекают верхняя артерия и брыжеечная вена (arteria et vena mesenterica superior).
Масса поджелудочной железы составляет 70-80 г, ее длина - 16-22 см, ширина 3-9 см и толщина - 2-3 см. Головка поджелудочной железы отклоняется вниз и охватывается подковой двенадцатиперстной кишки. Тело поджелудочной железы расположено поперечно, истончаясь переходит в хвост, который загибается кверху. Поджелудочная железа расположена забрюшинно.
Особенность анатомического строения поджелудочной железы заключается в том, что группы клеток (ацинарных) образуют дольки, из которых образуются большие доли с прослойками соединительной ткани между ними. В ацинарных клетках происходит синтез ферментов. На микрофотографиях срезов с использованием радиоиммуногистохимической методики видны проферменты в центре дольки, они попадают в мелкие протоки, которые отходят от каждого ацинуса, мелкие протоки собираются в большие протоки, которые под различным углом впадают в главный, вирсунгов (d.wirsungi), и добавочный (d.accessorius santorini) проток поджелудочной железы. Сеть лимфатических сосудов поджелудочной железы взаимодействует с лимфатической системой желчных протоков, желчного пузыря и двенадцатиперстной кишки.
Синтез и процессы восстановления в ацинарной клетке протекают непрерывно, а экструзия - периодически под влиянием эндогенных ритмов и достигает большой интенсивности после внешних стимулов. Функция клеток протоковой системы - это продукция жидкости, богатой бикарбонатами, важной для нейтрализации хлористоводородной кислоты в двенадцатиперстной кишке.
У человека поджелудочная железа за сутки выделяет около 1-2 л сока. Синтез жидкой части панкреатического секрета, включение в него электролитов совершается преимущественно в протоковых клетках. Транспорт воды происходит вслед за транспортом ионов в протоки. В просвет протоков вода переходит пассивно, под влиянием осмотического давления. Образуемый секрецией ацинарных клеток и клеток протоков сок поджелудочной железы является гипертоническим и обусловливает движение воды по системе протоков вплоть до их впадения в кишку. Сок, вытекающий из большого дуоденального соска в кишку, является изоосмотическим с плазмой. В основе секреции электролитов поджелудочной железой находятся метаболически зависимые транспортные процессы (активный транспорт).
Эпителий протоков содержит два активных транспортных механизма, обеспечивающих электролитный состав сока поджелудочной железы. Один из них связан с транспортом натрия, который поддерживает низкую внутриклеточную концентрацию натрия и высокую концентрацию калия. Транспорт связан с Mg-зависимой Na+ -K+ активирующей АТФ-азой. Благодаря натриевому насосу, концентрация HCO3 – во время секреции поджелудочной железы сохраняется на уровне 150 ммоль/л. С другой стороны, натриевый насос служит возвращению ионов водорода в кровь. Концентрация Са2+ в соке поджелудочной железы изменяется параллельно содержанию в нем ферментов.
Второй механизм активного транспорта связан с транспортом бикарбонатов, когда получаемая энергия используется для активного транспорта электролитов при участии карбоангидразы. В клетках протоков поджелудочной железы содержится около 0,34 мкмоль/кг карбоангидразы, которая способна образовать 10000 мкмоль HCO3 – за 1 мин. Одновременно происходит обмен Na+=H+. Концентрация HCO3 – в соке поджелудочной железы в 4-5 раз превосходит концентрацию анионов в крови. Бикарбонаты выделяются в просвет протоков также центроацинарными клетками, хотя нет убедительных доказательств того, что выделение бикарбонатов не осуществляется и ацинарными клетками. Ферменты не являются обязательным звеном в выделении бикарбонатов в состав сока поджелудочной железы. Двуокись углерода входит в клетку из крови или является продуктом клеточного окислительного метаболизма. Реакция протекает в зоне клеточной мембраны, отделяющей цитоплазму от просвета протоков. Здесь же локализована HCO3 – зависимая АТФаза. Получаемая энергия используется для активного транспорта электролитов в сок поджелудочной железы в обмен на ионы хлора. Концентрация бикарбонатов зависит от скорости секреции. Существует как бы реципроктное отношение между бикарбонатами и хлоридами, что обусловливает постоянство суммы концентрации бикарбонатов и хлоридов, которое наблюдается в процессе секреции поджелудочной железы. Под влиянием секретина происходит обмен между Cl- и HCO3 – . Как только скорость секреции возрастает, концентрация бикарбонатов также растет. Увеличение секреции обусловлено мембраносвязанным ферментом - аденилатциклазой и увеличением уровня цАМФ. Удельный вес поджелудочного сока около 1015 (среднее при возможных колебаниях), рН - 7,5-8,8, вязкость - 1,0. Сок содержит HCO3 – - 6-150 г-экв/л, Cl- - 60-80, SO42+ - 8,4 мг-экв/л, а также Na+- 138, К+ - 4,1-5,0, Са2+ - 2,2-3,2 и пр. Панкреатический сок более чем на 90 % состоит из воды и содержит белка около 190-300 мг/100 мл сока.
Поджелудочная железа синтезирует и выделяет около 25 пищеварительных ферментов. Они участвуют в распаде карбогидратов (амилаза), протеинов (трипсин, химотрипсин), липидов (липаза), нуклеиновых кислот (рибонуклеаза, дезоксирибонуклеаза). Синтез энзимов происходит относительно постоянно, но секреция увеличивается в ответ на пищу или во время голодной пищеварительной деятельности. При секреции пищеварительных гидролаз, доставка аминокислот через мембрану ацинарной клетки происходит с помощью активного транспортного процесса и различных переносчиков.
В состав протеинов сока поджелудочной железы входят протеолитические ферменты: химотрипсин-3, химотрипсин-2, трипсин, (про) эластаза (панкреопептидаза), (про)карбоксипептидаза А2, (про)карбокси-пептидаза В; амилолитические ферменты: a -амилаза; липолитические ферменты: липаза, эстераза (карбоксилэстергидролаза), (про)фосфолипаза А, холестеролэстераза; нуклеиновые ферменты: рибонуклеаза, дезоксирибонуклеаза; другие протеины: колипаза, ингибитор трипсина. Ферменты поджелудочного сока переваривают все виды питательных веществ.
Гидролиз жиров липазой поджелудочного сока усиливается под действием желчи, точнее солей желчных кислот и Са++. Незначительные количества панкреатических ферментов попадают в кровь (инкреция ферментов). Инкреция увеличивается при затруднении оттока панкреатического сока в двенадцатиперстную кишку и при повышении проницаемости мембран ацинусов. Отсюда измерение количества ферментов в крови приобретает диагностическое значение. Мембрана ацинарных клеток содержит два класса рецепторов к холецистокинину: с высоким и низким сродством к пептиду. Высоко-аффинные рецепторы включают секрецию энзимов, а низко-афинная популяция рецепторов ингибирует высвобождение протеолитических ферментов.
Методы исследования экзокринной функции
Панкреозимин-секретиновый тест
Секрет поджелудочной железы получают методом дуоденального зондирования с использованием двух- или трехканального зонда, который позволяет аспирировать отдельно желудочное и дуоденальное содержимое. Зонд устанавливают под рентгеновским контролем таким образом, чтобы олива находилась в нижнем отделе нисходящей части двенадцатиперстной кишки. Правильность нахождения зонда подтверждает выделение из дуоденального канала зонда содержимого кишки с примесью желчи. Желудочный и дуоденальный секрет получают путем активной аспирации. Базальную порцию дуоденального содержимого собирают в течение 30 мин.
Внутривенно вводят раствор панкреазимина в дозе 1,5 ед./кг и собирают в течение 20 мин следующую порцию дуоденального содержимого. Вслед за этим вводят секретин в такой же дозе и собирают еще 3 порции дуоденального содержимого, каждую в течение 20 мин. При этом важно учитывать, что при внутривенном введении секретина и панкреозимина у ряда больных возможно развитие аллергических реакций.
В каждой из 5 порций содержимого определяют:
- Его количество, отражающее объем секреции.
- Бикарбонатную щелочность (методом обратного титрования).
- Концентрацию основных панкреатических ферментов: амилазу - по методу Смит-Рое, липазу - по Титца, трипсин - по Хэвербеку - Эрлангеру.
Нормальные значения вышеуказанных показателей при проведении секретин-панкреазиминового теста:
- объем секреции - 184±19,2 мл/ч (3,6+0,2мл/(кг*ч)); - 85,4±16,3 ммоль/л (15,6+3,2 ммоль/ч);
- амилаза - 111,1±13.6 нкат; - 61,2±9,73 нкат/кг; - 4,86 нкат/кг.
Объем секреции у больных хроническим панкреатитом по сравнению со здоровыми лицами чаще снижен, имеется тенденция к понижению и концентрации бикарбонатов в панкреатическом соке. Повышенная концентрация ферментов нередко отмечается в начальных стадиях развития воспалительно-дистрофического процесса в поджелудочной железе. Гиперсекреция при этом может быть объяснена гипертрофией и гиперплазией эпителия панкреатических канальцев.
Выделяют ряд типов патологической панкреатической секреции, встречающихся при различной патологии поджелудочной железы (Dreiling D., 1975):
Солянокислый тест
В качестве естественного стимулятора панкреатической секреции используется 0,5% раствор хлористоводородной кислоты (в дозе 30 мл), вводимой через зонд интрадуоденально, а также оливкового или подсолнечного масла (25 мл). Действие этих раздражителей на панкреатическую секрецию опосредовано через выделение кишечных гормонов: секретина под влиянием хлористоводородной кислоты и панкреозимина после приема масла. Соответственно этому применение хлористоводородной кислоты в основном способствует выделению бикарбонатов, а оливкового масла - ферментовыделению. Методика забора и изучения панкреатического секрета в целом соответствует таковой после применения внутривенно вводимых стимуляторов.
Несмотря на простоту и доступность данного варианта исследования, оно позволяет получать менее точные данные, особенно при использовании в качестве стимулятора хлористоводородной кислоты, чем проба с секретином и панкреозимином. Одновременное применение этих двух естественных стимуляторов внешней секреции поджелудочной железы затруднительно и потому возникает необходимость в проведении двухэтапного исследования - более обременительного для больного.
Тест Лунда
Упрощенный тест оценки внешнесекреторной функции поджелудочной железы предложил G. Lundh (1962). Метод заключается в аспирации дуоденального содержимого с помощью зонда в течение 2 ч после приема стандартного завтрака, состоящего из 5% белка, 6% жира, 15% углеводов и 300 мл воды. Тест основан на том принципе, что воздействие жирных кислот и аминокислот на слизистую оболочку двенадцатиперстной кишки приводит к высвобождению панкреозимина - естественного стимулятора панкреатической секреции. Исследуется содержание трипсина, химотрипсина, амилазы, липазы в аспирируемой жидкости через 30-минутные интервалы.
К достоинствам теста Лунда относится его простота и доступность, отсутствие необходимости внутривенного введения дорогостоящих гормональных препаратов. Недостатком теста является получение при зондировании панкреатического секрета в смеси с желчью и желудочным соком, что отражается на точности полученных результатов.
Анализ проведенных исследований результативности тестов Лунда и секретин-панкреозиминового, свидетельствует о сравнимости получаемых данных в относительно далеко зашедших стадиях хронического панкреатита, тогда как в начальных стадиях заболевания последний тест оказывается более чувствительным.
Определение химотрипсина в кале
О нарушениях секреции панкреатических ферментов у больных хроническим панкреатитом можно судить и путем химического определения ферментов в кале. Одним из наиболее стойких среди протеолитических и липолитических ферментов поджелудочной железы является химотрипсин, который сохраняется в кале при комнатной температуре до 2 недель.
Исследование производят спустя 3 дня после отмены всех пероральных ферментных препаратов. Предпочтительным является взятие небольшого количества (1 г) из суточного объема кала. Принцип метода основан на расщеплении химотрипсином М-ацетил-тирозин-этилового эфира с образованием кислых продуктов, которые оттитровывают щелочью.
При выраженных нарушениях экзокринной функции поджелудочной железы тест обнаруживает значительное снижение содержания химотрипсина. Вместе с тем, при умеренных функциональных нарушениях отмечается довольно значительное количество ложноположительных и ложноотрицательных результатов. В связи с этим определение химотрипсина кала признается большинством авторов ориентировочным тестом выявления выраженных экзокринных нарушений функции поджелудочной железы различной природы.
Определение перевариваемости ингредиентов пищи
Как правило, при этом используют непрямые способы. О состоянии внешней секреции железы косвенно можно судить по степени перевариваемости различных ингредиентов пищи, прежде всего, жиров и белков. Простейшим методом оценки перевариваемости служит качественное копрологическое исследование, проводимое в условиях тщательного соблюдения больным стандартной диеты с высоким содержанием жира и мясных продуктов.
Обычно в течение 3 дней назначают диету Шмидта, включающую 105 г белка, 135 г жира и 180 г углеводов. У лиц не переносящих подобную диету, выполнение этого исследования невозможно.
Признаками, свидетельствующими о внешнесекреторной недостаточности поджелудочной железы, являются повышенное содержание в испражнениях нейтрального жира и мыл при малоизмененном содержании жирных кислот. На наличие креатореи указывает повышенное содержание в каловых массах мышечных волокон, которые, в отличие от нормальных условий, оказываются малоизмененными с сохраненным поперечнополосатым рисунком и острыми концами.
Более точным является количественное определение химическими способами содержания жира в кале. При проведении теста необходим ежедневный прием 100 г жира в течение 2-3 дней накануне исследования и 3 дней проведения теста. Средняя суточная потеря свыше 6% жира с калом является признаком стеатореи и заставляет предполагать недостаточность панкреатической секреции.
Радиоизотопный метод
Количественную оценку стеато- и креатореи более удобно проводить радиоизотопным методом. При этом необходимо учитывать, что стеаторея может быть обусловлена как недостатком панкреатической липазы, так и нарушением всасывания жира в кишечнике. При наличии мальабсорбции, нарушенным оказывается всасывание всех видов жира, который в повышенном количестве выделяется с калом. При поражении поджелудочной железы, в частности при хроническом панкреатите, нарушается всасывание только тех липидов, которые предварительно должны быть расщеплены липазой.
Для выявления стеатореи, обусловленной дефицитом панкреатической липазы, используется тест с триолеатом глицерина, меченным 131 I. Препарат принимают в дозе 0,15 мкКю/кг массы тела, разводя его в 30 мл растительного масла. Затем в течение 3 суток собирают каловые массы. Радиоактивность собранного кала подсчитывают с помощью сцинтилляционного счетчика в процентах ко всему количеству введенного изотопа. Выделение со стулом свыше 6% радиоактивного изотопа свидетельствует о наличии стеатореи, а при радиоактивности выведенного изотопа препарата, превышающей 10%, можно говорить о довольно тяжелой стеаторее.
Определение уровня креатореи проводят по сходной методике, обычно с помощью альбумина, меченного 131 I. За критический уровень, позволяющий говорить о наличии креатореи, принимается 5% выделенного радиоактивного йода, а при радиоактивности 10% и более йода в кале следует говорить о выраженной степени креатореи.
ПАБА-тест
К числу непрямых методов оценки состояния внешнесекреторной функции поджелудочной железы относят определение степени расщепления бензоил-тирозил-парааминобензойной кислоты в кишечнике с образованием парааминобензойной кислоты - РАВА-тест (Imondi A. et al., 1972). Принцип данного диагностического метода основан на оценке степени расщепления пептидов в тонкой кишке под действием химотрипсина. Отщепленная парааминобензойная кислота всасывается и выделяется с мочой. Таким образом, количество парааминобензойной кислоты, выделяемой за определенный промежуток времени после приема стандартной дозы препарата, позволяет количественно оценить экзокринную функцию поджелудочной железы.
Для проведения теста перорально принимается 1 г бензоил-тирозил-парааминобензойной кислоты (содержащей 340 мг парааминобензойной кислоты). Обследуемый в течение суток перед исследованием должен избегать приема ферментных препаратов, сульфаниламидов, диуретиков, алкоголя. После приема препарата, содержащего парааминобензойную кислоту, собирают мочу в течение 8 ч. Парааминобензойную кислоту определяют в моче фотометрическим методом. В норме за 8 ч с мочой выделяется от 51 до 78% принятой парааминобензойной кислоты.
При развитии выраженной внешнесекреторной недостаточности поджелудочной железы выделение парааминобензойной кислоты существенно снижается, часто более чем наполовину. ПАБА-тест позволяет определить как умеренные, так и тяжелые нарушения экзокринной панкреатической функции. Данный тест целесообразно использовать как метод массового обследования для первичного выявления поражений поджелудочной железы.
Эластазный тест
В отличие от существующих неинвазивных тестов, эластазный тест позволяет выявить эндокринную недостаточность поджелудочной железы уже на ранних стадиях заболевания. Эластаза в кале наиболее достоверно отражает экзокринную недостаточность поджелудочной железы, т.к. в отличие от остальных ферментов не инактивируется при транзите по кишечнику.
Стандартный эластазный копрологический тест содержит моноклональные антитела к панкратической эластазе человека. В отличие от тестов, основанных на поликлональных антителах он чувствителен и специфичен только в отношении панкреатической эластазы 1 человека.
В таблице 6 приведены колебания содержания панкреатической эластазы в кале.
Таблица 6. Содержание панкреатической эластазы в кале.
Определение жиров в кале
Определение эластазы в кале
Показания к назначению копрологического эластазного теста:
- диагностика острого и хронического панкреатита;
- количественная оценка степени снижения экзокринной недостаточности поджелудочной железы;
- оценка эффективности проводимого лечения (вместо эмпирического подбора доз ферментозаместительной терапии).
При этом определение эластазы в сыворотке крови имеет ряд преимуществ по сравнению с определением амилазы крови (табл. 8).
Таблица 8. Сравнительная характеристика специфичности и чувствительности методов диагностики панкреатической ферментемии.
Амилаза сыворотки крови
Эластаза сыворотки крови
Для исследования необходимо следующее оборудование:
Читайте также:

