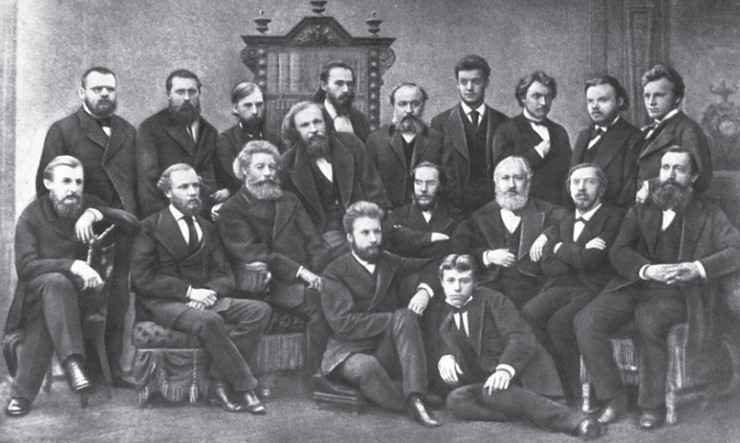Элементы предсказанные менделеевым доклад
Обновлено: 16.05.2024
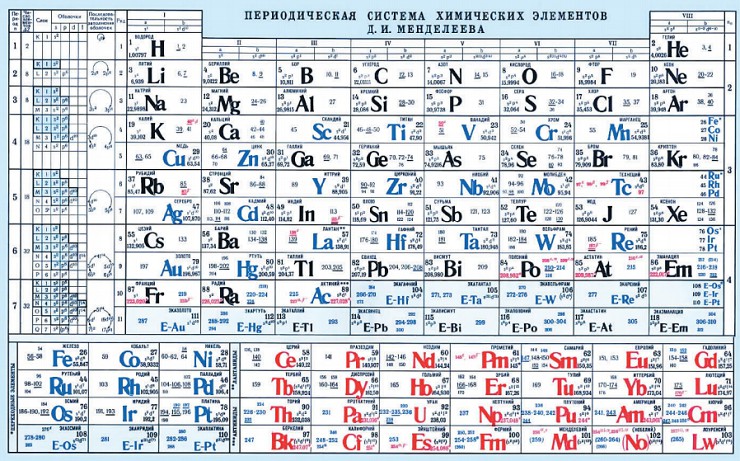
Дмитрий Менделеев опубликовал первую периодическую таблицу элементов в 1869 году , основанную на свойствах, которые появляются с регулярностью в зависимости от массы элементов . Эти элементы , предсказанные Менделеевым представляют собой набор химических элементов, существование которых было предсказано Д. И. Менделеевым , когда они не были обнаружены.
Резюме
Префиксы
Чтобы дать временные названия предсказанным им элементам, Менделеев использует префиксы éka -, dvi - и tri -, взятые из чисел 1, 2 и 3 на санскрите , в зависимости от места элемента в его периодической таблице (один, на два-три места ниже известного элемента той же группы ). Германий является так называемым Ека кремния Менделеева, тем рений DVI марганца и ранее три-марганец. На выбор этой терминологии, возможно, повлиял санскритист Отто фон Бетлингк , коллега и друг Менделеева.
Приставка éka- затем используется другими теоретиками. До их открытий, франция так называемое Ека цезия и астатином Ека йода . Ека до сих пор иногда используется для обозначения трансурановых элементов , как Ека радона , обозначающих oganesson и Ека актиния (DVI или лантан ) для unbiunium . Однако IUPAC использует систематическое именование, чтобы дать временное имя элементам на основе атомного номера .
Оригинальные предсказания
В 1871 году Менделеев сделал несколько предсказаний относительно элементов, которые еще не были обнаружены. Из них три предсказанных элементов с некоторыми из их свойств, Ека боры (Eb), Ека алюминия (Еа) и Ека кремния (Es), хорошие предсказания для элементов. Скандий , галлий и германий :
| Характеристики | Эка-бур | Скандий |
|---|---|---|
| Атомная масса | 44 год | 43,79 |
| Окись | Eb 2 O 3 | Сбн 2 О 3 |
| Плотность оксида ( г / см 3 ) | 3.5 | 3 864 |
| Характеристики | Эка-алюминий | Галлий |
|---|---|---|
| Атомная масса | 68 | 69,9 |
| Плотность ( г / см 3 ) | 6.0 | 5,96 |
| Характеристики | Эка-силикон | Германий | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Атомная масса | 72 | 72,3 | |||||||||||||||||||||||||||||
| Плотность ( г / см 3 ) | 5.5 | 5,469 | |||||||||||||||||||||||||||||
| Окись | EsO 2 | GeO 2 | |||||||||||||||||||||||||||||
| Плотность оксида ( г / см 3 ) | 4,7 | 4 703 | |||||||||||||||||||||||||||||
| Хлористый | EsCl 4 | GeCl 4 | |||||||||||||||||||||||||||||
| Температура кипения хлорида | 1913 и 1918 годами были выделены различные изотопы протактиния, хотя название протактиний не использовалось до 1949 года. С 1950-х годов торий, уран и протактиний были классифицированы как актиниды , так что протактиний больше не занимает место эка-тантала. теперь называется группой 5 . Сегодня эка-тантал называют дубнием .
Менделеев также предсказал существование эка-ниобия, эка-молибдена, эка-кадмия, эка-йода и двителлура. Однако присутствие лантаноидов мешает Менделееву предсказывать атомные массы таким образом, что только двителлур по своей атомной массе и своим свойствам соответствует элементу, открытому позже ( полонию ). Помимо атомных масс, были обнаружены более тяжелые аналоги ниобия, молибдена, кадмия и йода. Это соответственно тантал , вольфрам , ртуть и астат . Другие прогнозыВ 1902 г., признав существование элементов гелия и аргона , Менделеев поместил эти благородные газы в группу 0 . Менделеев сомневается в атомной теории, объясняющей закон определенных пропорций , поэтому у него нет оснований априори считать, что водород является самым легким элементом и предполагает существование еще двух элементов: света, принадлежащего к группе 0. Самым тяжелым из этих гипотетических элементов является короний (или элемент y), названный в связи с необъяснимой спектральной линией в солнечной короне, из которой он был бы источником. Вальтер Гротриан и Бенгт Эдлен впоследствии объяснят происхождение этой линии присутствием Fe XIV в короне. Самый легкий из этих элементов, элемент x, имел бы теоретическую атомную массу от 5,3 · 10 −11 до 9,6 · 10 −7 и составлял эфир . По мнению Менделеева, элемент x мог бы также вызвать явление радиоактивности путем накопления вокруг тяжелых элементов. Он предложит назвать этот элемент ньютонием в честь Исаака Ньютона . Менделеев также предсказал существование шести элементов между водородом и литием , но это предсказание оказалось неверным. Немецкий учёный, академик Лотар Кольдиц так истолковывает особенности открытия Д.И. Менделеева, сопоставляя в высшей степени убедительные результаты его труда с работами других исследователей, искавших подобные закономерности: Развивая в 1869—1871 годах идеи периодичности, Д.И. Менделеев ввёл понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов. На этой основе, в частности, опираясь на результаты изучения последовательности изменения стеклообразующих оксидов, исправил значения атомных масс 9 элементов (бериллия, индия, урана и др.). Элементы, предсказанные Менделеевым
Галлий. В 1875 г. французский ученый П. Лекок де Буабодран, исследуя цинковую обманку обнаружил в ней с помощью спектроскопического метода новый элемент и определил некоторые его свойства. Он назвал новый элемент галлием (Gallium) в честь своей родины - Франции (лат. Gallia).
Германий .В 1886 г. немецкий химик К. Винклер в обнаруживает в серебряном минерале аргиродите новый элемент, который впоследствии назвал в честь своей родины германием. Новый элемент оказался предсказанным Менделеевым экасилицием. Л. де Буабодрана, Л.Нильсона и К.Винклера, открывших галлий, скандий и германий, предсказанных и описанных Менделевым, ученый считал укрепителями периодического закона. История открытия элементовЧасто названия новые элементы получают по месту расположения лаборатории, где они были открыты, и по имени ученого, проводившего исследование. Имя Д.И. Менделеева носит 101 элемент периодической системы, синтезированный в 1955 году в Беркли (США) - Менделевий (Md). Первым человеком, чье имя занесли в периодическую таблицу при жизни, стал химик Глен Сиборг. В честь него назван 106 элемент таблицы - сиборгий (Sg).
Россия в периодической таблицеНа настоящий момент 6 элементов периодической системы носят названия, связанные с Россией.
Рутений (Ru) – 44-й элемент, открыт в 1844 г. в Казани К. Клаусом, назван в честь России (лат. – Ruthenia).
Менделевий (Md) – 101-й элемент, синтезирован в 1955 г. в Беркли (США), назван в честь Дмитрия Ивановича Менделеева.
Дубний (Db) – 105-й элемент, синтезирован в 1970 г. в Дубне и независимо в Беркли (США), назван в честь г. Дубны.
Флеровий (Fl) – 114- й элемент, открыт в 1998 г. в Дубне, назван в честь Лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ.
Московий (Mc)– 115- й элемент, открыт в 2004 г. в Дубне, назван в честь Московской области, где находится ОИЯИ. © 2019 СГТУ имени Гагарина Ю.А. Просветительский медиапроект, созданный в рамках Всероссийского Фестиваля науки 0+ Менделеев не только первый точно сформулировал этот закон и представил содержание его в виде таблицы, которая стала классической, но и всесторонне обосновал его, показал его огромное научное значение, как руководящего классификационного принципа и как могучего орудия для научного исследования. Физический смысл периодического закона. Был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома. Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе периодического закона лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. Наглядная иллюстрация периодического закона — кривые периодические изменения некоторых физических величин (ионизационных потенциалов, атомных радиусов, атомных объёмов) в зависимости от Z. Какого-либо общего математического выражения периодического закона не существует. Периодический закон имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря периодическому закону многие научные поиски (например, в области изучения строения вещества — в химии, физике, геохимии, космохимии, астрофизике) получили целенаправленный характер. Периодический закон — яркое проявление действия общих законов диалектики, в частности закона перехода количества в качество. Физический этап развития периодического закона можно в свою очередь разделить на несколько стадий: 1.Установление делимости атома на основании открытия электрона и радиоактивности (1896-1897); 2.Разработка моделей строения атома (1911-1913); 3.Открытие и разработка системы изотопов (1913); 4.Открытие закона Мозли (1913), позволяющего экспериментально определять заряд ядра и номер элемента в периодической системе; Нужна помощь в написании доклада? Мы - биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно. 5.Разработка теории периодической системы на основании представлений о строении электронных оболочек атомов (1921-1925); 6.Создание квантовой теории периодической системы (1926-1932). Предсказание существования неизвестных элементов Менделеев точно предсказал свойства экаалюминия: его атомную массу, плотность металла, формулу оксида El2O3, хлорида ElCl3, сульфата El2(SO4)3. После открытия галлия эти формулы стали записывать как Ga2O3, GaCl3 и Ga2(SO4)3. Менделеев предугадал, что это будет очень легкоплавкий металл, и действительно, температура плавления галлия оказалась равной 29,8 оС. По легкоплавкости галлий уступает только ртути Hg и цезию Cs. На протяжении истории развития химической науки сделано немало открытий, однако немногие из них можно сопоставить с достижениями русского ученого Дмитрия Ивановича Менделеева. Со времени открытия периодического закона прошло достаточно времени, однако даже сегодня никто не может однозначно утверждать, что все содержание таблицы элементов осознано до конца.
Д. И. Менделеев среди профессоров, преподавателей и студентов физикоматематического факультета Санкт-Петербургского университета Открытие периодического закона
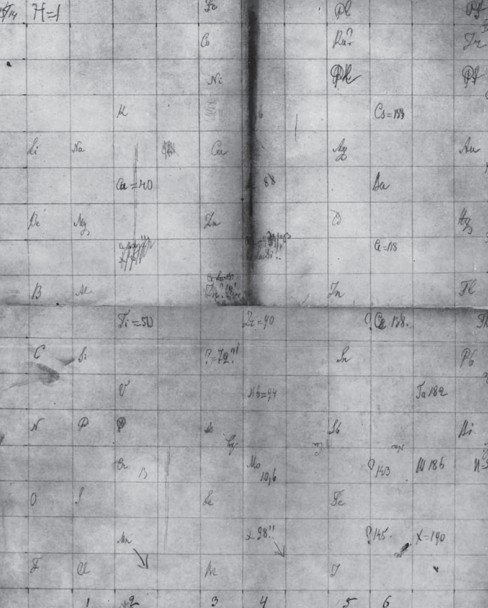
По легенде, которая более похожа на правду, периодическую таблицу элементов, которая позволила превратить весь собранный материал в стройную базу данных, Менделеев увидел во сне. Ему приснилось, в каком порядке необходимо расположить имеющиеся у него карточки согласно фундаментальному закону природы. На тот момент ученый был весьма близок к открытию таблицы, ведь он годами пытался систематизировать данные, так что рано или поздно это должно было случиться. Мозг химика и днем, и ночью работал в одном направлении. Поэтому озарение скорее закономерно, чем случайно. С того дня, когда за простыми рядами символов химических элементов Менделеев увидел проявление закона природы, его уже не занимали другие вопросы: все отошло на задний план.
Д. И. Менделеев также создавал приборы, которые использовал в своих исследованиях. Вот только некоторые из них: пикнометр для определения плотности жидких веществ, весы для взвешивания твердых и газообразных веществ, дифференциальный барометр 1 марта 1869 года, закончив рукопись учебника, в котором находилась таблица элементов, Менделеев сдал его в печать и сразу же уехал в командировку. Этот день считается датой открытия периодического закона химических элементов. Однако именно тогда ученый лишь завершил разработку таблицы, которая на самом деле была прообразом той периодической системы, о которой мы знаем со школьной скамьи. Об открытии закона сообщил друг Менделеева профессор химии Меншуткин. Это произошло 6 марта 1869 года на заседании Русского химического общества. Интересен тот факт, что русские химики вначале даже не поняли, о чем идет речь и какое великое достижение имеется в виду. Однако для дальнейшего развития таблицы и закона было достаточно того, что значение этого открытия осознал сам Дмитрий Иванович.
Окончательная доработка периодической таблицыРуководствуясь законом периодичности и химико-физическими свойствами соединений, Менделеев изменил атомные массы этих элементов и поставил их в один ряд с теми, у которых были сходные свойства. Так, вначале он поместил карточку с бериллием, атомная масса которого считалась равной 14, рядом с алюминием (атомная масса 27,4). В то время бериллий считали аналогом алюминия. Но, сопоставив химические свойства, переместил бериллий ближе к магнию. Можно сказать, что ученый таким образом высказал сомнение в общепринятом значении атомной массы бериллия. Он изменил ее на 9,4. А формулу оксида бериллия по аналогии с оксидом магния переделал из Be2O3 в BeO. Следует заметить, что такое значение атомной массы бериллия было подтверждено только спустя десять лет. Так же смело Менделеев действовал и в остальных подобных случаях. Например, приписал урану атомную массу 240, вследствие чего элемент оказался последним в системе. Далее четко сформулировал понятия о группах элементов, малых и больших периодах.
Пустые места в таблице Менделеева не смущали: он с легкостью оставлял их, считая, что эти элементы еще не открыты и неизвестны науке. Так, с учетом свойств соседствующих с пустотами в таблице элементов и их соединений талантливый химик предсказал и подробно описал три неизвестных элемента, назвав их именами аналогов — эка-бор (будущий элемент скандий), эка-алюминий (известный затем как галлий) и эка-силиций (получивший название германий). Доработкой таблицы занимался не только сам ее создатель. К ней приложили руку многие видные химики всех передовых стран. Варианты периодической системы отличались друг от друга порой разительно, однако всегда во главе угла стоял открытый Менделеевым закон периодического изменения свойств элементов. Так, химик поместил элемент водород в первую группу (сверху слева), некоторые ученые вообще не предоставляли водороду места в системе, другие рассматривали его как легкий аналог галогенов (хлора, брома или йода), третьи размещали водород в середине первого периода, подразумевая, что этот элемент как бы принадлежит ко всем группам элементов. К слову, такая неоднозначная ситуация сохранилась и до сих пор.
Закон и периодическая система даже сегодня продолжают свое развитие, которое порой отражается на ее внешнем виде, но не меняет при этом ее сути Последним элементом в этом варианте таблицы был уран с атомной массой 240. Менделеев не спешил предсказывать существование элементов тяжелее урана. Он считал, что если они и есть в природе, то их совсем немного. Так, в таблице после урана идут пять пустых мест, которые соответствуют трансурановым элементам с их вероятными атомными массами. Кроме этого, в таблице присутствуют и другие элементы, которые еще предстояло открыть: два аналога марганца с атомными массами 100 и 190 — будущие технеций и рений, аналоги цезия, бария, лантана и тантала — франций, радий, актиний и протактиний, аналоги теллура и йода — полоний и астат. благородные, или инертные, газы. Их Менделеев предсказать не смог, более того, они стали целым испытанием для периодического закона и таблицы. Дело в том, что от данных элементов не удавалось получить каких-либо соединений, они просто не вступали в химическое взаимодействие с другими веществами. Доходило до того, что некоторые ученые отказывались признавать их элементами. Однако в итоге была выдвинута идея так называемой нулевой группы, что позволило включить данные элементы в таблицу. Кроме них в таблицу попал еще радий — это говорит о том, что Менделеев окончательно признал явление радиоактивности и радиоактивных элементов. Открытие предсказанных элементовИнтересна история открытия элементов, существование которых предрекал Менделеев исходя из периодической таблицы. По сути, относительно скорое их обнаружение и полное совпадение предсказанных свойств с реальными стало дополнительной причиной признания периодического закона, дальнейшего развития таблицы и поиска новых элементов. А началось все, как водится, с подачи Дмитрия Ивановича.
Открытие галлия — первое подтверждение закономерности, выведенной Менделеевым. Ученый получил новый элемент в очень небольшом количестве (меньше 100 мг), и полностью изучить его физические и химические свойства не представлялось возможным. Поэтому неудивительно, что первоначально атомная масса была определена неверно: французский исследователь указал цифру 4,7. По вычислениям Менделеева, у эка-алюминия он должен быть 5,9. Дмитрий Иванович написал французскому ученому о том, что, судя по свойствам открытого элемента, это не что иное, как предсказанный им в 1869- м эка-алюминий. После более точных исследований удельный вес галлия действительно получился 5,94! Открытие галлия вызвало настоящую сенсацию в научной среде. Фамилии Менделеева и Лекока де Буабодрана в одночасье стали известны буквально всему миру. Ученые всех передовых стран воодушевились возможными успехами, что дало мощный старт дальнейшему поиску остальных предсказанных элементов. Десятки лабораторий Европы подключились к этой работе, не говоря уже о сотнях химиков, жаждущих необыкновенных открытий и славы.
При таком подходе успехи не заставили себя ждать. Уже в 1879 году профессор химии Ларс Фредерик Нильсон из шведского города Упсала открыл новый элемент, полностью соответствующий эка-бору. Он занимался изучением минералов, содержащих редкоземельные металлы, и стремился выделить из них соединения редкоземельных элементов в чистом виде, а затем определить физико-химические свойства и место в периодической системе. В результате Нильсон открыл неизвестное соединение, которое сначала принял за оксид существующего элемента. После более подробных исследований было доказано, что это новый элемент.
Профессор Нильсон назвал его скандием в честь родины Скандинавии. На то, что открытый элемент очень похож на предсказанный Менделеевым эка-бор, указал другой шведский ученый — Пер Теодор Клеве, который обратил внимание, что многие свойства нового элемента, в частности формула оксида, бесцветность солей и нерастворимость оксида в щелочах, очень похожи на предсказанные свойства эка-бора. После этого скандий занял в периодической системе именно то место, на которое указывал русский химик.
новый элемент есть эка-силиций, существование которого предсказал Менделеев. Винклер предложил назвать его нептунием, намекая на то, что история открытия очень сходна с обнаружением планеты Нептун.
Однако из-за того, что такое имя было дано ранее другому, ложно открытому элементу, Винклер придумал новое — германий — в честь родины. Но данное название вызвало неоднозначную реакцию у многих ученых. Конец спорам положил Менделеев, который к тому времени обладал неоспоримым авторитетом. В своем письме к Винклеру он решительно поддержал название германий. Авторитет Менделеева был настолько велик, что после его смерти имя ученого было присвоено Русскому химическому обществу (сейчас оно называется Российским химическим обществом им. Д. И. Менделеева). Кроме этого, АН СССР с 1962 года вручает золотую медаль им. Д. И. Менделеева отечественным ученым за выдающиеся научные работы в области химической науки и технологии.
Действующий вулкан в южной части острова Кунашир Большой Курильской гряды также назван в честь великого химика Краткая биография
На протяжении истории развития химической науки сделано немало открытий, однако немногие из них можно сопоставить с достижениями русского ученого Дмитрия Ивановича Менделеева. Со времени открытия периодического закона прошло достаточно времени, однако даже сегодня никто не может однозначно утверждать, что все содержание таблицы элементов осознано до конца. Элементы , предсказанные Менделеевым , — это совокупность ещё не открытых в то время химических элементов , существование и свойства которых были предсказаны русским химиком Дмитрием Менделеевым , а позже открыты и идентифицированы другими химиками. Предсказания МенделееваМенделеев опубликовал первую периодическую таблицу атомных элементов в 1869 году на основе свойств, которые проявлялись с некоторой регулярностью, когда он располагал элементы в порядке от самого легкого к самому тяжелому. [ 1 ] Когда Менделеев предложил свою периодическую таблицу, он указал на ее недостатки и предсказал, что должны быть какие-то неизвестные элементы с определенными подходящими свойствами, чтобы заполнить эти пробелы. префиксыЧтобы дать предварительные названия предсказанным им элементам, Менделеев использовал приставки эка- , дви- и три- от санскритских слов , означающих один, два и три, в зависимости от того, был ли элемент предсказан один, два или три. на три места ниже известного элемента в вашей таблице и с аналогичными химическими свойствами. Например, германий до его открытия в 1886 г. назывался эка - кремний , а до его открытия в 1926 г. рений назывался дви - марганцем . [ 2 ] Было высказано предположение, что сходство между табличной структурой, обычно используемой для отображения санскритских abugidas , и периодической таблицей привело Менделеева к использованию санскрита в качестве основы для этих префиксов. [ 3 ] На самом деле Менделеев изучал этот язык в Санкт-Петербургском университете [ 4 ] , и это могло быть причиной того, что он предпочитал эти префиксы тем, у которых были греческие или латинские корни. Иногда префикс эка- используется для обозначения некоторых трансурановых элементов , например, название эка- ведет для обозначения флеровия , а экарадон — для обозначения оганесона . Сегодня приставка эка- (и, реже, дви-) иногда используется при обсуждении новых элементов, которые еще предстоит открыть, таких как унтриенний , элемент с атомным номером 139, также известный как экаактиний или двилантан . Текущая официальная практика IUPAC заключается в использовании систематического имени элемента, основанного на атомном номере элемента, в качестве предварительного имени, а не на основе его положения в периодической таблице, как того требуют эти префиксы. Оригинальные предсказания 1870 годаЧетыре предсказанных элемента, которые имели меньшую атомную массу , чем редкоземельные элементы , экаборон (Eb), экаалюминий (Ea), экамарганец (Em) и экасилий (Es), оказались хорошими предикторами свойств скандия , галлия , технеций и германий соответственно, и каждый занимал место в таблице Менделеева, указанное Менделеевым. Ранние версии периодической таблицы не относились к редкоземельным элементам так, как сейчас, что помогает объяснить, почему предсказания Менделеева для этих тяжелых неизвестных элементов не сбылись так же хорошо, как для четырех самых легких элементов, и почему эти другие предсказания не так хороши. хорошо известны или задокументированы. Русский химик Дмитрий Менделеев (1834-1907) при создании своей периодической таблицы заметил, что периодическая последовательность не совпадает, и сделал вывод, что она содержит некоторые пробелы, и предсказал, что они будут соответствовать химическим элементам, которые еще предстоит открыть. Чтобы назвать их, он использовал три славянских слова [ 5 ] (которые идентичны их санскритским переводам ) в качестве префиксов: Эка-боро и скандийОксид скандия был выделен в конце 1879 года Ларсом Фредриком Нильсоном . Пер Теодор Клив узнал переписку и уведомил об этом Менделеева позже в том же году. Менделеев предсказал атомную массу экабора, равную 44, в 1871 году [ 6 ] , в то время как атомная масса скандия равна 44,955910. Эка-алюминий и галлийВ 1871 году Менделеев предсказал существование еще не открытого элемента, который он назвал эка-алюминием (из-за его близости к алюминию в периодической таблице). В следующей таблице сопоставлены свойства элемента, предсказанного Менделеевым [ 6 ] , с действительными характеристиками галлия (открытого в 1875 г.). ((растворим в щелочах и кислотах)) ((растворим в щелочах и кислотах)) Эка-марганец и технецийТехнеций был выделен Карло Перрье и Эмилио Сегре в 1937 году , спустя много времени после смерти Менделеева, из образцов молибдена , которые Эрнест Лоуренс бомбардировал ядрами дейтерия в циклотроне . Менделеев предсказал [ 6 ] атомную массу 100 для экамарганца в 1871 г., а наиболее стабильным изотопом технеция является 98Tc . [ 7 ] Эка-кремний и германийГерманий был выделен в 1886 году и на тот момент служил лучшим подтверждением теории, потому что он более явно разделяет свойства с соседними элементами, чем два ранее подтвержденных предсказания Менделеева.
1871 предсказаниеСуществование элемента между торием и ураном было предсказано Менделеевым в 1871 году. В 1900 году Уильям Крукс выделил протактиний как радиоактивный материал из урана, который он не мог идентифицировать. Различные изотопы протактиния были идентифицированы в Германии в 1913 и 1918 годах [ 8 ] , но название протактиний не было дано до 1948 года. В таблице 1869 г. Менделеев неявно предсказал более тяжелый аналог титана и циркония , но в 1871 г. он поставил на это место лантан . Открытие гафния в 1923 году подтвердило первоначальное предсказание Менделеева в 1869 году. Более поздние предсказания новых элементов: короний и др.В 1902 году, приняв существование элементов гелия и аргона , Менделеев поместил эти благородные газы в группу 0 (сегодня называемую группой 18 ) в своей табличной системе элементов. [ 9 ] Поскольку Менделеев сомневался, что атомная теория может объяснить Закон определенных пропорций , у него не было априорных оснований полагать, что водород является самым легким из элементов, и предположил, что гипотетический самый легкий член этих элементов, химически инертная группа 0, может быть обнаружены в будущем и будут нести ответственность за радиоактивность. Самый тяжелый из гипотетических протогелиевых элементов был отождествлен Менделеевым с коронием , названным по ассоциации с необъяснимой спектральной линией спектра солнечной короны . Неправильная калибровка дала длину волны 531,68 нм , скорректированную со временем до 530,3 нм, которую Гротриан и Эдлен идентифицировали как исходящую от Fe XIV в 1939 году. [ 10 ] Самый легкий из газов нулевой группы, первый в периодической таблице, имел теоретическую атомную массу от 5,3 х 10 -11 до 9,6 х 10 -7 . Кинетическая скорость этого газа была рассчитана Менделеевым и составила бы 2 500 000 метров в секунду. Почти безмассовые, Менделеев предполагал, что эти газы пронизывают всю материю, редко взаимодействуя химически. Высокая подвижность и очень малая масса трансводородных газов привели бы к тому, что они могут быть очень разреженными, но все же казаться очень плотными. [ 11 ] Менделеев был настолько уверен, что эти атомные элементы будут обнаружены, что включил их в последующие публикации таблицы Менделеева, хотя в то время не было никаких физических доказательств их существования. Читайте также:
|