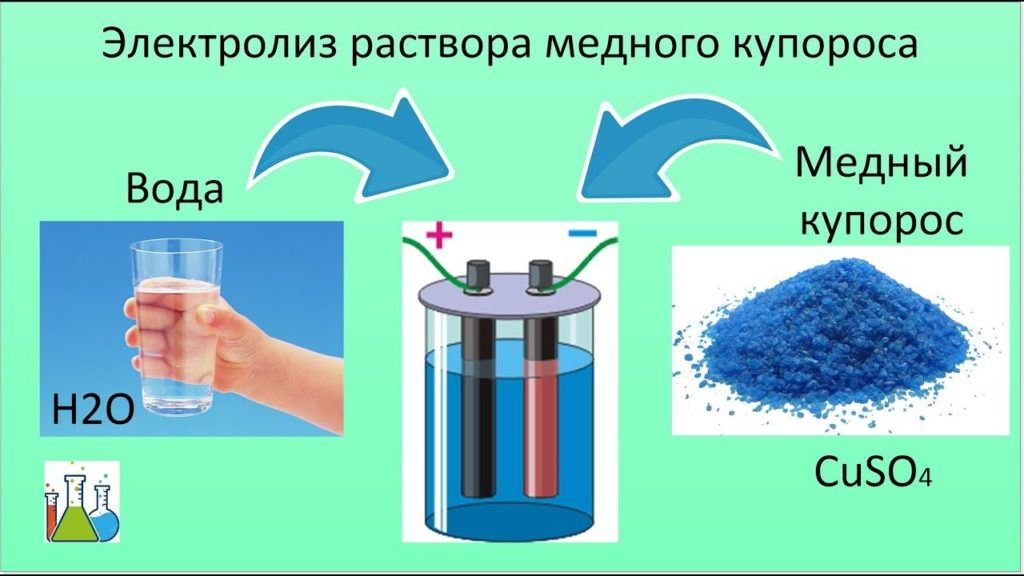
Доклад на тему применение электролиза гальванопластика
Обновлено: 16.05.2024
Анализ сущности процесса электролиза как совокупности физико-химических явлений. Рассмотрение примеров получения металлов в промышленности электролитическим путём. Изучение специфики гальваностегии, гальванопластики, гальванополировки и электрофореза.
| Рубрика | Химия |
| Вид | доклад |
| Язык | русский |
| Дата добавления | 10.11.2014 |
| Размер файла | 12,2 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
На тему: “Применение электролиза”
ученица 8 “Б” класса школы №7
Электрометаллургия. Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна - катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
Рафинирование (очистка) меди. Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название - медный купорос) и опускают две пластины: анод - толстую пластину из неочищенной меди и катод - тонкий лист из чистой меди. При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы - никель, свинец, золото.
Гальваностегия. Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними. Электролиз применение металл
Гальванопластика. Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке - электрохимии.
Подобные документы
Обзор физико-химического процесса, состоящего в выделении на электродах составных частей растворённых веществ. История изучения электролиза и его применение в современной промышленности и технике. Переработка руд, очистка металлов с помощью электролиза.
презентация [1,5 M], добавлен 01.03.2013
Понятие электролиза, его практическое применение. Электролизные и гальванические ванны, их электроснабжение для получения алюминия. Применение электрохимических процессов в различных областях современной техники, в аналитической химии и биохимии веществ.
презентация [772,0 K], добавлен 25.07.2015
Определение массы вещества, выделившегося при реакции электролиза. Примеры решения задач на расчет массовой доли веществ, участвующих в реакции электролиза. Примеры решения задач на расчеты по законам электролиза М. Фарадея, расчет времени электролиза.
методичка [125,5 K], добавлен 18.08.2009
Физические, химические свойства и применение цинка. Вещественный состав цинкосодержащих руд и концентратов. Способы переработки цинкового концентрата. Электроосаждение цинка: основные показатели процесса электролиза, его осуществление и обслуживание.
курсовая работа [2,9 M], добавлен 08.07.2012
Теоретические основы электрохимических методов анализа вещества, основанных на использовании электролиза. Рассмотрение аппаратуры, метрологических и аналитических характеристик электрогравиметрического анализа. Особенности метода внутреннего электролиза.
Практическое применение электролиза
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.

Суть электролиза
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т. д.)

На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Законы электролиза Фарадея
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.

m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Получение чистых металлов из руд путем электролиза
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются - выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.

Рассмотрим в качестве примера электрорафинирование меди. Главный компонент раствора - сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Очистка сточных вод путем электролиза
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.

Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию. Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
Гальваностегия
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика
Гальванопластика - осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.д.

Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование, он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование, способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение, пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Подробнее смотрите здесь: Химические источники электрического тока
Лимонная батарейка (для увеличения нажмите нажмите на картинку)

Подробнее о том, как работает такая батарейка смотрите здесь: Как сделать батарейку из лимона в домашних условиях
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Электролиз находит широкое применение в технике. Рассмотрим лишь некоторые примеры наиболее важных технических применений электролиза.
Гальваностегия — покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т. д.) с целью предохранения от окисления и придания изделию привлекательного внешнего вида. Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет (рис. 3.8). Анодом служит пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними (см. рис. 3.8).

Гальванопластика — электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т. д.). С рельефного предмета делают восковый или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом служит медная пластинка. Когда на слепке нарастет достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Остается точная медная копия оригинала.
В полиграфической промышленности такие копии (стереотипы) получают с оттиска набора на пластичном материале (матрица), осаждая на матрицах толстый слой железа или другого материала. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор стирается), то использование стереотипов позволяет значительно увеличить тираж.
Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати и с большим числом иллюстраций.
Осаждая металл на длинный цилиндр, получают трубы без шва.
Процесс получения отслаиваемых покрытий был разработан русским ученым Б. С. Якоби, который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора (в Санкт-Петербурге).
Рафинирование меди
Медь является лучшим материалом для изготовления проводников, но для этого она должна быть лишена каких бы то ни было примесей. Очищение меди от примесей называется рафинированием (очисткой) меди. Массивные куски (толстые листы) неочищенной меди, полученной при выплавке из руды, являются анодом, а тонкие пластинки из чистой меди — катодом. Процесс происходит в больших ваннах с водным раствором медного купороса. При электролизе медь анода растворяется; примеси, содержащие ценные и редкие металлы, выпадают на дно в виде осадка (шлама), а на катоде оседает чистая медь. Таким же образом производят рафинирование некоторых других металлов.
Получение алюминия
При помощи электролиза получают алюминий. Для этого подвергают электролизу не растворы солей этого металла, а его расплавленные оксиды.
В угольные тигли (рис. 3.9) насыпают глинозем (оксид алюминия Аl2O3), полученный путем переработки бокситов — руд, содержащих алюминий. Тигель служит катодом. Анодом являются угольные стержни, вставленные в тигель. Сначала угольные стержни опускают до соединения с тиглем и пропускают сильный ток. Глинозем при прохождении тока нагревается и расплавляется. После этого угли поднимают, ток проходит через жидкость и производит электролиз. Расплавленный алюминий, выделяющийся при электролизе, опускается на дно тигля (катод), откуда его через особое отверстие выпускают в формы для отливки.

Описанный способ получения алюминия сделал его дешевым и наряду с железом самым распространенным в технике и быту металлом.
Путем электролиза расплавленных солей в настоящее время получают также натрий, калий, магний, кальций и другие металлы.
Электролиз используется для гальваностегии, гальванопластики, рафинирования меди, получения алюминия и др.
Электролизом называется химический процесс при постоянном токе, заставляющий перемещаться ионы в требуемом направлении. Этот процесс нашел применение в многих отраслях промышленности – химической, металлургической и других. Любой раствор состоит из частиц, которые имеют положительный и отрицательный заряды.
Такое состояние является нестабильным, так как противоположные заряды притягиваются. Таким образом появляется частица с нейтральным зарядом или другими словами новая молекула другого вещества. В статье будет описан механизм электролиза, как он происходит, работает, в каких сферах он нашел применение.

В чём заключается процесс
Для организации процесса перемещения ионов в растворе нужно только два электрода и источник тока. Положительно заряженный электрод, называемый анодом, способствует окислению анионов, то есть отрицательно заряженных частиц, а также нейтральных молекул. Катод, то есть отрицательно заряженный электрод, притягивает к себе положительно заряженные ионы и нейтральные молекулы.
Особенности процессов, происходящих на катоде, заключаются в том, что здесь восстанавливаются обычно сильные окислители. Таким образом, с помощью двух пластинок с разницей потенциалов, помещённых в электролит, можно получать новые вещества, менять состояние электродов и раствора.
Электролиз широко применяется для осуществления следующих процессов:
- Получение веществ в чистом состоянии.Этот процесс используется для того, чтобы обработать горные породы и получить чистые вещества. Так образуются алюминий, двуокись марганца, водород, перекись водорода.
- Очистка сточных вод.В результате помещения в такие растворы электролитов происходит не только обеззараживание воды, но и образование взвесей, которые выпадают в осадок.
- Нанесение тонких покрытий.Под воздействием тока ионы металла осаждаются на предмете, формируя тонкую декоративную или защитную плёнку.
Этот список на самом деле гораздо обширней, поскольку с помощью разницы потенциалов можно с минимальными затратами добиваться значительного эффекта для разных целей.
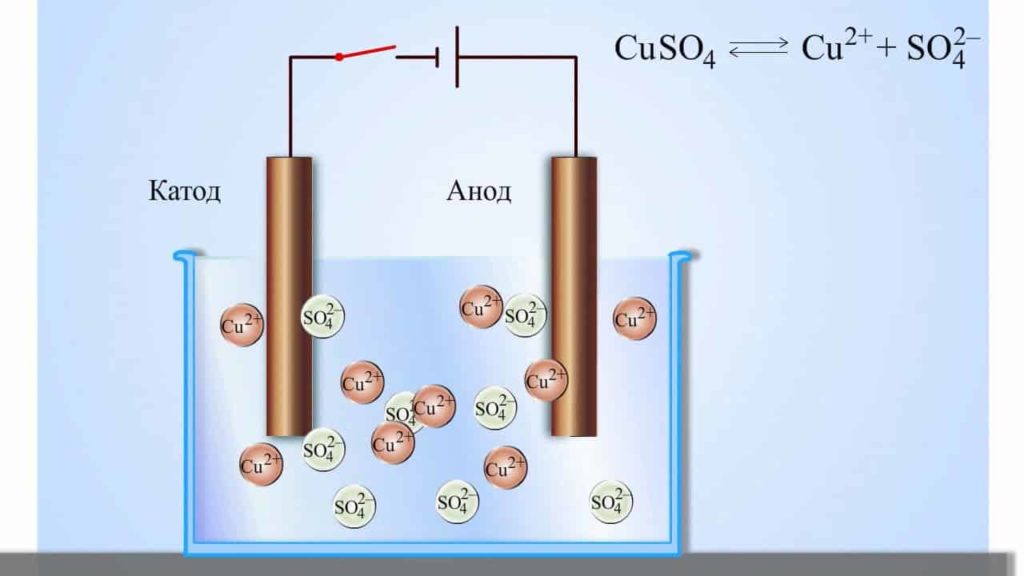
Правила электролиза водных растворов
Электролиз на катоде зависит только от положения металла в электрохимическом ряду напряжений:
- если катион электролита стоит левее алюминия (включительно), на катоде восстанавливается вода с выделением водорода, а катионы металла остаются в растворе:
2H2O+2e – = H2↑+2OH – (Li…Al) - если катион электролита стоит между алюминием и водородом, на катоде восстанавливаются и вода, и катионы металла;
Me n+ +ne – = Me ; 2H2O+2e – = H2↑+2OH – (Mn…Pb) - если катион электролита стоит правее водорода, на катоде восстанавливается только катионы металла:
Me n+ +ne – = Me (Cu…Au) - если в растворе электролита находится несколько металлов, первыми восстанавливаются катионы металла, который в ряду напряжений стоит правее остальных.
- Электролиз на анодезависит только от материала, из которого изготовлен анод:
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза – железо, медь, цинк, серебро) – всегда идет процесс окисления металла анода:
Me -ne – = Me n+ - в случае нерастворимого анода (золото, платина, графит):
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
Ac m -me – = Ac - идет процесс окисления воды в остальных случаях (электролиз оксикислот и фторидов) – анион остается в растворе:
2H2O-4e – = 4H + +O2↑ - при электролизе растворов щелочей окисляются гидроксид-ионы:
4OH – -4e – = 2H2O+O2↑
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
![Получение рафинированной меди.]()
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
![Электрометаллургия.]()
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
![Что такое электролиз и где он применяется на практике]()
При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.
![Результат гальваностегии.]()
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Электрофорез
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
![Что такое электролиз и где он применяется на практике]()
В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность.
Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы. Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду.
![Что такое электролиз.]()
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху. Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).
Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора. Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
![Электролиз медного купороса.]()
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
![Что такое электролиз и где он применяется на практике]()
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе.
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
![Таблица электролиз расплавов и растворов веществ]()
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n: mэ = А / 96480n, здесь 96480 – число Фарадея, Кл х моль -1 .
Таким образом, электрохимический эквивалент вещества α= А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой). Для меди А = 63,54, n =2, α =63,54/96480 -2 = 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α=0,00034 г/Кл. В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами.
![Химические реакции при электролизе.]()
Теоретическая часть
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
![Электролиз расплавов оснований.]()
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).
Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к. элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока. Электролиз растворов На катоде могут протекать следующие реакции восстановления.
![Электролиз расплавов оснований.]()
Катодные процессы: Li K Ca Na Mg Al Li+K +Ca2+Na+Mg2+Al3+ Mn Zn Fe Ni Sn Pb Mn2+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H2 2H+ Cu Hg Ag Pt Au Cu2+Hg2 2+Ag+ Pt2+Au3+ Восстанавливается вода: 2H2O+2ē=H2↑+2OH− ; M n+ не восстанавливается Восстанавливаются катионы металла и вода: Mn++nē=M0 2H2O+2ē=H2↑+2OH−Восстанавливаются катионы металла: M n++ nē=М0 а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений после водорода, происходит выделение металлов на катоде: (-) Cu2++ 2ē → Cu. б) при электролизе растворов солей, содержащих катионы, расположенные между алюминием и водородом, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода: (-) Zn2++ 2ē → Zn; (-) 2H2O + 2ē → H2↑ + 2OH– . в) если растворы солей содержат катионы, находящиеся в ряду напряжения до алюминия, то в водном растворе такие ионы восстановленными быть не могут, на катоде выделяется водород: (-) 2H2O + 2ē → H2↑ + 2OH– . Процесс на аноде зависит от материала анода и от природы аниона. На аноде протекают реакции окисления.
Цели. 1. Сформировать представление о практическом применении электролиза в основной химической промышленности, электрометаллургии, медицине, металлообрабатывающей отрасли промышленности.
2. Развивать умение работать с дополнительной литературой, сайтами Интернета, конспектировать, выбирать главное, делать выводы.
Оборудование и реактивы. Мультимедийная установка, презентация, электролизер, коллекция веществ, полученных с помощью электролиза (азотная кислота, кальций, гидроксид натрия и другие), электронная плата.
1. Организационный момент. Проверка готовности.
2. Подготовка к работе. (Проверка знаний, умений и навыков.)
Задания для учащихся.
• У доски – записать пример электролиза расплава.
• Ученик у доски с помощью электролизера объясняет, как проходит электролиз раствора хлорида меди.
![]()
3. Изучение нового материала и поэтапная проверка его усвоения.
Учитель. Разобраться с материалом новой темы нам помогут специалисты различных профессий: историк, литератор, химики-технологи, медик, инженер автомобильного завода.
Историк. В 1962 г. работавшая вблизи Багдада американская археологическая экспедиция обнаружила серебряные украшения с хорошо сохранившейся позолотой. Согласно предположениям, они принадлежали древним жителям Двуречья – шумерам, цивилизация которых существовала около пяти тысяч лет назад. Для тонкослойного золочения серебряных изделий в наше время существует единственный способ – электролиз. Неужели шумерские ремесленники умели использовать электролиз при выполнении ювелирных работ?
Обратимся к более близким к нам временам.
Изобретенный им в 1800 г. источник постоянного тока Вольта назвал в честь умершего в 1798 г. Гальвани гальваническим элементом. Состоял гальванический элемент из нескольких десятков кружков серебра (или меди) и такого же количества кружков цинка, чередовавшихся с ними и разделенных пористыми прокладками, пропитанными раствором соли.
Открытия Гальвани и Вольта ознаменовали рождение новой науки – электрохимии.
Первый гальванический элемент
В XIX в. открытия в области электрохимии следовали одно за другим. Уже в 1800 г. Г.Дэви осуществил электролиз воды. У.Николсон и А.Карлейль обнаружили, что при электролизе водных растворов образуются кислород и водород, выделяющиеся, к удивлению исследователей, на электродах раздельно.
Этот парадокс разрешил К.Гротгус, предложивший в 1805 г. первую теорию электролиза, основанную на представлении о дипольном характере молекул воды. В 1807–1808 гг. Дэви посредством электролиза расплавов получил металлы: натрий, калий, магний, кальций, стронций и барий.
Также большой вклад в развитие электрохимии внесли русские ученые В.В.Петров и А.Н.Фрумкин, шведский ученый С.Аррениус и др.
Учитель. Рассмотрим практическое применение электролиза. Ваша цель – по ходу заполнить таблицу (таблица).
Учитель. Исходя из того материала, который вы изучали раньше, какой прогноз можно сделать по применению электролиза в основной химической промышленности? А по применению электролиза в электрометаллургии?
Задание (подсказка): по образцам веществ, имеющимся на лотке, объяснить способ их получения с помощью электролиза.
Учащиеся объясняют, как можно получить азотную кислоту, кальций, гидроксид натрия и другие вещества, заполняют в таблице две верхние строчки.
Литератор. В состав названия какого металла входит новогоднее дерево?
(О т в е т. Никель.)
В состав названия какого металла входит любимый пиратский напиток?
Учитель. Как можно получить никель и хром?
Иду на мелкую монету,
В колоколах люблю звенеть,
Мне ставят памятник за это
И знают имя мое – …Учитель. Как получают особо чистую медь?
Из глины я обыкновенной,
И на редкость современный,
Не боюсь электротока,
Служу на кухне я без срока,
Бесстрашно в воздухе лечу,
Мне все задачи по плечу.
Легки конструкции из дюрали,
Не перечислить всех регалий,
Горжусь я именем своим,
Зовусь я …(О т в е т. Алюминий.)
Учитель. Как получают алюминий?
Учащиеся отвечают, вспоминают сырье, вспомогательные материалы, химический процесс, особенности технологии.
Он с морской капустой дружит
И лекарством людям служит,
Знает млад и стар народ –
Коль ушиб, то нужен …Учитель. Что объединяет вещества, о которых шла речь в загадках?
Медик. Сначала проведем физкультминутку.
Упражнение для улучшения мозгового кровообращения: исходное положение – стоя; на счет 1–2 – плавно наклонить голову назад, на счет 3–4 – плавно наклонить голову вперед; повторить четыре раза, темп медленный.
Упражнение для снятия утомления с плечевого пояса и рук: исходное положение – стоя; кисти тыльной стороной на поясе; на счет 1–2 – свести локти вперед, голову наклонить вперед; на счет 3–4 – локти назад, прогнуться; повторить шесть раз; затем руки опустить вниз и потрясти расслабленно; темп медленный.
Упражнение для гимнастики глаз: быстро поморгать, закрыть глаза и медленно досчитать до пяти.
Медик. Теперь поговорим об использовании электролиза в медицине.
Электрофорез – это использование явлений электролиза для ввода лекарств через кожу.
Электроды, представляющие собой гибкие металлические пластины, накладываются на тело. Между телом и электродом прокладывается фланель, бязь, обезжиренная кипячением, иногда просто фильтровальная бумага. Прокладка пропитывается лекарственным раствором, электроды подключаются к источнику постоянного электрического тока, и процесс ввода лекарств начинается. Материалом электрода может служить платина, золото, серебро, латунь, алюминий, свинец.
Один из аппаратов для электрофореза
Выбор металла обусловлен составом лекарственного соединения: входящие в него вещества должны быть инертны по отношению к данному металлу. Наиболее часто применяют листовой свинец: он легко принимает форму поверхности, его можно резать ножницами, придавая пластинке любую форму. Под влиянием приложенного напряжения ионы начинают перемещаться по телу человека. Таким образом, через кожу вводятся в организм человека антибиотики, йодистые препараты, другие сложные лекарственные соединения. С током лимфы и крови они разносятся по всему организму.
Учитель. Теперь поговорим об использовании электролиза с растворимым анодом. Вы могли слышать о хромированной, оцинкованной, никелированной стали. Мы видим никелированные и хромированные детали на автомашинах, дверные и оконные ручки, шпингалеты, наборы слесарных инструментов, оцинкованное кровельное железо.
Инженер автомобильного завода. Гальваностегия – это покрытие одного металла тончайшим слоем другого металла (например, слоем хрома, серебра, золота, меди, никеля) с целью защиты от коррозии, от истирания, для придания красивого декоративного вида предметам.
Покрываемое другим металлом металлическое изделие служит катодом в электролизере. А в качестве растворимого анода используется тот металл, который применяется для покрытия. Часто применяется многослойное покрытие. Например, на Волжском автомобильном заводе для более прочного соединения покрытия с поверхностью сначала проводят меднение. Предварительно детали обезжириваются, промываются, а затем поступают в ванны в качестве катодов, на которые откладывается медь. Затем аналогичным способом наносится слой никеля и хрома. Нанесенные электролизом покрытия получаются ровными по толщине, прочными. Так получают внешние детали автомобиля, бамперы, диски, колпаки колес.
Применяется специальное пористое покрытие хромом шеек валов, подшипников, цилиндров двигателей в тех местах, где требуется сохранение смазки, т.к. гладкая поверхность смазки не удерживает.
Некоторые детали двигателей внутреннего сгорания (подвергающиеся сильному трению, работающие при высокой температуре) кадмируют, что обеспечивает антикоррозионные свойства, придает поверхности высокую твердость и прочность.
Историк. Золочение куполов на храмах до открытия электролиза было делом опасным. Золото смешивали с ртутью и получали амальгаму (так называется сплав металлов с ртутью). Амальгаму наносили на медные листы, предназначенные для покрытия купола, и нагревали. Ртуть испарялась, золото прочно оседало на меди. Так золотили купола Исаакиевского собора в Санкт-Петербурге. В ходе этих работ от ртутного отравления погибло свыше 80 мастеров. А вот при постройке храма Христа Спасителя в Москве в честь победы 1812 г. использовали уже электролиз. Медные листы играли роль катода. На них осаждалось золото из раствора.
В Санкт-Петербурге в 1847 г. были изготовлены с помощью гальваностегии художественные двери, барельефы, фигуры, которые поражали посетителей Эрмитажа и Исаакиевского собора своей красотой, блеском и величием. Покрытия прослужили более 120 лет без реставрации и сохранили не тронутыми коррозией художественные ценности. На все эти работы было израсходовано около 109 т меди, 700 кг золота, хотя толщина покрытий составляла всего 0,01–0,02 мм.
1-й химик-технолог. Гальванопластика – это получение точных металлических копий с той или иной рельефной поверхности. Для этого сначала изготавливают копию: покрывают воском, дают воску застыть и получают восковую матрицу, на которой все углубления копируемого предмета будут выпуклостями. Внутреннюю поверхность матрицы покрывают тонким слоем графита, проводящего электрический ток. Этот графитовый катод опускают в ванну с раствором сульфата меди, анодом служит медь. При электролизе медный анод растворяется, а на катоде осаждается медь. Таким образом, получается точная металлическая копия предмета. Впервые этот способ был применен в 1836 г. Борисом Семеновичем Якоби.
Материальные носители информации:
грампластинка, компакт-диск, флеш-накопительГальванопластика применяется для изготовления грампластинок, различного рода клише, пресс-форм для прессования изделий из пластмасс, полых толстостенных труб, тонких сит, различных полых деталей точных размеров и сложной формы, которые нельзя изготовить механически.
Таким же способом изготавливают электронные схемы, которые являются основой телевизора, компьютера, радиоприемника. Для того, чтобы сделать схему, необходимо спаять огромное множество контактов. Паяние не способствует точности, т.к. в местах пайки повышается электрическое сопротивление. Да и будет такая схема слишком громоздкой. Поэтому на специальную пластмассовую пластинку – плату – по заданному чертежу наносят электролизным путем тонкий слой металла, который в точности повторяет чертеж. Такая плата очень точна, компактна, имеет небольшую массу, что позволяет собирать миниатюрные компьютеры, телевизоры. (Демонстрация платы.)
2-й химик-технолог. Используют также и анодное окисление. Например, на изделии из алюминия хотят получить пористую оксидную пленку, которая предохранит детали от коррозии и способна впитывать краситель, поэтому поверхность можно сделать бронзового, золотистого и другого цвета. Изделие из алюминия помещают в качестве анода в раствор серной кислоты. На катоде выделяется водород, на аноде – кислород. Растворения анода не будет, т.к. алюминий активно окисляется кислородом. Естественная оксидная пленка заметно утолщается. Так получают окрашенную в различные оттенки алюминиевую фольгу, анодируют корпуса наручных часов и многое другое.
Учитель с учениками проверяют заполнение таблицы, обсуждают, обмениваются вопросами.
Учитель. Электролиз имеет много достоинств. Но есть и недостатки. При электролизе в атмосферу могут выделяться ядовитые вещества. Поэтому надо применять меры, предупреждающие загрязнение окружающей среды. Это удорожает производство. Но сохранность природы – это сохранение самой жизни на Земле.
4. Закрепление.
Учитель. Перечислить все области применения электролиза практически невозможно, ибо с каждым днем их становится все больше и больше. Назовите основные области применения электролиза.
Учащиеся отвечают, повторяют материал.
5. Рефлексия. Подведение итогов.
На каких этапах урока вам было трудно? Легко?
Какой вид работы вам был интересен?
Ученики отвечают, учитель выставляет оценки, комментирует.
6. Домашнее задание.
Л и т е р а т у р а
Гузей Л.С., Суровцева Р.П. Химия. 10 класс. М.: Дрофа, 2002; Некрасов Л.Н. Электрохимия: история становления и характерные особенности как самостоятельной науки. Химия в школе, 2002, № 10, с. 6–14.
Читайте также:
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза – железо, медь, цинк, серебро) – всегда идет процесс окисления металла анода: