Атомно молекулярное учение ломоносова доклад
Обновлено: 02.07.2024
2 Цель: Узнать как развивается современная наука и какие изобретения появились (появятся в будущем), благодаря научной деятельности Ломоносова.
3 Задачи: Раскрыть тему Раскрыть тему Изложить проблему Изложить проблему Изучить проблему Изучить проблему Собрать материал Собрать материал Сделать вывод. Сделать вывод.
4 М.В. Ломоносов Ломоносов Михаил Васильевич (19 ноября апреля 1765) первый русский ученый– естествоиспытатель, поэт, филолог, художник, историк, просветитель. Он вошёл в науку как первый химик, который дал физической химии определение, весьма близкое к современному, и предначертал обширную программу физико- химических исследований; его молекулярно-кинетическая теория тепла во многом предвосхитила современное представление о строении материи
6 Нанотехнология Нанотехнология междисциплинарная область фундаментальной и прикладной науки и техники, имеющая дело с совокупностью теоретического обоснования, практических методов исследования, анализа и синтеза, а также методов производства и применения продуктов с заданной атомной структурой путём контролируемого манипулирования отдельными атомами и молекулами.
8 Нанотрубки Углеродные нанотрубки это протяжённые цилиндрические структуры диаметром от одного до нескольких десятков нанометров и длиной до нескольких сантиметров, состоящие из одной или нескольких свёрнутых в трубку графитовых плоскостей и заканчивающиеся обычно полусферической головкой.
9 Фуллерены Фуллерены молекулярные соединения, принадлежащие классу аллотропных форм углерода и представляющие собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. В настоящее время преобладающая часть научных исследований связана с химией фуллеренов. На основе фуллеренов уже синтезировано более 3 тысяч новых соединений. Столь бурное развитие химии фуллеренов связано с особенностями строения этой молекулы и наличием большого числа двойных сопряженных связей на замкнутой углеродной сфере. Комбинация фуллерена с представителями множества известных классов веществ открыла для химиков-синтетиков возможность получения многочисленных производных этого соединения. Компьютерное моделирование показало, что фуллерены, а именно сферические молекулы C60, представляют потенциальную опасность для молекул ДНК, хранящих генетическую информацию.
12 Графен Графен - углеродный наноматериал. В 2004 г. Андрей Гейм и Константин Новоселов экспериментально доказали возможность получения наноматериала графена - особой формы углерода, представляющей собой лист толщиной в один атом. Он обладает уникальными физико-химическими свойствами, которые делают его незаменимым в самых разных сферах, в частности, в электронике. Графен представляет собой одиночный слой атомов углерода, соединенных между собой структурой химических связей, напоминающих по своей геометрии структуру пчелиных сот. При этом, графен обладает высокой прочностью, он прозрачен в силу своей чрезвычайно малой толщины. Кроме того, графен является прекрасным проводником электрического тока.
13 Применение графена в будущем: Заменит кремний в микросхемах; считается, что чипы на основе графена станут легче, производительнее, стабильнее в работе, будут потреблять меньше электроэнергии и меньше её рассеивать в виде тепла. Придет на смену тяжелым медным проводам в авиации и космонавтике Будет использован при создании гибких сенсорных дисплеев и солнечных батарей Найдет применение в качестве сенсора при обнаружении отдельных молекул химических веществ.
14 Внимание! В ноябре 2011 года на базе АЗЛК был открыт первый цех по производству углеродных тканей. Эти ткани являются сырьём для производства материалов для самолётостроения.
15 Вывод М.В. Ломоносов, создав атомно- молекулярное учение, дал толчок к развитию химии и других наук. Нанотехнология – перспективная область науки, которая уже сейчас помогает нам в быту и других сферах жизни.

Роль М.В.Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения

Роль М.В.Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения
Роль Химии в жизни человека

Роль Химии в жизни человека
Лекарства для больных в аптеке – это химия и она помогает людям выздороветь или убрать боль и т. д.
А Синтетические Вещи? Их Еще Называют Ненатуральные. (пример: искусственная кожа) тоже Химия! Некоторые вещи, если они качественно сделаны, носятся как кожаные и даже лучше
о том, что
осуществляет этим действием сложный химический процесс.
Делаем вывод : химия очень важная часть в жизни человека
Михаил Васильевич Ломоносов Родился: 19 ноября 1711 г
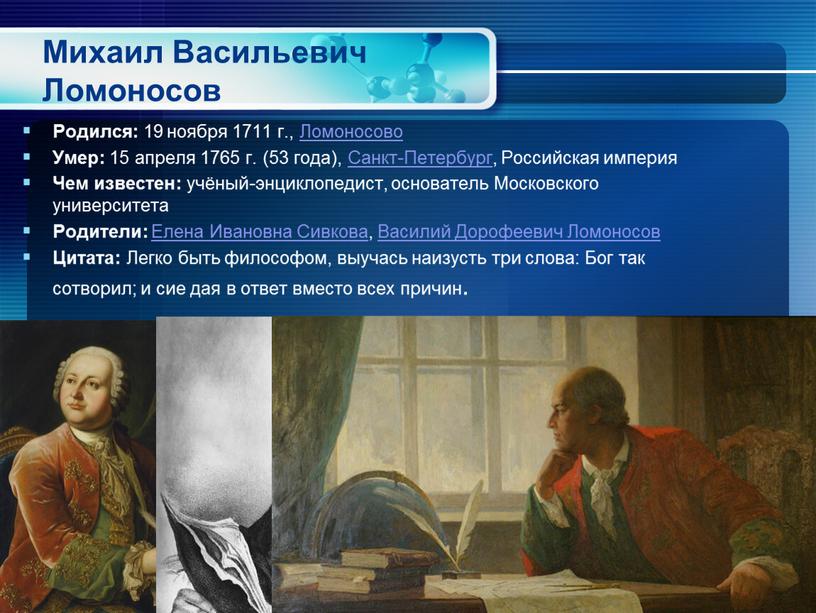
Михаил Васильевич Ломоносов
Родился: 19 ноября 1711 г., Ломоносово
Умер: 15 апреля 1765 г. (53 года), Санкт-Петербург, Российская империя
Чем известен: учёный-энциклопедист, основатель Московского университета
Родители: Елена Ивановна Сивкова, Василий Дорофеевич Ломоносов
Цитата: Легко быть философом, выучась наизусть три слова: Бог так сотворил; и сие дая в ответ вместо всех причин.
Джон Дальтон Английский провинциальный учитель-самоучка, химик, физик, метеоролог, естествоиспытатель и создатель химического атомизма

Английский провинциальный учитель-самоучка, химик, физик, метеоролог, естествоиспытатель и создатель химического атомизма.
Он впервые провёл исследования и описал дефект зрения, которым страдал сам, - цветовую слепоту, позже названную в его честь дальтонизмом.
Родился: 6 сентября 1766 г., Камберленд, Англия, Королевство Великобритания
Умер: 27 июля 1844 г. (77 лет), Англия
Атомно-молекулярное учение Атомно-молекулярное учение-это совокупность теоретических представлений естествознания о дискретном строении веществ

Атомно-молекулярное учение-это совокупность теоретических представлений естествознания о дискретном строении веществ.
В развитие атомно-молекулярного учения большой вклад внесли М. В.Ломоносов, Дж.Дальтон, А.Лавуазье, Ж.Пруст, А.Авогадро, Й.Берцелиус, Д. И.Менделеев, А. М.Бутлеров.
Михаил Васильевич Ломоносов в XVIII в

Михаил Васильевич Ломоносов в XVIII в. разработал учение о молекулах и атомах: • утверждал, что тела в природе состоят из корпускул (молекул) , в состав которых входят неделимые элементы (атомы) . • Многообразие веществ объяснял соединением разных атомов в молекулах и различным расположением атомов в них. • Предполагал, что некоторые молекулы могут состоять из одинаковых атомов.
М.В. Ломоносов и учение о молекулах и атомах
Дж. Дальтон и учение о атомах и молекулах

Дж. Дальтон и учение о атомах и молекулах
В 1808 году английский химик Дальтон сформулировал атомистическую теорию. • Утверждал, что все вещества состоят из атомов, мельчайших неделимых частиц, которые не могут быть ни созданы, ни уничтожены. Ввёл понятие атомного веса. • Дальтон считал, что все атомы одного и того же элемента совершенно идентичны, например, имеют одинаковые массы. • На основе химических законов создал атомистическую теорию, основанную на количественных соотношениях, возникающих при взаимодействии между химическими элементами. Основы используются до сих пор.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
по дисциплине Физика
обучаюшаяся 1 курса группы № 4
Назимова Олеся Юрьевна
Преподаватель: Грибова О.М.
п.Тарасовский
Краткая биография М.В. Ломоносова
Направления творческой деятельности ученого
Работы М.В. Ломоносова в области молекулярной физики и термодинамики
«Достигнутое им одним в области физики,
химии, астрономии, приборостроения,
географии, языкознания, истории
достаточно было бы для деятельности

Михаил Васильевич Ломоносов – великий русский ученый, внес большой вклад в развитие отечественной науки. Он проявил себя в самых разных областях науки и техники: химии, географии, геологии, филологии, литературе и русском языке, истории и др. Михаил Васильевич Ломоносов - человек разносторонних интересов. Ученый работал с мозаикой, вел исследования для развития производства фарфора - создавал фарфоровые пробы, разрабатывая теорию цветоведения, нашел пути решения различных практических задач, которые сегодня применяются в кино, печати, цветной фотографии. Это один из основоположников такой области знания, как физическая химия. Михаил Васильевич был приборостроителем, астрономом, геологом, металлургом, писателем и поэтом, историком, художником Мировое значение имеют его достижения как ученого-естествоиспытателя.
Ломоносов Михаил Васильевич признан одним из самых выдающихся ученых 18 века. Своим умом, широтой мысли, своими суждениями он превзошел великих европейских ученых своего времени. Ему первому суждено было прославить на весь мир русскую науку.
В многосторонней деятельности Михаила Васильевича Ломоносова особое место занимает физика. Одним из наиболее важных научных достижений Ломоносова в области физики является атомно-корпускулярная теория строения вещества и материи .
19 ноября 1711 года – рождение в деревне Мишанинской, (ныне село Ломоносово), нынешней Архангельской области на Курострове.
1730 год – получение паспорта в Холмогорске. Путешествие пешком в Москву.
1731 год – становится учеником первой высшей школы – Московской Славяно-греко-латинской академии, расположенной в Законоспасском монастыре на Никольской улице. Изучение латинского – на котором тогда писались почти все ученые книги, славянского и греческого языков. Жил впроголодь, бедно, но наук не оставил.
1734 год – поступление в Киево-Могилянскую академию и изучение материалов богословия.
1741 год - возвратился в Петербург, принят на работу в Петербургскую Академию наук, где стал читать лекции студентам по географии, химии, горному делу, а также обучал стихотворству и русскому языку. На кафедре естествознания занимается сбором окаменелостей и минералов для Кунсткамеры
1741 год –1742 год – работает помощником профессора физического класса Академии.
1745 год – назначен профессором химии в Академии.
1746 год – читает лекции по физике в Академии.
1748 год – создал первую в России химическую лабораторию.
1752 год – читает лекции по физической химии в Академии.
1753 год – основал стекольную фабрику.
1755год – по инициативе Ломоносова открыт Московский университет.
1755 – 1757 год - М.В. Ломоносов - советник канцелярии Академии наук.
1758 год – руководитель Исторического собрания, академической гимназии, академического университета, Географического департамента.
1760 год – почетный член Шведской королевской академии наук.
1763 год – член Академии трех знатнейших художеств в Петербурге:
живописи, скульптуры и архитектуры.
1764 год – почетный член Академии наук Болонского института.
4 апреля 1765 года – умер в своем доме от воспаления легких. Тело было погребено на Лазаревском кладбище Александро-Невской лавры.
Направления творческой деятельности ученого
Творческую деятельность М.В. Ломоносова условно можно разделить на три периода. Первый период с 1741 по 1748 г. был посвящён, главным образом, теоретическим исследованиям в области физики. Второй период охватывает время от постройки химической лаборатории в 1748 году до 1757 г. В эти годы М.В. Ломоносов в основном занимается решением различных вопросов теоретической и экспериментальной химии. Третий период - это период с 1757 г. до конца его жизни. В течение этого времени М.В. Ломоносов, помимо общих занятий, уделяет много времени работам в области различных прикладных наук и административной деятельности.
М.В. Ломоносов внёс значительный вклад в развитие науки физики, в его научной деятельности физика занимает особое место. В многосторонней деятельности ученого физика была первой областью его научных интересов, способствовала формированию материалистического мировоззрения. Исследования М. В. Ломоносова в области естественных наук можно рассматривать как построение единой естественнонаучной картины мира.
Работы М.В. Ломоносова в области молекулярной физики и термодинамики.
1) в телах имеется тем больше теплоты, чем плотнее их связанная материя, и наоборот. Так, рыхлая пакля загорается бо́льшим пламенем, но дающим гораздо меньше жару, чем она же, сжатая более плотно. Соломою, которая в обычных условиях горит легким пламенем, обитатели плодородных областей России, лишенных лесов, пользуются вместо дров, предварительно связав ее в плотные, толстые жгуты. Более пористые дрова при горении дают меньше жара, чем более плотные, а ископаемые угли, содержащие в своих порах каменистую материю, производят более сильный жар, чем древесные угли, имеющие, наподобие губок, пустые промежутки. Затем, воздух нижней атмосферы, который плотнее воздуха более высокой атмосферы, более чем последний согревает обтекаемые им тела, как свидетельствуют теплые долины, окруженные покрытыми вечным льдом горами.
Какое движение вызывает появление теплоты? Можно целый век возить на телеге дрова, и ни одно полено не нагреется ни на один градус. Но если начать тереть одно полено о другое полено, то оно нагреется очень быстро. Очевидно, поленья, крепко прижатые друг к другу, при трении приводят в движение расположенные на поверхности те мельчайшие частички, из которых они построены. Точно так же и молот, ударяясь о железо, заставляет быстрее двигаться частички железа. Внешнее движение всего тела превращается во внутреннее движение частичек, из которых оно состоит. Это-то движение частичек и есть теплота. И этим можно объяснить все тепловые явления.
При нагревании твердого тела его частички двигаются все быстрее и сильнее отталкиваются друг от друга. Промежутки между частицами увеличиваются - оттого и расширяются тела при нагревании. Чем теплее тело, тем быстрее движутся его частички. При дальнейшем нагревании промежутки между частичками становятся столь значительными, что тело не может сохранять прежнюю форму - оно растекается, расплавляется. А когда скорость движения частичек становится настолько большой, что частички разлетаются во все стороны, происходит испарение.
М. В. Ломоносов показал физическую несостоятельность теории теплорода и развил идеи о кинетической теории теплоты. Эта теория была революционной для своего времени, поэтому чаще отвергалась его современниками, чем принималась. Ученый дал по сути современную молекулярно-кинетическую трактовку теории теплоты. Он считал, что теплота состоит во внутреннем движении материи, то есть в теплых и горячих телах движутся нечувствительные частицы, из которых состоят сами тела. Его "корпускулярная философия" стала логическим центром всех естественно-научных достижений Михаила Васильевича Ломоносова.
Можно ли представить себе самую большую возможную степень теплоты (температуру)? Очевидно, нет, потому что скорость движения частичек может возрастать и возрастать. Наоборот, чем холоднее тело, тем меньше скорость движения его частичек, а когда оно прекратится полностью, наступит самая низкая возможная степень теплоты. Ломоносов доказывает, что ". движение может настолько уменьшиться, что, наконец тело достигает состояния совершенного покоя - и никакое дальнейшее уменьшение движения невозможно. Следовательно, по необходимости должна существовать наибольшая и последняя степень холода, состоящая в полном покое частичек, в полном отсутствии вращательного движения их".
Самой высокой температуры тела не существует, при повышении температуры тело может перейти из одного агрегатного состояния в другое (например – плавление твердых тел, испарение жидкостей и др.), а самая низкая температура тела объяснима с точки зрения молекулярного строения тел. Ломоносов указал на возможность существования абсолютного нуля температуры с точки зрения понятий кинетической теории теплоты, отмечая, что полное прекращение движения частиц существует при наибольшей и последней степени холода. Так ученый впервые в истории науки ввел понятие об абсолютном нуле температуры.
"Господин Арнольд, - указывалось в этом отчете, - совсем опровергает, принимая в свои доказательства также и господина Ломоносова, некоторые предположения, но выводя из них противное нововыдуманной теории".
Сам Эйлер высоко оценил работу Ломоносова. В ответном письме он писал: "Недобросовестность и слог немецких газетчиков мне очень хорошо известны и нисколько не трогают меня: я смеюсь, видя, как они терзают прекраснейшие сочинения. Надобно презирать подобные статьи… всякий знает, что появившиеся до сих пор трактаты о причинах теплоты еще не разъяснили вполне этого предмета, и занимающиеся его исследованием заслуживают величайшей похвалы. Вас нельзя не поблагодарить за то, что Вы рассеяли мрак, покрывавший доселе этот вопрос".
Работа Ломоносова о причине теплоты не только была известна, но и вызвала большую дискуссию. Имя русского ученого в Европе было известно еще ранее, т. к. одновременно с сочинениями о природе теплоты в журнале, издаваемом академией на латинском языке и рассылаемом всем иностранным академиям и университетам, были напечатаны еще три статьи Ломоносова, в том числе его замечательная работа "Попытка теории упругой силы воздуха", в которой он впервые дал строго обоснованную кинетическую теорию газов.
Можно говорить не только о приоритете Ломоносова в создании теории теплоты, основанной на молекулярно-атомистических представлениях, но и о том, что эта теория, как и другие его исследования, была в свое время хорошо известна ученым всего мира и широко обсуждалась.
Теория Ломоносова позволила также объяснить изменения плотности воздуха с высотой и предсказать наличие границы атмосферы: «Чем дальше от земли отстоят остальные атомы, тем меньшую массу толкающих и тяготеющих атомов встречают они в своем стремлении вверх; так что верхние атомы, занимающие самую поверхность атмосферы, только своей собственной тяжестью увлекаются вниз и, оттолкнувшись от ближайших нижних, до тех пор несутся вверх, пока полученные ими от столкновения импульсы превышают их вес. Но как только последний возьмет верх, они снова падают вниз, чтобы снова быть отраженными находящимися ниже. Отсюда следует:
что атмосферный воздух должен быть тем реже, чем более он отделен от центра земли;
Объясняя упругость воздуха, он совершенно ясно и четко утверждает, что взаимодействие атомов воздуха обусловлено только теплотой. Отсюда более теплое тело обладает более быстрым вращением своих частиц, а последние ускоряют вращение частиц более холодного тела, причем движение последних увеличивается настолько, насколько уменьшается движение первых. Ломоносов правильно отметил, что для сильно сжатого воздуха этот закон не соблюдается, причина этого — конечный размер молекул воздуха. Эта идея Ломоносова была применена во второй половине XIX в. Ван-дер-Ваальсом при выводе уравнения состояния реальных газов. Представления о молекулярном строении газов, которые развивал Ломоносов, не являлись совсем новыми. До Ломоносова уже Даниил Бернулли, исходя из молекулярных представлений, объяснил закон Бойля — Мариотта. Однако следует отметить, что никто из предшественников Ломоносова не разработал так обстоятельно молекулярную модель газа и не связал ее с кинетической теорией теплоты, как он.
Критикуя теорию "блуждающей жидкости", Ломоносов пишет в указанной работе: "Действительно, мы считаем излишним призывать на помощь для отыскания причины упругости воздуха ту своеобразную блуждающую жидкость, которую очень многие - по обычаю века, изобилующего тонкими материями, - применяют обычно для объяснения природных явлений. Мы довольствуемся тонкостью и подвижностью самого воздуха и ищем причину в самой материи его".
“ Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет. Сей всеобщей естественной закон простирается и в самые правила движения: ибо тело, движущее своею силою другое, столько же оные у себя теряет, сколько сообщает другому, которое от него движение получает”. Однако об этих замыслах ученого стало известно только сто лет спустя, в то время как в 1774 году французский ученый Антуан Лоран Лавуазье издает работу на эту тему, где описывает опыты, подобные опытам Ломоносова о законе сохранения вещества. Ломоносов не опубликовал результаты своих опытов, поэтому его причастность к установлению закона сохранения вещества была установлена только в нашем столетии. Достоверно неизвестно, почему Ломоносов не обнародовал свои экспериментальные наблюдения. Вряд ли это можно объяснить боязнью выступить против авторитета Бойля. Ломоносов не был склонен умалчивать свои достижения в области наук, рассматривал их не только как свой личный успех, но и как успех молодой русской науки.
Еще одним направлением в современной науке, основоположником и методологом которой был Михаил Ломоносов, является физическая химия. В 1752 году он начал читать студентам курс лекций, основной идеей которых является попытка объяснить химические явления на основе имеющихся знаний о строении вещества. Занимаясь построением физической картины мира Ломоносов поставил задачи исследования связей между различными физическими явлениями – плавлением и электризацией, кристаллизацией и электрическом взаимодействием тел . В планах опытных исследований Ломоносова встречается множество физических экспериментов, которые не были характерны и общеприняты для времени, когда жил Ломоносов. Они приобретают значение в физике XIX в., когда перед ней встали новые задачи исследования связей между различными физическими явлениями.
Пери од с 1200 по 1700 г. в ис тори и химии принято называть алхимическим. Движущей силой алхимии в течение 5 веков являлся бесплодный поиск некое го философского камня, прев ращающего бла городные металлы в з олото. Однако, несмотря на всю абсурдность основной идеи, алхимия накопила богатей ший арсенал определенных знаний и практических прие мов, позв оляющих осуще ствлять многообразные химические превращения. В начале XVIII в. накоп ленные знания приобретают практиче скую важность, что связано с началом интенсивного развития металлургии и с необходимостью объяснит ь сопутствующие процессы горения, окисления и восстановления. Перенесение интересов в актуальную практическую сфе ру человеческой деятельности позволило с тавить и решать задачи, приведшие к открытию основных законов химии, и способствовало становлению химии как науки.
Исключительное значение для развития химии имело атомно-мо лекулярное учение, колыбелью которого является Древняя Греция. Атомистика древнегреческих материалистов отделена от нас 25-ве-ковым периодом, однако логика греков поражает настолько, что философское учение о дискретном строении материи, развитое ими, невольно сливается в сознании с нашими сегодняшними представлениями.
Как же зародилась атомисти ка? Основ ным научным методом древнегреческих философов явля лись ди скуссия, спор. Для поиска “первопричин” в спорах обсуждались многие ло гические задачи, одной из котор ых яв лялась задача о камне: чт о произойдет если нач ать его дробить? Большинствофилософов считало, что этот проц есс можн о продолжать бесконечны . И только Л евкип (500—440 до н. э.) и его школа утверждали, что этот процесс не бесконечен: при дроблении в конце концов получится такая частица, дальнейшее деление которой будет просто невозможно. Основыв аясь на этой концепции, Левки пп утверждал: м атериальный мир дискретен, он состоит из мельчайших частиц и пустоты.
Уч еник Левкиппа Демокрит (460—370 до н. э.) назвал мельчайшие частицы “не делимые”, что по-гречески з начит “ато м”. Это название мы и сп ольз уе м и сегодня. Демокрит, разви л новое учение — “атомистику”, приписал атомам такие “современные” свойства, как размер и форму, способность к движению.
Последователь Де мокрита Эпикур (342—270 до н. э.) придал древнегре ческой атомистике зав ершен ность, предположив, что у атомов существует внутренний источн ик дви жения и они сами способны взаимодейств овать друг с другом.
Все положе ния древнегреческой атомистики в ыглядят удивитель но современно, и нам они, ес те ственно, понятн ы. Ведь любой из нас, ссылаясь на опыт науки, может описать множество интересных эк спериментов, подтверждающих справ едливость любой из выдвинутых концепций. Но сов ершенно непонятны они были 20--2 5 веков назад, поскольку н икаких экспериментальных док азательств, под тверждающи х справ едливость своих идей, древ негрече ские атомис ты представить не могли.
Итак, хотя атомисти ка древних греков и выглядит удив ительно современно, ни одно из ее положен ий в то время не было дока зано. Следовательно” атомистика, развитая Л ев к и п п о м, Демокритом и Э п и кур о м, была и о стается просто догадкой, с мелым предположением, философской концепцией, но подкрепленной практикой. Это привело к тому, что одна из гениальных догадок чело веческого разума постепенно была предана забвению.
Были и другие причины, из-за которых учение атомистов было надолго забыто. К сожалению, атомисты не оставили после себя систематических трудов, а отдельные записи с поров и дис куссий, которые были сделаны, лишь с трудом позволяли составить п равильное представление об учени и в целом. Главное же заключается е том, что многие концепции атомистики были еретичны и официальная церковь не могла их поддерживать.
Об учении атомистов не вспоминали почти 20 веков. И лишь в XVII в. идеи древнегреческих атомистов были возрождены благодаря работам французского философа Пьера Гассенди (1592—1655 гг.). Почти 20 лет он потратил; чтобы восстановить и собрать воедино забытые концепции древнегреческих филос офов, которые он подробн о изложил в св оих трудах “С) жизни, нравах и учении Эпикура” и “Свод филосо фии Эпикура”. Эти две книги, в которых воззрения древнегречески х материалис тов впервые были изложены системат ически, стали “учебником” для ев ропе йски х учен ых и философов. До этого единственным источником, дав ав шим информацию о воз зренияхД е м о к р и т а -а э п и к у р а, была поэма римс кого поэта Л у к р е ц и я “О природе вещей”.
История науки знает немало удивитель ны х совпадений. Вот одно и з них: возрож де ние древнегречес кой атом истики сов пад ае т по време ни с установ лением Р. Бойлем (1627 —1 691 гг.) фунда ментальной закономерности, описывающей и зменения об ъема газа от его давления. Ка чест венное объяснен ие фактом, наблюдаемых Бойлем, может дать тол ько атомистика: если газ име ет дис кретно е строение, т. е. состоит и з атомов и пуст оты, то легкость его сжатия обусловлена с ближением атомов в результате уменьшени я свободного пространства м ежду ними.
Перв ая робкая попытка прим ен ения атом исти ки для объяснения коли чественно наблюдаемых явлений природы позволяет сде лать два очень важных вывода:
1. Превратившись из философской гипотезы в научную концепцию, атомистика может стать мощным инструментом, позволяющим давать единственно правильную трактовку самым разнообразным явлениям природы.
2. Для скорейшего превращения атомистики из философской ги потезы в научную концепцию доказательство существования атомов необходимо прежде всего искать при изучении газов, а не жидких и твердых веществ, которыми до этого занимались химики.
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ: водород, кислород, азот, хлор. А несколько поз же газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения.
Зак он сохранения массы. Исключительное значение для химии имело установление закона сохранения массы, являющегося следствием всеобщего естественного закона сохранения материи и движения, сформулированного М.В.Ломоносовым (1711—1765 гг.) как всеобщий естественный закон в 1748 г. в письме к Д. Э йлер у: “ Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присов окупится к другому, ежели, где убудет несколько материи, то умножится в другом месте. Сей всеобщий закон простирается и в самые прав ила движения; ибо тело, движущее своей силой другое, столько же он у себя теряет, сколько сообщает другому, которое от него движ ен ие получает” (Ломоносов М. В. Труды по физике и химии.— М., 1951.— Т. II.-" С. 188).
Эт о положение, высказанное в виде философской концепции. М. В. Ломонос ов подтвердил экспериментально в 1756 г., пов торив опыты Р. Б о и л я по прокалив анию металлов в запаянных стеклянных сосудах (ретортах). Русс кий учены й уста нови л, что ес ли сосуд, содержащи й мета лл, взв есить до и после прокалив ания, не вскрыв ая его, т о масса ос тается бе з изм енений . При наг ревании же металла во вскрытой реторте ма с са ув ели чива ется з а счет его с оединени я с воздухом, пр оникающим в сосуд.
Ан алоги чных вы воды на основе э кспе римен том по прок аливанию м еталл ов сделал в 1777 г. и А. Лав уазье (1743- -179 4 гг.), которы й (после открыти я и 1774 г. Д. Пристли кислорода) уже зн ал ка че ственный и количественный соста в воз дух а.
Например, оксид углерода (IV) можно получить по любой и з указанн ых ниже реакций:
С+О2=СО2; 2СО+02= 2С02; СаСОз= С02+С аО
В химически чистом образ це этого окс ида всегда содержится 27,29% С и 72,71% О. Отклонение от указанного состава свидетельствует о присутствии примесей. Утверждение, обратное закону о постоянстве состава веществ: каждому определенному составу отвечает только одно химическое соединение, неверно. Действительно, диметиловый эфир и этиловый спирт имеют одинаковый химический состав — С2НбО, но отличаются друг от друга структурой молекул, т. е. порядком соединения в них атомов (изомеры).
Закон эквивалентов. Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам (В. Рихтер, 1792—1794 гг.). Понятие эквивалента введено в химию для сопоставления соединительной способности различных элементов. Эквивалентом химиче ского элемента называют такую его массу, которая соединяется с 1,008 ч. м. (части массы) водорода или 8 ч. м. кислорода или з амещает эти массы в соединениях*
Отметим, что один и тот же элемент может иметь не один, а несколько эквивалентов. Так, эквивалент углерода в оксиде углерода (IV) равен трем, а в оксиде углерода (II) — шести.
Понятие эквивалента можно распространить и на сложные соединения типа кислот, солей и оснований.
Эквивалентом сложного соединения называют массу этого соединения, содержащую эквивалент водорода (кислоты) или эквивалент металлической составной части (основания, соли).
В общем виде закон эквивалентов можно сформулировать следующим образом:
Во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными.
Закон кратных отношений. Если два элемента образуют друг с Другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа (Д. Дальтон, 1803 г.).
^Д. Дальтон (1776—1844 гг.) в дальнейшем, используя открыт ый им закол кратных отношений, закон эквивалентов и закон постоянства состава, создал новую версию атомистической теории, основан ную на количественных соотношениях, возникающих при взаимодействии между химическими элементами.
Нетрудно убедиться, что закон кратных отношений представляет с обой дальнейшее развитие закона эквивалентов, основанное на после довательном анализе рядов химических соединений, образующихся п ри взаимодействии друг с другом двух любых химических элементов . В простейшем случае указанный ряд может состоять из двух соединений. Например, при вз аимодействии углерода и кислорода: образуются два соединения: оксид углерода (II) и оксид углерода- ( IV).
Доказа тельств о постоянства соста ва для самых разнообразных хими ческих соединении уже являл ос ь само по себе сви де те льс твом в пользу дискретного строе ния материи. При менение же закона постоянства состава для анализа любого из указа нных рядов пока зывает, что существ ов ание дв ух (или нескольких) соединений, образующихся п ри взаимодей стви и любой пары химическ их элементов , возможно лишь в том случае, ког да состав соедине ний буде т отличаться один от другого на целы е атомы. Естеств енн о, что эти разли чия в составе химических соединений ряда, впрочем, как и сами основные законы химии,справедливы лишь при условии , что материя действительно состоит из мельчайших неделимых частиц.
Выдвигая новую версию атомисти чес кой теории, опирающуюся н а основные химически е законы, и отдавая дань уважения древнегреческим философам-атомистам, Д. Дальтон сохранил предложенное ими название для мельчайших неделимых частиц материи — атом.
И наконец, использование закона постоянства состава и закона кратных отношений позволило Д. Дальтону установить значения относительных атомных масс элементов, принимая за единичную — массу атома водорода. Так, том Дальтона, обладающий конкретным материальным свойством — атомной массой, из отвлеченной модели превратилс я в конкретное химическое понятие. С введением в химию понятия “атомная масса” наука переходит на более высокую ступень своего развития.
Вместе с тем атомистика Дальтона еще не свободна от недостатков: в ней нет места молекулам, а существуют только “сложные атомы”.
Закон объемных отношений и закон Авогадро. Объемы вступающих в реакцию газов относятся друг к другу, а также к объему получающихся газообразных продуктов как простые целые числа (Ж. Ге й-Л ю сса к, 1805 г.). Этот закон находится в серьезном противоречии с выводами атомистики Дальтона.
Для объяснения наблюдавшихся Ж. Г е й-Люссаком закономерностей соединения газов оказалось необходимым предположи ть следующее:
1) любые газы (в том числе и простые) состоят не и з атомов, а из молекул;
2) в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Последнее утверждение, высказанное итальянским ученым А. А во га дров 1811 г., вошло в химию под именем закона Авог адр о. Однако в начале XIX в. эти воззрения не получили должного признания: даже крупные химики того времени Д. Дальтон и И. Берцелиус отрицали возможност ь существ ования молекул, состоящи х из нескольких одинаковых атомов. Прошло еще полвека, прежде чем на 1 Международном съезде химиков, состоявшемся в Карлсруэ (Германия) в сентябре 1860 г., были окончате льно приняты основные химические представления (понятия об атомах и молекулах), зародившиеся в виде философского учения в Древней Греции (Л евкип п, Демокрит, Эпикур), впервые развитые в виде научной концепции Д. Дальтоном, подтвержденные опытами Ж. Пруста, Ж. Гей-Люссака и окончательно сформулированныев трудах А. Авогадро и его ученика С.Канн иццаро.
Таким образом, основные положения атомно-молекулярного учения можно сформулировать следующим образом:
1. Все вещества состоят из атомов.
2. Атомы каждого вида одинаковы между собой, но отличаются от атомов любого другого вида.
3. При взаимодействии атомов образуются молекулы: гомоядерные или гетероядерные.
4. При физических явлениях молекулы сохраняются; при химических – разрушаются; при химических реакциях атомы в отличии от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Моль равен количеству вещества, с одержаще го столько же структурных частиц данного вещества, сколько атомов содержится в углероде массой 12 г.
Физико-химический смысл понятия “моль” м ожет быть уточнен после введения представлений об изотоп ах.
Для удобства расчетов, проводимых на ос новании химических реакций и учи тывающих коли чества исходных реагентов и продуктов взаимодействия в молях, вводится молярна я масса вещества.
Молярная масса М ве щества представляет со бой отношен ие его м ассы к количеству вещества: М =m
гдеm — мас са в граммах, v — коли чество веще ства в молях, М — молярная масса в г/моль — постоянная величина для каждого дан ного вещес тва.
Значение молярн ой массы численно совпада ет с относи тельной молекулярн ой массой вещества или относитель ной атомной массой элемента.
Определение, данное молю, опирается на число структурных частиц, содержащихся в 12г углерода. Было установлено, что указанная масса углерода содержит6,02 х10/23 атомов этого элемента. Следовательно, любой хими ческий индивид коли чеством 1 моль содержит6,02 х10/23 структурных части ц (атомов или молекул).
ЧислоN /A=6.02*10/23 носи т название постоянной Авогадро и выведено с испо льзованием закона Авогадро .
Из закона Авогадро следует, что два газа одинаковых объемов при одинаковых условия х, хотя и содерж ат одинаков ое число молекул, имеют неодинаковые массы: масса одного га за во столько раз больше массы другого, во сколько раз относительная молекулярная масса первого больше, чем отн оси тельная молекулярная масса второго, т. е. плотности газ ов относятся как их отн осительные молекулярные массы.
Независи мая оценка значения молярной массы М мож ет быть проведена на основании обобщенного у равнения Кл апейрона — Мен делее ва:PV=m хRT
Где Р – давление газа в замкнутой системе, V – объем системы, m – масса газа, R – молярная газовая постоянная, равная 8, 31*ДЖ/К*моль, Т – абсолютная температура.
Читайте также:

