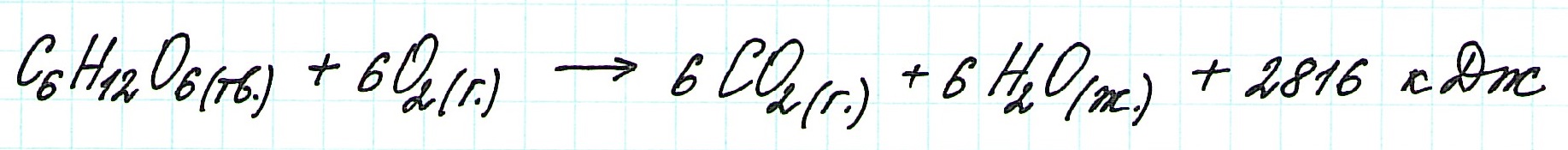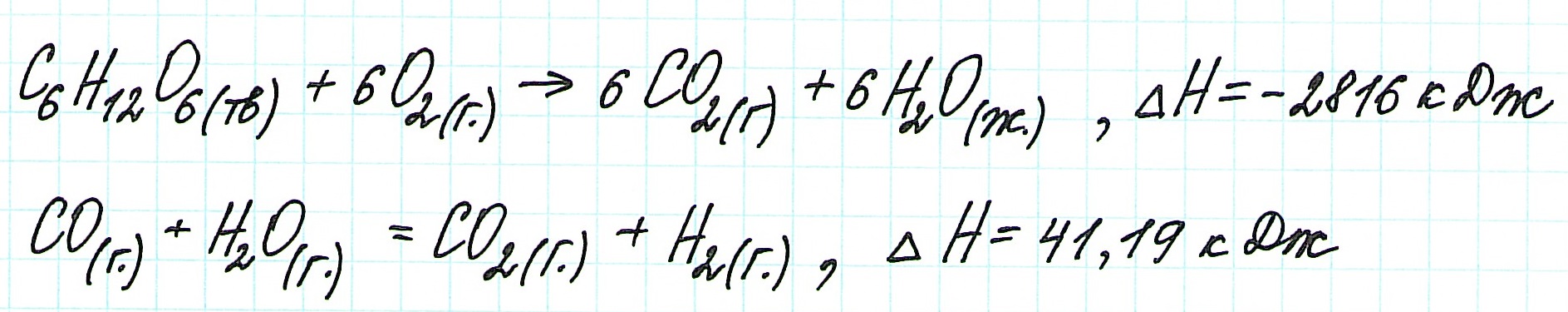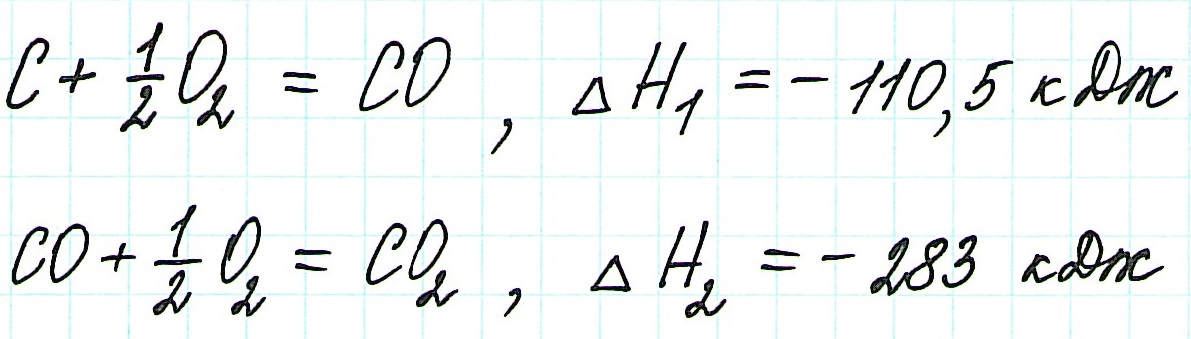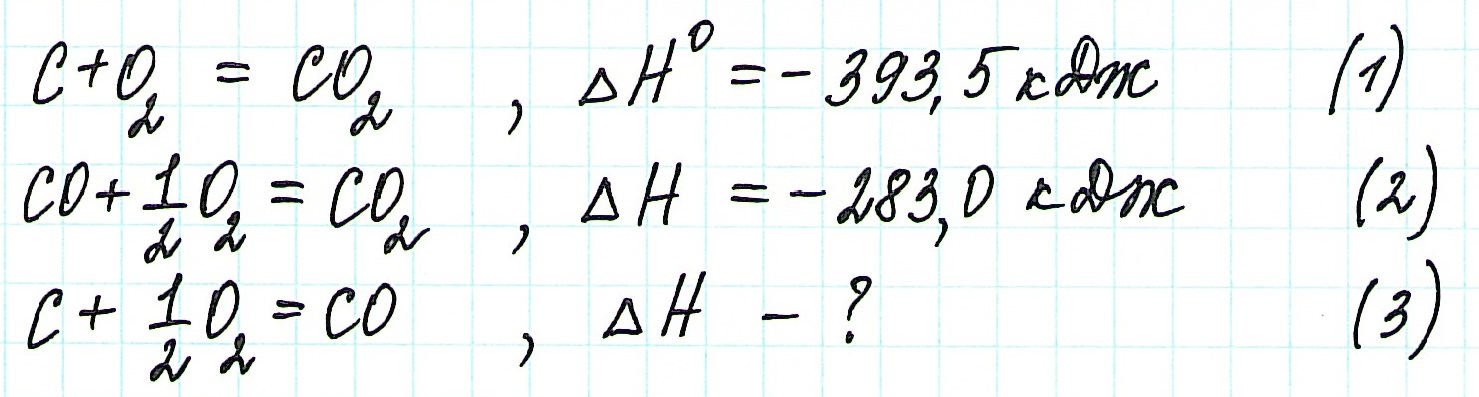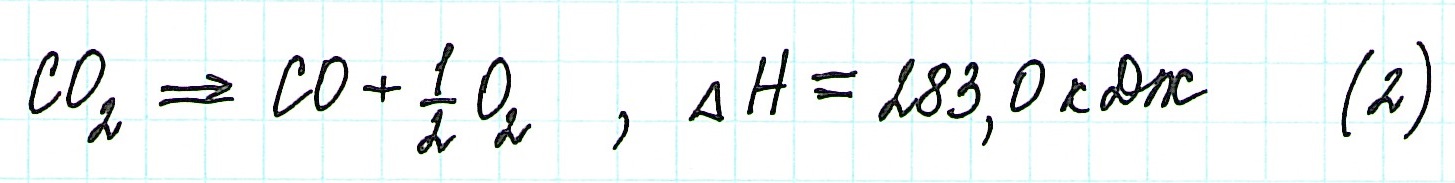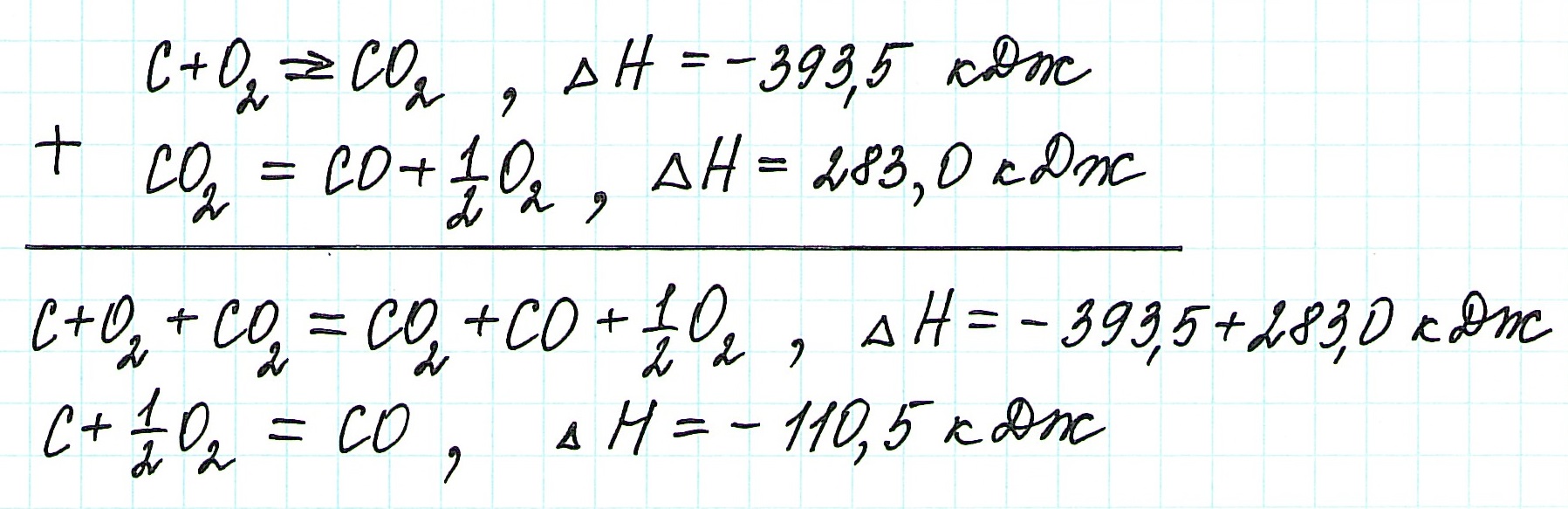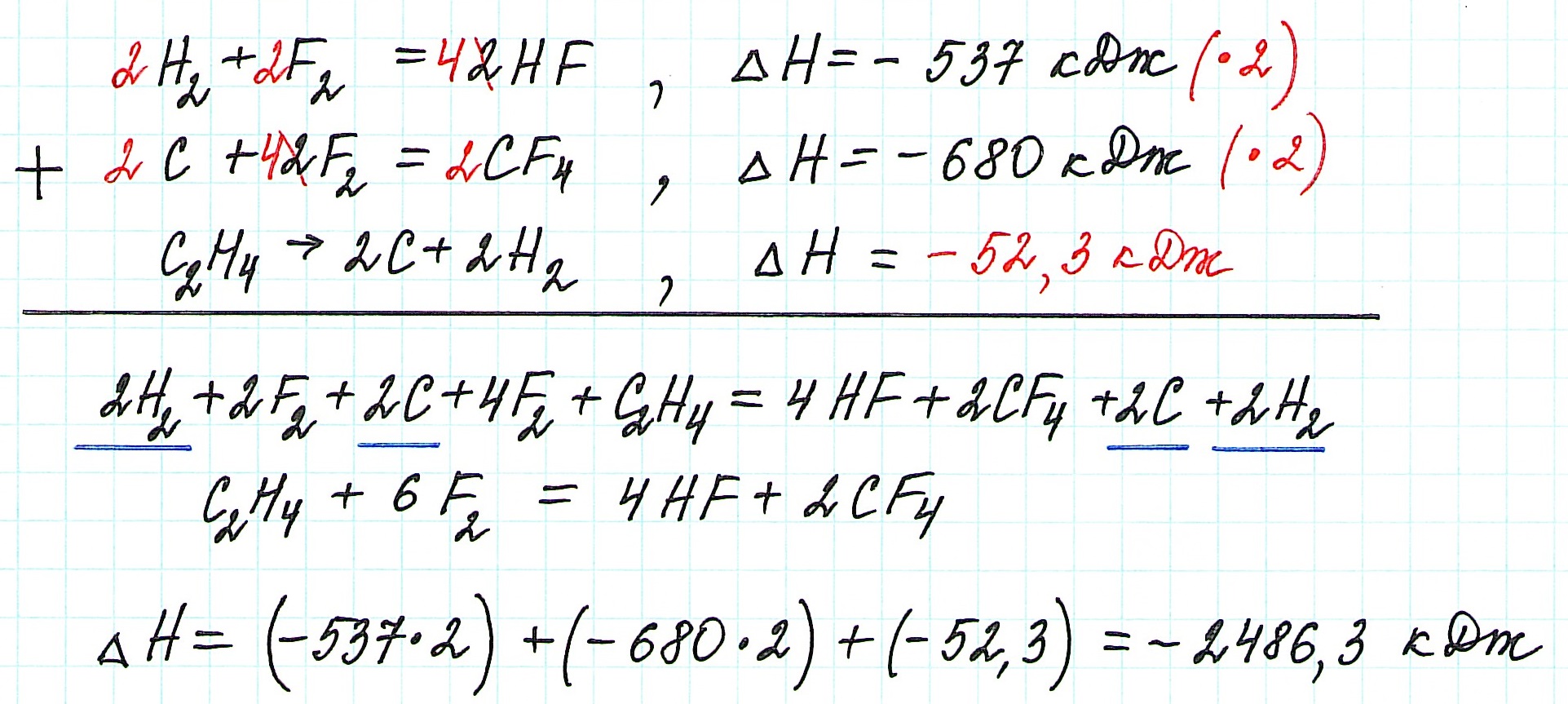Закон гесса план урока
Обновлено: 19.05.2024
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
- сложить полученные первое и второе уравнения.
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
![]()
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
Второй урок по термидинамике в 11 классе. представлена презентация к уроку.
Вложение Размер zakon_gessa.rar 106.86 КБ По теме: методические разработки, презентации и конспекты
Урок химии 9 класс Путешествие в страну "Неорганическая химия"
Заключительный урок по разделу "Неорганическая химия"Урок-путешествие для учащихся 9 класса.
![]()
Презентация к уроку химии 10 класс по теме: «Именные реакции в органической химии».
![]()
Презентация к уроку химии 10 класс по теме: «Химия алканов».
![]()
Урок химии 7 класс "Химия в центре естествознания"
Урок химии 7 класс - это урок зачет, который проводится по итогам изучения I раздела пропедевтичекого курса "Химия 7 класс" О.С. Габриэляна "Химия в центре естествознания". На данн.
![]()
Конспект урока химии 8 класс "Предмет химии. Вещества и их свойства"
Конспект урока химии 8 класс ФГОС по учебнику Рудзитис Г.Е., Фельдман Ф.Г.
![]()
урок химии 9 класс Подготовка к ОГЭ по химии.
Урок разработан для проведения практической части на ОГЭ в 9 классе. Пример разбора задания 23 и выполнения задания 24.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Дата ______________ Класс_____
1. Познакомить учащихся с тепловыми эффектами реакций, сопровождающими химические процессы; изучить закон Гесса и следствия из закона Гесса
2. Продолжить формирование умения наблюдать, описывать наблюдения и делать выводы по результатам эксперимента
3. Развивать у учащихся умение выделять главное, анализировать и сравнивать информацию, аргументировано отвечать на вопросы
Тип урока: изучение нового материала
Оборудование: мультимедийная доска, презентация, компьютер.
Планируемые результаты обучения :
Личностные. Формировать мировоззрение, соответствующее современному уровню развития науки, умение организовывать сотрудничество с учителем и одноклассниками.
Метапредметные . Развивать умения делать обобщения, устанавливать аналогии, строить логические рассуждения и выводы.
Предметные. Знать термохимические уравнения реакции, чем отличаются от химических. Знать экдотермический и экзотермические эффекты. Уметь решать задачи.
I . Организационный момент
II .Актуализация знаний
Что такое теплота образования?
Какие реакции называются эндотермическими, а какие экзотермические?
В чем состоит отличие эндотермических реакций от экзотермических?
Какова закономерность между тепловым эффектом и количеством вещества?
III . Объяснение нового материала
Основным законом термохимии, на основании которого проводят термохимические расчеты, является закон, сформулированный Г. И. Гессом в1841 г.: т епловой эффект химической реакции определяется начальным и конечным состоянием системы и не зависит от пути проведения процесса и числа промежуточных стадий.
Например, если реакцию
провести в две стадии
то сумма тепловых эффектов отдельных стадий будет равна тепловому эффекту суммарной реакции
Связь между тепловыми эффектами химической реакции и ее отдельных стадий может быть представлена наглядно с помощью энтальпийных диаграмм. На энтальпийных диаграммах значениям энтальпии для различных состояний системы соответствуют ступеньки, расстояние между которыми равны тепловым эффектам перехода из одного состояния в другое (рис. 14); стрелки, направленные вниз, соответствуют выделению энергии, стрелки, направленные вверх, - ее поглощению.
Рис. 14. Энтальпийная диаграмма для реакции А + 2В = АВ 2 .
Закон Гесса позволяет решать многие практически важные задачи. Прежде всего отметим, что этот закон позволяет выражать тепловые эффекты реакций через энтальпии образования веществ, участвующих во взаимодействии.
Энтальпия образования - это изменение энтальпии системы при синтезе одного моля вещества из простых веществ. Эта величина обозначается символом ΔН f . Если процесс протекает в стандартных условиях, энтальпию образования называют стандартной ( ). Значения стандартных энтальпий образования для различных соединений приводятся в термодинамических справочниках.
Энтальпии простых веществ по определению равны нулю. Если элемент образует несколько простых веществ, то равным нулю принимается значение для той аллотропной модификации, которая при стандартных условиях наиболее устойчива (например, графит в случае углерода).
Конкретные термохимические расчеты выполняют на основании следствий из закона Гесса.
Следствие первое - с термохимическими реакциями можно выполнять арифметические операции. Таким образом, комбинируя термохимические уравнения, можно определять тепловые эффекты любых реакций, в том числе и тех, для которых его определение связано с экспериментальными сложностями или вообще невыполнимо. Например, невозможно экспериментально определить тепловой эффект реакции образования оксида углерода(II):
поскольку большое сродство углерода к кислороду приводит к образованию примеси СО 2 даже при недостатке кислорода. В то же время легко поддаются экспериментальному определению тепловые эффекты следующих реакций:
Вычтя второе уравнение из первого, получим уравнение образования оксида углерода(II):
С(графит) - СO(г) + 1/2O 2 (г) = 0;
С(графит) + 1/2O 2 (г) = СO(г)
Соответствующая комбинация тепловых эффектов реакций дает искомый тепловой эффект
H о = H о 1 - H о 2 = -393,5 - (-283) = -110,5 (кДж)
Следствие второе - тепловой эффект химической реакции равен разности сумм энтальпий образования продуктов реакции и энтальпий образования исходных веществ.
где i и j – коэффициенты в термохимическом уравнении.
Применение данного следствия позволяет рассчитать тепловой эффект любой реакции, для которой известны стандартные энтальпии образования реагентов и продуктов реакции (справочные данные).
Рассчитаем в качестве примера тепловой эффект реакции термического разложения карбоната кальция:
= -635,5 + (-393,5) - (-1206,9) = 177,9 (кДж)
Следствие третье - тепловой эффект химической реакции равен разности сумм энтальпий сгорания исходных веществ и энтальпий сгорания продуктов реакции.
В качестве примера рассчитаем энтальпию процесса перехода цис -бутена-2 в транс -изомер:
= ( cis- C 4 H 8 ) - ( trans -C 4 H 8 ); = -2710,4 - (-2706,2) = -4,2 ( кДж )
IV . Закрепление
Решим задачи:
Вычислите тепловой эффект химической реакции восстановления FeO ( II ) исходя из следующих уравнений:
CO+ O 2 →CO 2 ; = - 283 кДж .
H 2 + ½ O 2 → H 2 O ; = - 241, 83 кДж .
= - 13, 19 кДж а ) FeO + CO Fe + CO 2
= - 283 кДж б ) CO+ O 2 → CO 2
= - 241, 83 кДж в ) H 2 + O 2 → H 2 O
г = FeO + CO + H 2 + O 2 – CO - O 2 → Fe + CO 2 +
= -13,19 – 241,84+ 283 = 27, 98 кДж .
FeO ( т ) + H 2( г ) → Fe ( т ) + H 2 O ( г ) ; = 27, 98 кДж
Ответ: = 27, 98 кДж.
Вычислите теплоту образования гидроксида кальция (Ca(O H ) 2 ), исход из следующих уравнений реакций:
Ca + 1/2O 2 → CaO; ∆ H 1 = 633,6 кДж ;
= - 633,6 кДж а) Ca + O 2 → CaO
= - 285,84 кДж б )H 2 + O 2 → H 2 O ( ж )
= - 65, 06 кДж в )CaO + H 2 O ( ж ) → Са (OH) 2
=? г) Ca + O 2 + H 2 →Ca(OH) 2
Ca + O 2 + H 2 + O 2 + CaO + H 2 O→CaO + H 2 O ( ж ) + Ca(OH) 2
= - 633,6 – 285,84 – 65, 06 = - 984,5 кДж
Ca + O 2 + H 2 →Ca(OH) 2 ; = -984,5 кДж .
Ответ: = - 984, 5 кДж
3. Вычислить ∆H 1 реакций:
![hello_html_m479adf4.jpg]()
Решение:
По табличным данным стандартные энтальпии образования С 2 Н 6(г) , С 6 Н 6(ж) , Н 2 О (г) , Н 2 О (ж) и СО 2(г) соответственно равны -89,7, -241,8, 82,9, -241,8, -285,8 и -393,5 кДж/моль (стандартные энтальпии образования простых веществ принято считать равными нулю). Для расчета реакций используем уравнение из следствия закона Гесса:а) Находим стандартную энтальпию реакции:
![hello_html_m774e6524.jpg]()
б) Находим стандартную энтальпию реакции:
![hello_html_m24094aa7.jpg]()
Ответ : а) 1423 кДж; б) 3301,3 кДж.
![hello_html_708dcfd4.jpg]()
Вычислить ∆ H 1 реакций:
Б) 2 Na ( k ) + 2 H 2 O (ж) = 2 Li + (водн) + 2 OH - ( водн) + H 2(г)
Стандартные энтальпии образования L1 + (водн.) , Na + (водн.) и OH - (водн.) принять соответственно равными -278,5, -239,7 и -228,9 кДж/моль.
Решение:
По условию задачи и по табличным данным стандартные энтальпии образования веществ равны:Для расчета реакций используем уравнение из следствия закона Гесса :
а) Находим стандартную энтальпию реакции:
![hello_html_6a48ac88.jpg]()
б) Находим стандартную энтальпию реакции:
![hello_html_m76e24e8b.jpg]()
Ответ: а) -443,2кДж; б) -365,6кДж.
V . Домашнее задание
1. Согласно термохимическому уравнению реакции
определите количество теплоты, выделившейся при сжигании 24 г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3. По термохимическому уравнению H 2 + Cl 2 = 2 HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
Презентация на тему: " ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ 1.Основные понятия 2.Первое начало термодинамики 3.Закон Гесса, следствия из закона Гесса, теплоты образования и сгорания," — Транскрипт:
1 ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ 1. Основные понятия 2. Первое начало термодинамики 3. Закон Гесса, следствия из закона Гесса, теплоты образования и сгорания, термохимические расчеты 4. Понятие об энтропии, вероятностный характер энтропии, направленность процессов в изолированных системах 5. Направленность процессов в реальных системах
3 СИСТЕМА – произвольно выбранная часть пространства, часть материального мира, являющаяся объектом нашего наблюдения или исследования. Между частями системы возможно взаимодействие и теплообмен. ОКРУЖЕНИЕ – остальная часть материального мира, за пределами условно или реально выделенной системы. Фаза – часть объема системы, обладающая во всех точках одинаковыми физическими и химическими свойствами и отделенная от других частей системы поверхностью раздела.
4 Виды систем по количеству фаз в составе системы гомогенные - имеют в составе одну фазу гетерогенные – имеют в составе 2 и более фаз
5 Виды систем по характеру обмена с окружением изолированная система закрытая система открытая система не обменивается с окружением ни веществом, ни энергией обменивается с окружением только энергией обменивается с окружением и веществом, и энергией m(системы)=cons t, E(системы)=cons t m(системы)=con st, E (системы) const m(системы) const, E(системы) con st
7 Параметры термодинамической системы ( функции состояния) – макроскопические величины, которые характеризуют ее состояние - экстенсивные параметры (зависят от количества вещества и подчиняются закону аддитивности): m, p,V -интенсивные параметры ( не зависят от количества вещества и не подчиняются законам аддитивности) Параметры состояния или функции состояния связаны между собой в уравнение состояния, например, уравнение состояния идеального газа:pV= RT. Изменение любой из функций состояния не зависит от того каким способом оно произошло, а зависит от конечного и начального значения параметра: Т=Т 2 -Т 1.
8 Энергия – как параметр термодинамической системы Энергия – мера способности совершать работу ( в системе СИ – Дж) Е полная =1/2 m 2 +mgh+U, U – внутренняя энергия U=E внутр.кин. +E внутр.пот, E внут пот =E межмол +E хим.св. +E атом В ходе химических реакций Е кин и Е пот для системы можно пренебречь, E атом остается неизменной, таким образом: Е= U=U 2 -U 1 = E внутр.кин + E межмол + E хим.св Абсолютные значения U 2 и U 1 измерить невозможно, поэтому о U судят по обмену внутренней энергией системы с окружением в виде теплоты(Q) и работы (W)
9 Теплота – результат изменения внутренней энергии системы, характеризующий передачу хаотического поступательного, колебательного и вращательного движения от структурных единиц системы к частицам окружения или наоборот путем теплопроводности, излучения или конвекции. Теплота – не функция состояния системы, а результат изменения параметра системы. Теплопередача оценивается количеством переданной теплоты и возможна лишь при наличии разности температур системы и окружения. При этом, -если реакция экзотермическая Т системы Т окружения, энергия передается от системы к окружению( Q
10 Работа – форма передачи энергии от системы к системе или к окружению В ходе химической реакции осуществляется работа: - по превращению а моль реагента в в моль продукта; -по расширению ( против внешнего давления): W=- p V, p – внешнее давление; V – изменение объема системы ; -по переносу заряда ( в окислительно- восстановительных реакциях): W= nF, n – число моль электронов; F – постоянная Фарадея, - разность потенциалов - и др.
11 Первое начало термодинамики -Если внутренняя энергия системы меняется, то система совершает передачу энергии,т.е. получает или отдает теплоту и совершает работу: U=Q-p V -Система не может создавать или уничтожать энергию, она лишь осуществляет ее передачу. -Все изменения внутренней энергии обусловлены ее передачей в форме теплоты и работы
12 U=Q-p V Процесс при V=соnst (изохорный) : V=0 U=Q-p V=Q Адиабатный процесс не сопровождается теплопередачей, для него, Q=0, U=-p V. Процесс в изобарных условиях p=соnst: U=Q-p V Q=p V + U=pV 2 -pV 1 +U 2 -U 1 =pV 2 +U 2 -U 1 -pV 1 H=U+pV, H – энтальпия Q=H 2 -H 1 = Н Тепловой эффект реакции – количество теплоты, поглотившейся или выделившейся в ходе конкретной химической реакции, отнесенное к количествам вещества реагентов и продуктов, которые соответствуют коэффициентам в уравнении реакции. Уравнение реакции с указание теплового эффекта – термохимическое уравнение реакции.
13 Закон Гесса( 1836 ) Герман Иванович Гесс ( )- русский химик, академик Петербургский АН, врач по образованию, основоположник термохимии. Тепловой эффект химической реакции при р,Т=const (Q p = Н) и при V,T=const (Q v = U) определяется только природой и состоянием исходных и конечных продуктов и не зависит от ее пути.
14 Следствия из закона Гесса Изменение энтальпии химической реакции не зависит от числа ее промежуточных стадий (закон Лавуазье-Лапласа) Изменение энтальпии прямой реакции равно взятому с противоположным знаком изменению энтальпии обратной реакции H ( прямой реакции)=- H (обратной реакции) Изменение энтальпии в ходе химической реакции может быть найдено как разность сумм энтальпий образования продуктов с учетом стехиометрических коэффициентов и сумм энтальпий образования реагентов с учетом стехиометрических коэффициентов: аА+bB=cC+dD H (реакции)=[c f H (C)+d f H (D)]- [a f H (A)+b f H (B)]
15 Термохимические уравнения CaCO 3(кр) =CaO (кр) +CO 2(г), H =178 к Дж/моль или CaCO 3(кр) =CaO (кр) +CO 2(г) +178 к Дж/моль для обратной реакции СaO (г) +CO 2(кр) =CaCO 3(кр), H =-178 к Дж/моль f H наиболее стабильной модификации простого вещества принята равной нулю, поэтому в термохимических уравнениях допускаются дробные коэффициенты перед формулами простых веществ: С 2 Н 6(г) +3,5О 2(г) =2СО 2(г) +3Н 2 О (г), H =-1431,9 к Дж/моль Тепловой эффект сгорания 1 моль вещества – стандартная теплота сгорания, т.о. H сгорания (С 2 Н 6 )=- 1431,9 к Дж/моль
18 Примеры термохимических расчетов и их применение для решения задач Определите сколько теплоты выделится при сгорании в стандартных условиях при 25 С 10 л гремучего газа? Какой объем метана (температура в помещении 20 С, р=101,3 к Па) следует сжечь для того, чтобы нагреть 300 мл воды до 80 С, если исходная температура воды соответствовала температуре в помещении? Вычислите энтальпию образования кристаллического PCl 5 если: Р 4(к) +6Сl 2(г) =РCl 3(ж) к Дж PCl 3(ж) +Cl 2(г) =PCl 5 (к)+137,2 к Дж. 35,2 г минерала, содержащего 63,6% железа и 36,4 % серы по массе, сожгли в избытке кислорода, а твердый продукт сгорания прокалили с 15,4 г алюминия. Какое количество теплоты выделилось в результате каждого из этих процессов, если известно, что реакции проводились при постоянной температуре, а теплоты образования при данной температуре равны: сульфида железа 101 к Дж/моль, оксид железа(III) 824 к Дж/моль, оксид серы(IV) 297 к Дж/моль, оксид алюминия 1675 к Дж/моль?
19 Оптимальное топливо Определите какой из видов топлива : водород под давлением 10 атм., при температуре 25 С ( цена 25 у.е. за кубометр); метан при тех же условиях ( 5 у.е. за кубометр) и уголь ( 3 у.е. за килограмм), представляющий собой чистый графит, дает наибольшую энергию при сгорании: а) на единицу объема; б) на единицу массы; в) на у.е. стоимости? Справочные данные: f H (СН 4 )=-74,8 к Дж/моль; f H (СО 2 )=393,5 к Дж/моль; f H (Н 2 О (ж) )=285,8 к Дж/моль, плотность графита 2,27 г/см 3
20 Понятие об энтропии, вероятностный характер энтропии, направленность процессов в изолированных системах Для оценки принципиальной осуществимости химической реакции в системе используют функцию состояния системы, которая была названа Клаузиусом энтропия S( в переводе с греческого – превращение). S=S 2 -S 1 =Q/T Это выражение вытекает из анализа работы идеальной тепловой машины ( цикла Карно): эффективность паровой машины не зависит от природы нагреваемого и охлажденного рабочего вещества и определяется равенством: =W/Q=(Q 1 -Q 2 )/Q 1 =(T 2 -T 1 )/T 1 Q 1 -теплота, переданная рабочему веществу от нагревателя, температура которого T 1, Q 2 – теплота, принятая холодильником от рабочего вещества, температура которого T 2 Т.о. доля внутренней энергии, которая может быть превращена в работу зависит от разности температур нагревателя и холодильника.
21 Второе начало термодинамики Энтропия в термодинамически необратимом процессе, протекающем в изолированной системе, возрастает: S 0 Возрастание будет происходить до максимально возможного значения, характерного для данной системы, пока не наступит тепловое равновесие. Для закрытых систем, находящихся в тепловом равновесии с внешней средой: T S Q Для необратимых самопроизвольные химических реакций, протекающих в закрытых системах: T S Q
23 Вероятностный характер энтропии W - число микросостояний, с помощью которых реализуется данное микросостояние, называют термодинамической вероятностью. Рассмотрение различных изолированных систем показывает, что самопроизвольные процессы всегда связаны с ростом числа микросостояний w системы. В этих же процессах происходит возрастание энтропии S системы, т. е. энтропия возрастает с увеличением числа микросостояний. Впервые на существование такой зависимости обратил внимание австрийский физик Л. Больцман, который в 1872 г. предложил соотношение: S=klnW, k = R/N A = 1,38 * Дж/К, где k – постоянная Больцмана, равная отношению газовой постоянной R к постоянной Авогадро N A.
24 Энтропия – мера термодинамической вероятности состояния веществ и систем Формула Больцмана позволяет теоретически рассчитать энтропию системы по числу возможных ее микросостояний. Если известно, что число микросостояний кристаллических веществ при 0°К близко к w 0 «1. Т.о, могут быть определены абсолютные значения энтропии кристаллизующихся веществ в отличие от внутренней энергии U и энтальпии Н, для которых можно определить лишь относительные значения. Увеличение числа микросостояний системы во многих случаях можно связать с ростом неупорядоченности в этой системе, с переходом к более вероятным распределениям энергии системы. Исходя из соотношения Больцмана, можно дать молекулярно-кинетическое определение энтропии: Энтропия есть мера вероятности пребывания системы в данном состоянии или мера неупорядоченности системы.
25 Процессы, для которых S>0
26 Возрастание энтропии при плавлении, испарении, возгонке S (I 2 (тв.) ) = 117 Дж/моль*К, S (I 2(г) ) = Дж/моль*К при растворении тв. или ж. S (NaCl (тв.) ) = 72.4 Дж/моль*К, S (NaCl (р-р) ) = Дж/моль*К при усложнении химического состава/"сложности" MnO Mn 2 O 3 Mn 3 O 4 : Дж/моль*К увеличении количества г/о веществ в реакции CaCO 3 (тв.). CaO (тв.) + CO 2 (г), S 0 =S 0 (CO 2 (г)) + S 0 (CaO(тв.)) - S 0 (CaCO3(тв.)) = = Дж/моль*К при образовании дефектов и загрязнении кристаллов NaCl(тв.) + Na (г.): F-центры при образовании "рыхлых" кристаллических структур алмаз графит при аморфизации кристаллических веществ S ромб. S ж S аморфн при нагревании веществ S S (TiO 2 ) = 82.4 Дж/моль*К
27 Энергия Гиббса В качестве критерия самопроизвольности процессов в открытых и закрытых системах при р, Т = const предложена функция энергия Гиббса. Д.У.Гиббс ( ) – американский физик, который вывел эту функцию, а затем использовал в термодинамических работах. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) это термодинамический потенциал следующего вида: термодинамический потенциал G=U+pV-TS или G=H-TS Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)химическуюэнергию Изменение энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных - через давление p и температуру T:давление температуру G=-T S+p V Для системы с переменным числом частиц этот дифференциал записывается так: G=-T S+p V+μ N Здесь μ химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.химический потенциал
28 Условия самопроизвольного протекания процесса, при р, Т = const Для необратимых самопроизвольные химических реакций, протекающих в закрытых системах: T S Q При р, Т = const, Q= H T S H 0 H- T S G0 В изобарно-изотермических условиях (р, Т = const) в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса системы уменьшается (ΔG
29 Выведенная на основе второго начала термодинамики энергия Гиббса является функцией состояния. Следовательно, так же, как и для энтальпии, может быть сформулирован закон Гесса для энергии Гиббса в следующей форме: Изменение энергии Гиббса при образовании заданных продуктов из данных реагентов при постоянных давлении и температуре не зависит от числа и вида реакций, в результате которых образуются эти продукты; Энергия Гиббса реакции равна алгебраической сумме энергий Гиббса образования стехиометриеского количества продуктов за вычетом алгебраической суммы энергий Гиббса образования стехиометрического количества реагентов: aA+bB=cC+dD ΔG p-и = (cΔG c + dΔG D )-(aΔG A + bΔG B ).
30 Движущие силы химической реакции - ЭНТАЛЬПИЙНЫЙ ФАКТОР - стремление систему перейти в состояние в наименьшей внутренней энергией ( H 0)
31 Самопроизвольный процесс с ΔH
33 G 0 (T=const, p=const)
34 Энтальпийные и энтропийные факторы, обуславливающие самопроизвольность протекания физико-химических процессов – стремление к уменьшению энтальпии (ΔH 0) 1. H 0 - самопроизвольная: C(тв.) +O 2 (г)=2CO(г) 2. H>0 и S 0 и S>0 - при высоких T: Cu 2 O(тв.) =4Cu(тв.)+O 2 (г) 4. H
35 РАВНОВЕСИЕ Состояние системы, содержащей вещества, способные к взаимодействию в прямом и обратном направлении, когда ни один из параметров системы не меняется
36 Признаки истинного равновесия H=0; G=0; T=0; p=0 и т.д. Равновесие достигается как по прямой и по обратной реакции Всякое точечное воздействие на систему вызывает смещение равновесия легко и незначительно В системе на происходит видимых во времени изменений при отсутствии внешних воздействий
![zakon-gessa-reshenie-zadach]()
Закон Гесса (1840 г.) представляет собой частный случай закона сохранения энергии. Он позволяет определить тепловой эффект химического взаимодействия, используя данные о состояниях веществ только в начале и в конце процесса. Для этого применяется так называемая формула закона Гесса, оформленная в виде формулировки следствия из него.
Итак, что же из себя представляет закон, о котором идет речь? Как, пользуясь им, можно проводить вычисления?
Экзотермические и эндотермические реакции
Основной категорией химического процесса, с которой закон Гесса имеет дело, является тепловой эффект – главный объект термохимии.
Тепловым эффектом Q считают теплоту, либо подающуюся в систему, либо выделяющуюся из нее в ходе химического взаимодействия.
Так, если теплота подается в систему (то есть поглощается из внешней среды), то процесс является эндотермическим. Если теплота, наоборот, уходит из системы в окружающую среду, то процесс является экзотермическим.
Каждая реакция отображается с помощью уравнения. Если в уравнении указан тепловой эффект химического процесса, то такое уравнение называется термохимическим. В нем обязательно записываются либо агрегатные состояния веществ, определяющие общее состояние системы, либо их аллотропные модификации (в случае простых веществ).
Обозначения агрегатных состояний записываются нижним индексом в скобках рядом с химической формулой вещества.
Например, для экзотермического процесса:
![zakon-gessa-formula-reshenie-zadach]()
И для эндотермического процесса:
![]()
Состояния:
— (тв.) – твердое, или (к.) – кристаллическое;
Тепловой эффект Q реакции и изменение энтальпии ΔН имеют одинаковые численные значения, а по знаку противоположны:
![zakon-gessa-formula-reshenie-zadach]()
В связи с этим приведенные выше уравнения можно записать так:
![zakon-gessa-formula-reshenie-zadach]()
Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
![]()
Закон Гесса констатирует:Рассмотрим классический пример.
При экзотермическом взаимодействии углерода (графита) и кислорода образуется углекислый газ. У этого процесса есть два возможных пути: напрямую или через промежуточную стадию, идущую с образованием угарного газа (оксида углерода (II)):
![zakon-gessa-formula-reshenie-zadach]()
При прямом процессе, идущем непосредственно с образованием углекислого газа, выделяется 393,5 кДж энергии:
![zakon-gessa-formula-reshenie-zadach]()
Если процесс взаимодействия графита с кислородом идет в две стадии, то каждая из них также сопровождается выделением энергии:
![zakon-gessa-formula-reshenie-zadach]()
Просуммируем эти два уравнения:
Получаем то же, что и в первом случае (то есть при прямом взаимодействии графита с кислородом): выделяется 393,5 кДж энергии.
Таким образом, результат реакции совершенно не зависит как от пройденного пути, так и от количества промежуточных стадий. Важными оказываются состояния веществ: начальное и конечное.
Прежде, чем рассмотреть примеры расчетов, в которых используется формула закона Гесса, необходимо сделать некоторые уточнения:
1) результаты термохимических расчетов (и измерений) всегда относят к одному молю вещества, которое образуется в ходе реакции;
2) теплота образования – это количество теплоты, выделяющееся при реакции простых веществ с образованием 1 моля продукта;
3) теплоты образования простых веществ принимают за ноль;
4) если прямой процесс является экзотермическим, то обратный будет эндотермическим, и наоборот.
Пример 1.
![zakon-gessa-formula-reshenie-zadach]()
Запишем термохимические уравнения реакций, о которых идет речь:
![zakon-gessa-formula-reshenie-zadach]()
Представим уравнение (2) так, чтобы СО стал конечным продуктом реакции, а не исходным веществом. Для этого запишем уравнение в обратном виде. Теплота сгорания по знаку в таком случае станет противоположной:
![zakon-gessa-formula-reshenie-zadach]()
Для получения ответа на вопрос задачи (по закону Гесса) просуммируем уравнения (1) и (2):
![zakon-gessa-formula-reshenie-zadach]()
Таким образом, при сгорании углерода с образованием угарного газа выделяется 110,5 кДж энергии.
![zakon-gessa-formula-reshenie-zadach]()
Пример 2.
В реакции, для которой требуется вычислить теплоту:
- участвуют 1 молекула этилена и 6 молекул фтора;
- образуются 2 молекулы тетрафторуглерода и 4 молекулы фтороводорода.
— в первой из данных по условию реакций все коэффициенты и теплоту реакции умножим на 2, чтобы получить 4 молекулы фтороводорода;
— во второй реакции также все коэффициенты и теплоту реакции умножим на 2, чтобы получить 2 молекулы тетрафторуглерода;
— уравнение третьей реакции запишем в обратном виде, чтобы этилен стал исходным веществом, а не продуктом реакции;
— изменим знак теплоты третьей реакции на противоположный, так как ее уравнение записываем в обратном виде.
Просуммируем все уравнения:
![zakon-gessa-formula-reshenie-zadach]()
Таким образом, теплота реакции этилена с фтором ΔН= -2486,3 кДж.
Следствие из закона Гесса: вычисление энтальпии реакции
Чаще всего в вычислениях применяется не сам закон Гесса, а следствие из него. Оно позволяет вычислить как изменение энтальпии реакции, так и энтальпию образования любого из участников химического взаимодействия.
Следствие утверждает, что
![zakon-gessa-formula-reshenie-zadach]()
В самом общем виде расчетная формула выглядит так:
![zakon-gessa-formula-reshenie-zadach]()
А если учесть коэффициенты, то так:
![zakon-gessa-formula-reshenie-zadach]()
Для вычислений обычно применяют стандартные энтальпии образования, так как именно в стандартных состояниях вещества наиболее устойчивы:
![]()
Стандартные теплоты (энтальпии) образования являются табличными величинами.
![zakon-gessa-formula-reshenie-zadach]()
Задача 1. Используя данные таблицы стандартных термодинамических величин , вычислите изменение энтальпии для реакции:
![zakon-gessa-reshenie-zadach]()
Решение:
![]()
Задача 2.
![zakon-gessa-reshenie-zadach]()
Решение:
![]()
Задача 3. Решение:
Тепловой эффект в термодинамическом уравнении относят к 1 молю образующегося вещества. С учетом этого запишем уравнение реакции следующим образом:
![]()
![zakon-gessa-reshenie-zadach]()
Следовательно, для данной реакции термохимическое уравнение будет выглядеть так:
![]()
В дополнение ко всему сказанному отметим, что некоторые тепловые эффекты реакций, идущих при стандартном давлении, меняются с температурой. Однако эти изменения незначительны. Поэтому при выполнении термодинамических вычислений для нестандартных условий можно использовать стандартные величины теплот образования. Появится в итоге небольшая ошибка, что вполне допускается.
Таким образом, закон Гесса, а также следствие из него позволяют проводить расчеты, в основе которых лежат тепловые явления химических процессов.
Далее будут рассмотрены случаи, в которых используется формула закона Гесса для расчета таких термодинамических величин, как энтропия и энергия Гиббса.
или на Одноклассниках
![]()
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Читайте также:
- В чем заключаются различия в эмоциональных проявлениях людей кратко
- Что вы знаете о словах пришедших в русский язык из старославянского языка кратко
- Какие идеи школы физиократов актуальны до сих пор
- Какие животные и растения обитали на земле в разные эпохи кратко
- Кратко активизация деятельности по привлечению иностранцев в россию