В чем сущность сухого и мокрого способов выполнения аналитических реакций кратко
Обновлено: 01.06.2024
Несмотря на возросшую роль теоретических и инструментальных аспектов в курсе химии, изучение химических свойств по-прежнему составляет неотъемлемую основу любого химического образования. Важную роль в изучении свойств веществ играет курс качественного неорганического анализа. В настоящее время качественный анализ рассматривается не столько как часть аналитической химии, сколько как введение в общую химию.
Качественный анализ заключается в обнаружении отдельных элементов (или ионов), из которых состоит анализируемое вещество.
Исследуя какое-нибудь новое соединение, прежде всего, определяют из каких элементов (или ионов), оно состоит, а затем уже количественные отношения, в которых они содержатся. Поэтому качественный анализ вещества, как правило, предшествует количественному.
2. Аналитические реакции и способы их выполнения
Анализируемые вещества могут находиться в различных агрегатных состояниях (твердом, жидком и газообразном). Соответственно этому и качественные аналитические реакции могут быть выполнены „сухим” или „мокрым” путем.
Анализ сухим путем осуществляют с помощью таких приемов, как проба на окрашивание пламени, получение цветных стекол („перлов”) и рассмотрение металлических “корольков”. Эти приемы называют пирохимическими (от греч. „пир” – огонь).
При выполнении окрашивания в пламени пробы, исследуемое вещество на петле платиновой (или нихромовой) проволочки вносят в бесцветное пламя горелки. По характерной окраске пламени узнают о присутствии того или иного элемента. Например, натрий окрашивает пламя в ярко желтый цвет , калий- в фиолетовый, медь и бор – в ярко-зелёный, свинец и мышьяк – в бледно-голубой.
Окрашенные стекла, или перлы, приготовляют сплавлением исследуемого вещества с бурой Na2B407•10H2O (или с гидрофосфатом натрия-аммония NaNH4HPO4•4Н2О) в ушке платиновой проволочки над пламенем. Окраска перла указывает на присутствие того или иного металла. Например, хром окрашивает перл буры в зеленый цвет, кобальт – в синий, марганец – в фиолетовый.
Металлические корольки получаются при прокаливании анализируемых минералов на древесном угле с помощью паяльной трубки. По внешнему виду их также можно судить о составе испытуемого материала.
Анализ „сухим” путем используют главным образом в полевых условиях для качественного или полуколичественного исследования минералов и руд.
В лабораторных условиях обычно применяют анализ „мокрым” путем, который основан на реакциях в растворах. Естественно, что при этом исследуемое вещество должно быть сначала переведено в раствор. Если оно не растворяется в дистиллированной воде, то используют уксусную, соляную, азотную и другие кислоты. Химически взаимодействуя с кислотами, анализируемое вещество (соль, гидроксид или оксид) превращается в легко растворимое соединение:
В полученном растворе обнаруживают те или иные ионы.
Не все химические реакции пригодны для качественного анализа. Аналитическими являются только те реакции, которые сопровождаются каким-нибудь внешним эффектом, позволяющим установить, что химический процесс происходит: выпадением или растворением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ.
Кислотно-основные реакции
Выделение свободной уксусной кислоты (обозначение г. — газ) при добавлении сильной кислоты (например, соляной или серной) используется для обнаружения ацетат-ионов. Партнером ацетат-иона в этой реакции является ион водорода, существующий в воде и гидратированной форме, формулу которой записывают обычно как Н3О + (правильнее было бы записывать (H2O)4H + или H9O4 + ). Аналогичным образом (по выделению свободного аммиака при действии сильных щелочей, например гидроксида натрия) можно обнаружить и ион аммония:
Реакции комплексообразования
Реакции осаждения
Ag + + Сl – ↔ AgCl (тв.)
Ионы Ag + (или Сl – ) осаждаются в виде малорастворимого хлорида серебра (о его растворении см. выше).
Ионы Ba 2+ (или SO4 2- ) осаждаются в виде малорастворимого сульфата бария.
Реакции полимеризации
Многие вещества в водных растворах способны образовывать димеры или полимеры линейного или циклического строения. Простейшим примером может служить димеризация хромат-иона с образованием бихромат-иона, сопровождающаяся изменением желтой окраски на оранжевую:
Еще одной важной в аналитическом отношении реакцией является взаимодействие ионов двух различных типов с образованием смешанного полимерного соединения, так называемого гетерополисоединения. Примером может служить взаимодействие молибдат- и фосфат-ионов:
Эта реакция применяется для обнаружения фосфат-иона по образованию желтого осадка гетерополисоединения.
Окислительно-восстановительные реакции
Эти реакции связаны с переносом электронов и могут протекать в различных формах.
1. Простой обмен электронами:
Ce 4+ + Fe 2+ ↔ Ce 3+ + Fe 3+
2. Гетерогенные реакции между ионами в растворе и твердыми веществами:
Cu 2+ + Fe (тв.) ↔ Cu(тв.) + Fe 2+
3. Реакции диспропорционирования:
2Cu + ↔ Cu 2+ + Cu(тв.)
4. Реакции компропорционирования (синпропорционирования):
Реакции с выделением газов
Для обнаружения ионов часто используют реакции с выделением газов (например, см. приведенные выше кислотно-основные реакции). Выделяющийся газ затем обычно вступает в другую реакцию, которая, собственно, и используется для обнаружения. Например, для обнаружения карбонат-ионов используют выделе- ние диоксида углерода при действии кислот. Выделяющийся газ можно затем обнаружить при помощи реакции образования малорастворимого карбоната бария:
В аналитическом отношении важное значение имеет также реакция диоксида кремния и плавиковой кислоты (HF), сопровождающаяся образованием летучих соединений кремния с фтором:
В зависимости от количества плавиковой кислоты образуется либо тетрафторид кремния, либо летучая кремнефтороводородная кислота. Чтобы равновесия указанных реакций сместить вправо, необходимо связать выделяющуюся воду путем добавления концентрированной серной кислоты. Смещение этих равновесий в обратном направлении можно использовать для обнаружения выделившихся газов по выпадению осадка диоксида кремния.
С точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на четыре группы:
- 1)образование характерных осадков,
- 2)растворение осадков,
- 3)появление (изменение) окраски,
- 4)выделение газов.
3. Качественные реакции как реакции между ионами
В качественном анализе имеют дело преимущественно с водными растворами электролитов, т. е. солей, оснований и кислот, диссоциирующих на ионы. Можно сказать, что каждый ион обладает определенными свойствами, которые он сохраняет независимо от присутствия в растворе других ионов. Например, катион водорода, присутствующий в водном растворе любой кислоты, независимо от ее аниона окрашивает синий лакмус в красный цвет и проявляет другие, характерные для него свойства.
Поскольку сильные электролиты практически полностью ионизированы, при смешении растворов в реакцию могут вступать только ионы. Проиллюстрируем это положение несколькими примерами взаимодействия веществ, дающих при диссоциации ионы Ва 2+ и SО4 2- :
Продуктом всех этих реакций является белый мелкокристаллический осадок сульфата бария, не растворимый в кислотах и щелочах.
Получение одного и того же продукта при взаимодействии трех пар различных соединений легко объясняется ионной теорией. Ведь сущность приведенных трех реакций может быть выражена следующим ионным уравнением:
Следовательно, сульфат бария ВаS04 образуется всякий раз, когда при смешении растворов катионы Ва 2+ встречаются с анионами SО4 2- . Поэтому с помощью сульфат-ионов можно обнаруживать в растворе катионы Ва 2+ и, наоборот, с помощью ионов бария – анионы SО4 2- .
Таким образом, реакции, происходящие в растворах между электролитами, это реакции между ионами. Поэтому аналитическими реакциями обнаруживают не химические вещества, а образуемые ими катионы и анионы.
Анализ мокрым путем позволяет уже по результатам качественных испытаний установить формулу соединения. Например, если в исследуемом растворе обнаружены только ионы Na + и NO3 – ,то, очевидно, что он содержит нитрат натрия (натриевую селитру). Обнаружив в исследуемом веществе катион Fe 3+ и анион S04 2- , можно считать, что это сульфат железа (III) Fe2(SO4)3.
4. Условия выполнения аналитических реакций, их чувствительность, специфичность и селективность
Выполняя аналитическую реакцию, нужно строго соблюдать определенные условия, которые зависят от свойств получающегося продукта. При несоблюдении этих условий результат не может считаться достоверным.
Одним из условий выполнения реакций является среда анализируемого раствора. Например, нельзя обнаруживать ион Са 2+ действием оксалата аммония (NH4)2C2O4 в присутствии сильной кислоты, так как оксалат кальция СаС2О4 растворим в сильных кислотах. Осадок хлорида серебра AgCl, растворимого в аммиаке NH4OH, не может быть получен в аммиачной среде. Если осадок какого-либо вещества выпадает только в нейтральной среде, то анализируемый раствор предварительно нейтрализуют кислотой или щелочью. Например, осадок гидротартрата калия KHC4H406 может быть получен только в нейтральной среде.
Другим условием выполнения реакций является поддержание необходимой температуры раствора. Большинство аналитических реакций выполняют „на холоду”, т. е. при комнатной температуре или даже при охлаждении пробирки водой под краном. Это необходимо, например, при осаждении гексагидроксостибиата (V) натрия Na[Sb(ОН)6] или гидротартрата калия. Некоторые реакции требуют нагревания до определенной температуры. Так, обнаружение иона NH4 + действием щелочи на исследуемый раствор выполняют при нагревании.
Не менее важна достаточно высокая концентрация обнаруживаемого иона в растворе. Если образующееся соединение малорастворимо и выпадает в осадок при очень небольшой концентрации открываемого иона, то говорят, что реакция высокочувствительна. Если же образующееся соединение заметно растворимо в воде, то реакцию считают малочувствительной. Такие реакции удаются лишь при сравнительно высокой концентрации обнаруживаемого иона в анализируемом растворе (или при образовании в растворе окрашенного соединения).
Чувствительность реакций характеризуют количественно при помощи двух величин – обнаруживаемого минимума и минимальной концентрации.
Обнаруживаемый минимум – это наименьшее количество иона, которое удается обнаружить с помощью данной реакции (при соблюдении необходимых условий).
Выражают обнаруживаемый минимум в миллионных долях грамма – микрограммах, иногда обозначаемых буквой γ (lγ = 1 мкг = 10 -6 г). Например, при обнаружении иона К + в виде гексахлороплатината (IV) калия K2[PtCl6] обнаруживаемый минимум составляет 0,1 мкг.
Минимальная концентрация показывает, при каком разбавлении раствора реакция еще дает положительный результат.
При обнаружении иона К + в виде гексахлороплатината (IV) калия минимальная концентрация выражается отношением 1:10 000. Следовательно, катион К + можно обнаружить, если на 1 г его в растворе приходится не более 10 000 мл воды.
Чувствительность реакций на катионы меди (II)
Из приведенных данных видно, что чувствительность реакции с гексациано-ферратом (II) калия в 10 раз выше, чем реакции с аммиаком, и в 50 раз выше, чем с соляной кислотой.
В качественном анализе применяют только те реакции, обнаруживаемый минимум которых не превышает 50 мкг, а минимальная концентрация ниже, чем 1:1000.
Чувствительность реакций сильно зависит от условий их выполнения: концентрации реактивов, продолжительности их действия, способа наблюдения внешнего эффекта, температуры, присутствия посторонних веществ и т.д
Помимо чувствительности, большое значение для анализа имеет специфичность реакции.
Специфической называют такую реакцию, которая позволяет обнаружить ион в присутствии любых других ионов.
Например, специфична реакция обнаружения иона NH4 + действием щелочи при нагревании, так как в этих условиях аммиак NH3 может выделяться только из солей аммония:
Специфична и широко известная реакция на иод с крахмалом. Однако специфических реакций сравнительно немного.
Гораздо более распространены так называемые селективные, или избирательные, реакции, которые дают сходный внешний эффект с несколькими ионами. Например, оксалат аммония образует осадки с ограниченным числом катионов (Са 2+ , Ва 2+ , Sr 2+ и др.). Чем меньше таких ионов, тем более выражена избирательность (селективность) реакции.
Групповыми реактивами называются реактивы , которые одинаково реагируют с рядом ионов и могут применяться для отделения целой группы сходных ионов от других ионов.
Иногда посторонний ион, присутствуя в растворе, не взаимодействует непосредственно с прибавляемым реактивом, но, тем не менее, понижает чувствительность выполняемой реакции. По мере увеличения концентрации постороннего иона отрицательное влияние его усиливается. Наконец, при некотором предельном отношении концентраций обнаруживаемого и постороннего ионов реакция становится недостоверной. Например, катион РЬ 2+ можно обнаружить в виде иодида свинца РbI2 действием иодида калия в присутствии постороннего иона Сu 2+ , но только в том случае, если концентрация Сu 2+ будет превышать концентрацию РЬ 2+ не более чем в 25 раз. В данном случае предельное отношение концентраций РЬ 2+ и Сu 2+ равно 1 : 25.
Чтобы устранить влияние посторонних ионов, иногда пользуются так называемыми маскирующими средствами, которые переводят мешающие ионы в малодиссоциирующие или комплексные соединения. Концентрация посторонних ионов в растворе сильно понижается и помехи устраняются.
5. Методы повышения чувствительности реакций
Чувствительность реакции зависит от многих факторов и может быть повышена, если тем или иным способом увеличить концентрацию обнаруживаемого иона в растворе.
Обогатить раствор обнаруживаемым ионом и, следовательно, повысить чувствительность реакции можно с помощью ионного обмена, экстрагирования соединений органическими растворителями, путем соосаждения, а также некоторыми другими способами (дистилляция, электролиз, удаление примесей, мешающих выполнению реакции и т. п.).
Метод ионного обмена. Для концентрирования ионов этим методом в качественном анализе используют так называемые ионообменные смолы (иониты). Одни из них поглощают из раствора катионы и называются катионитами, другие сорбируют анионы и именуются анионитами.
Процесс ведут либо в статических условиях, внося зерна ионита в исследуемый раствор, либо в динамических, пропуская анализируемый раствор через “колонку” – трубку, наполненную ионитом. При этом каждое зерно ионита накапливает в себе обнаруживаемый ион.
Концентрирование ионов в статических условиях несложно. Переносят 2-3 мл испытуемого раствора в маленький фарфоровый тигель. Для поглощения катионов прибавляют 35-40 набухших зерен катионита (КУ-2, KУ-l или СБС) в виде двух капель суспензии, а для извлечения анионов – такое же количество зерен анионита (AB-l7, AB-16 или ЭДЭ-10П). Перемешивают содержимое тигля стеклянной палочкой 5 мин, сливают жидкость, а зерна ионита, адсорбировавшие обнаруживаемый ион, помещают в каплю реактива и наблюдают форму и цвет образовавшихся кристаллов.
Этот метод позволяет повысить чувствительность многих реакций в десятки и сотни раз.
Метод экстрагирования. Экстрагирование – это один из видов фазового разделения веществ. Оно основано на том, что некоторые органические растворители, не смешивающиеся с водой, обладают способностью извлекать из водных растворов отдельные компоненты смесей.
Для экстрагирования подбирают такой органический растворитель, в котором определяемое вещество растворяется хорошо, а другие компоненты смеси практически не растворяются.
Смесь двух жидкостей и растворенного вещества встряхивают, после чего оставляют стоять до появления резкой границы раздела между жидкостями. Из полученного экстракта определяемое вещество выделяют выпариванием, высушиванием, перегонкой или кристаллизацией.
Например, ионы железа (III) из солянокислых водных растворов чаще всего экстрагируют диэтиловым эфиром в виде железохлористоводородной кислоты Н[FeC14] желтого цвета. Это позволяет отделить железо от других элементов, не образующих хлоридных комплексов.
Метод соосаждения. Это один из наиболее простых и эффективных способов концентрирования ионов.
В раствор, содержащий следы определяемого иона, вводят посторонний катион (или анион), который и осаждают подходящим реактивом в виде малорастворимого соединения. При этом соосаждаются и следы определяемого иона. Таким образом, получающийся осадок играет роль коллектора, т. е. собирателя определяемых ионов. Установлено, что чем меньше концентрация определяемого иона в растворе, тем полнее он сорбируется коллектором.
Причины соосаждения определяемых ионов с коллекторами различны. К ним относятся адсорбция соосаждаемых ионов (или соединений) на поверхности коллектора, ионный обмен, образование твердых растворов.
В аналитической практике используются как неорганические (гидроокиси алюминия и железа, фосфат железа), так и органические соосадители (малорастворимые соединения ионов органических веществ, например метилового фиолетового, метилового оранжевого, нафталин,α -сульфокислоты, диметиламиноазобензола). Предпочтение отдается органическим соосадителям, которые позволяют выделять определяемые ионы из растворов с концентрацией до 1 : 10 13 и отличаются высокой селективностью. Кроме того, органические соосадители легко озоляются, благодаря чему соосаждаемые элементы удается получить в чистом виде.
Следует помнить, что несоблюдение оптимальных условий выполнения той или иной реакции (температура, рН раствора, количество реагента) ведет к понижению ее чувствительности.
К реакциям, выполняемым сухим путем, относятся реакции окрашивания пламени солями металлов, а также реакции окрашивания плава, полученного при нагревании вещества с тетраборатом калия или фосфатом натрия в ушке платиновой проволоки.
Большинство аналитических реакций проводят мокрым путем, т. е. в растворах, а в процессе растворения многие вещества распадаются (диссоциируют) на ионы – положительно и отрицательно заряженные частицы.
В качественном анализе для установления состава вещества к нему прибавляют другие вещества, вызывающие химические превращения, сопровождающиеся образованием новых соединений, которые имеют характерные свойства, а именно:
- определенное физическое состояние (осадок, жидкость, газ)
- известную растворимость в воде, кислотах, щелочах
- характерный цвет, запах и т.п.
Требования к качественным реакциям:
1. Реакция должна протекать быстро, практически мгновенно,
2. Быть необратимой, т. е. протекать преимущественно в одном направлении,
3. Быть по возможности специфической,
4. Отличаться высокой чувствительностью.
Специфическими называются реакции, которые дают возможность обнаруживать (открывать) одни ионы в присутствии различных других ионов.
Чувствительность реакции определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле раствора.
Реакции, позволяющие обнаружить искомые ионы в отдельных порциях сложной смеси при условии устранения влияния других ионов, называют дробными реакциями, а метод анализа, основанный на применении дробных реакций, называют дробным анализом. При этом порядок обнаружения катионов и анионов не имеет особого значения. При систематическом анализе, в отличие от дробного, соблюдается определенный порядок разделения и последующего открытия ионов. К обнаружению ионов приступают лишь после удаления из раствора всех других ионов, мешающих открытию искомых.
В аналитической химии все ионы делят на аналитические группы. Классификация катионов основана на растворимости их солей или других соединений. На основании различных классификаций катионов разработаны разные методы систематического анализа кати онов.
Методы систематического хода анализа катионов.
Наиболее распространенными являются сероводородный, аммиачно-фосфатный, кислотно-основной. Исторически первым был сероводородный метод , (1871 г. Предложен русским ученым М. О. Меншуткиным). В основу положена разная растворимость сульфидов катионов в зависимости от рН среды (табл. 1.1). Аммиачно-фосфатный метод - основан на разной растворимости фосфатов катионов (табл. 1.2), кислотно-основной - на разной растворимости гидроксидов и солей (табл. 1.3).
Классификация катионов по сероводородному методу
| Группа | Катионы | Групповой реагент | Растворимость соед. |
| І | К+, Na+, Lі+, NH+, Мg2+ | Нет | Сульфиды, карбонаты*, хлориды гидроксиды* растворяются в воде |
| II | Ва2+, Sг2+, Са2+ | (НН4)2С0 3 , NH3•Н2О+ NН4Cl, рН - 9,25 | Карбонаты не растворяются в воде |
| III | Fе2+, Fе3+, Сг3+, А13+, Мn2+, Ni2+ , Zn2+, Со2+ | (НН4)2S, NH3 • Н2О+NH4С1, рН = 9,25 | Сульфиды не растворяются в воде **, но растворяются в разб. кислотах |
| IV | Сu2+, Нg2+, Ві3+, Sn2+, Sn (IV), 5Ь (III), SЬ (V), Аs (III), Аs (V) | Н2S, НС1, рН = 0,5 | Сульфиды не растворяются в воде ** и разб. кислотах |
| V | Аg+, РЬ2+, Нg2+ | HCl | Хлориды не растворяются в воде и разб. кислотах |
**—сульфиды Сг3+, А13+ разлагаются водой
КАЧЕСТВЕННЫЙ АНАЛИЗ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Способы выполнения аналитических реакций

К реакциям, выполняемым сухим путем, относятся реакции окрашивания пламени солями металлов, а также реакции окрашивания плава, полученного при нагревании вещества с тетраборатом калия или фосфатом натрия в ушке платиновой проволоки.
Большинство аналитических реакций проводят мокрым путем, т. е. в растворах, а в процессе растворения многие вещества распадаются (диссоциируют) на ионы – положительно и отрицательно заряженные частицы.
В качественном анализе для установления состава вещества к нему прибавляют другие вещества, вызывающие химические превращения, сопровождающиеся образованием новых соединений, которые имеют характерные свойства, а именно:
- определенное физическое состояние (осадок, жидкость, газ)
- известную растворимость в воде, кислотах, щелочах
- характерный цвет, запах и т.п.
Требования к качественным реакциям:
1. Реакция должна протекать быстро, практически мгновенно,
2. Быть необратимой, т. е. протекать преимущественно в одном направлении,
3. Быть по возможности специфической,
4. Отличаться высокой чувствительностью.
Специфическими называются реакции, которые дают возможность обнаруживать (открывать) одни ионы в присутствии различных других ионов.
Чувствительность реакции определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле раствора.
Реакции, позволяющие обнаружить искомые ионы в отдельных порциях сложной смеси при условии устранения влияния других ионов, называют дробными реакциями, а метод анализа, основанный на применении дробных реакций, называют дробным анализом. При этом порядок обнаружения катионов и анионов не имеет особого значения. При систематическом анализе, в отличие от дробного, соблюдается определенный порядок разделения и последующего открытия ионов. К обнаружению ионов приступают лишь после удаления из раствора всех других ионов, мешающих открытию искомых.
В аналитической химии все ионы делят на аналитические группы. Классификация катионов основана на растворимости их солей или других соединений. На основании различных классификаций катионов разработаны разные методы систематического анализа кати онов.
Методы систематического хода анализа катионов.
Наиболее распространенными являются сероводородный, аммиачно-фосфатный, кислотно-основной. Исторически первым был сероводородный метод , (1871 г. Предложен русским ученым М. О. Меншуткиным). В основу положена разная растворимость сульфидов катионов в зависимости от рН среды (табл. 1.1). Аммиачно-фосфатный метод - основан на разной растворимости фосфатов катионов (табл. 1.2), кислотно-основной - на разной растворимости гидроксидов и солей (табл. 1.3).
Метод растирания порошков был предложен в 1898 г. Ф. М. Флавицким. Его применяют только для высоко чувствительных реакций с низкой энергией активации, так как для запуска таких реакций обычно достаточно небольшого механического воздействия: растирания или прессования. В настоящее время этот метод находит применение преимущественно в полевых условиях в геологии, а также – для быстрого прикидочного анализа на ионы Fe 3+ .
Выполняют анализ с использованием агатовых или яшмовых, иногда - фарфоровых, ступок. Так, при анализе методом растирания ионов Fe 3+ роданидным способом их наличие идентифицируют по появлению характерного розового окрашивания порошка. Аналогично можно определять ион Co 2+ в сульфате. В отличии от водных растворов, при растирании CoSO4 с роданидными солями сразу же появляется синее окрашивание, так как комплекс не гидратирует.
Метод перлов или плавов (термохимический) представляет собой определение ионов по окраске плава, полученного спеканием определяемого вещества с боратами или фосфатами щелочных металлов: Na2B4O7 – бура; Na2HPO4. При охлаждении полученной стекловидной массы в присутствии анализируемого иона появляется характерная окраска. Так ионыхромапридают боратному стеклу (перлу)зеленый цвет, а ионы кобальта в этих же условиях дают при охлаждении перл с розовой или фиолетовой окраской.
Пирохимическая реакция позволяет очень быстро определить катионы по окрашиванию пламени газовой горелки, которое характерно для ионов с низкими значениями энергии ионизации, в первую очередь, это ионы щелочных и щелочноземельных металлов. Данный метод применяют при предварительном испытании пробы, так как точность и чувствительность его не высока, а результаты не всегда однозначны. Для идентификации катионов по окрашиванию пламени пользуются справочными данными (таблица 3.6) или делают контрольный опыт с раствором не содержащим мешающих примесей.
Таблица 3.4 – Пирохимическое определение катионов по
окрашивание пламени некоторыми элементами
| ион | окраска пламени | ион | окраска пламени |
| Li * литий | кармино-красная, | In * индий | сине-фиолетовая |
| Na * натрий | желтая, интенсивная | Tl * таллий | изумрудно-зеленая |
| K * калий | лиловая, слабая | Pb * свинец | красно-фиолетовая |
| Rb * рубидий | розово-фиолетовый | As * мышьяк | бледно-синий |
| Cs * цезий | красно-фиолетовая | Sb * сурьма | бледно-синий |
| Ca * кальций | кирпично-красная, интенсивная | Se * селен | бледно-синий |
| Sr * стронций | кармино-красная, интенсивная | Te * теллур | изумрудно-зеленый |
| Ba * барий | бледно-зеленая | Cu * медь | зеленый, голубой |
| B * бор | зеленый | Mo * молибден | желто-зеленый |
Для проведения анализа применяют предварительно прокаленную в растворе HCl платиновую или нихромовую петлю, в которую помещают порошок (можно и каплю раствора, но при этом чувствительность реакции уменьшается). Петлю с образцом вносят в среднюю, наиболее горячую, часть пламени и определяют его цвет. Для повышения чувствительности иногда наблюдения ведут через специальные стекла – светофильтры, поглощающие мешающее излучение.
Сущность метода возгонов заключается в образовании некоторыми металлами при нагреве на воздухе летучих окрашенных оксидов или же спеков (корольков). Для получения возгона используют калильную трубку. Иногда нагревание выполняют над раскаленным углем (восстановитель). Идентификацию проводят по цвету налетов в холодной части трубки или по цвету королька. Так свинец при нагревании на воздухе образует налет оксида характерного желтого цвета.
Кмокрым способам анализа относят все виды определений, при которых анализируемое вещество предварительно переводят в раствор. Это такие методы, как: пробирный анализ, капельный, экстракционный и микрокристаллоскопический. В качестве растворителя чаще всего используют воду, реже – органические растворители (CCl4, бензол, спирты и эфиры) из-за их летучести и токсичности.
Пробирный анализ выполняют в цилиндрических пробирках объемом 5 – 10 мл, в которые отбирают примерно 0,5 – 1 мл анализируемого раствора и добавляют по каплям реагент. Так как большинство реакций очень чувствительны и протекают с высокой скоростью, то в среднем добавляют 3 – 5 капель реагента, которых вполне достаточно для появления четкого аналитического признака. При необходимости анализ может выполняться с нагревом на водяной или песочной бане, или на газовой горелке.

Экстракционный анализ используют при определении веществ из разбавленных растворов. Аналитический признак - появление характерного окрашенного кольца органического растворителя (экстрагента) в верхней части раствора или же окрашенных капель внизу пробирки (при большой концентрации вещества). В качестве экстрагентов обычно применяют готовую смесь органического растворителя с реагентом, чаще всего - комплексоном. Таким образом поступают при определении ионов цинка раствором дитизона (реагент) в CCl4 (экстрагент). Аналитическим признаком ионов Zn 2+ является появление в верхней части пробирки красного кольца.
Если экстрагент – летуч, а признак – неустойчив, то в водный раствордобавляют сначала реагент, а потом уже экстрагент. Например, при определении ионов Co 2+ : сначала проводят реакцию в водном растворе с роданидом калия, а затем - экстракцию образовавшегося роданидного комплекса амиловым спиртом (образование сине-фиолетового кольца).
Микрокристаллоскопический анализ основан на идентификации ионов по цвету и форме кристаллов. Он предложен академиком Ловиц Т. Е. в 1798 г. Реакцию проводят на предметном стекле, куда наносят каплю исследуемого препарата и реагента. Рост кристаллов и их окраску наблюдают в микроскоп и сравнивают с образцами в определителях (рис. 3.4). При необходимости ускорения роста кристаллов препарат слегка подсушивают.
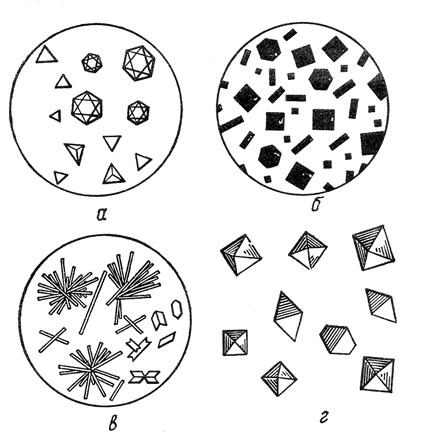
Рисунок 3.4 – Сравнительный вид кристаллов различных соединений:
а – лимонного цвета уранилацетата натрия (NaUO2(CH3COO)3);
б – черные или коричневые гексанитрокупрата (II) калия-свинца
в – белого цвета сульфата кальция дигидрата – гипса (CaSO4×2H2O);
г – бесцветные гексахлоростанната (IV) аммония ((NH4)2[SnCl6]).
Форма кристаллов может значительно варьировать в зависимости от концентрации растворов, скорости кристаллизации, температуры и влажности среды (рис. 3.5). Тем не менее, данный вид анализа не потерял своей значимости, так как ряд соединений имеет достаточно характерный цвет и вид кристаллов, что позволяет их надежно интерпретировать (рис. 3.4 и 3.5).
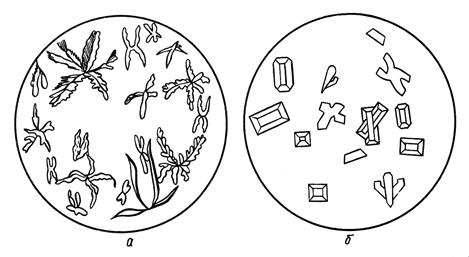
Рисунок 3.5 Кристаллы MgNH4PO4×6H2O, выделенные при определении ионов Mg 2+ из а) концентрированного; б) разбавленного раствора.
Капельный метод анализа впервые предложен в 1920 г. профессором Тананаевым Н. А. и не потерял своей актуальности до сих пор. Его применяют при малых объемах проб или концентрации вещества, а выполняют на фильтровальной бумаге, часовом стекле или специальных стеклянных пластинках с углублением, что позволяет существенно повысить чувствительность реакций. При проведении капельного анализа на фильтр последовательно наносят с помощью пипетки капли анализируемого раствора и реагента (рис. 3.6). Аналитическим признаком в этом методе является характерная окраска образовавшегося пятна. Например, ионы Mn 2+ со свежеприготовленным раствором аммиаката серебра дают на фильтре пятно серого цвета. Аналогично можно определить ионы железа с помощью гексацианоферратов калия, алюминия – ализариновой пробой.
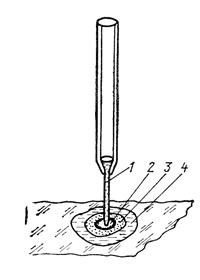
Рисунок 3.6. – Прибор для проведение капельной реакции: 1 – капилляр
или пипетка с раствором реагента; 2 – образовавшееся цветное пятно;
3 – край пятна анализируемого раствора; 4 – граница растворителя.

Реакции, применяемые в качественном химическом анализе, чащё всего проводят в растворах. Анализируемое вещество сначала растворяют, а затем действуют на полученный раствор соответствующими реактивами.
Для растворения анализируемого вещества применяют дистиллированную воду, уксусную и минеральные кислоты, царскую водку, водный раствор аммиака, органические растворители и т. п. Чистота применяемых растворителей является важным условием для получения правильных результатов.
Переведенное в раствор вещество подвергают систематическому химическому анализу. Систематический анализ состоит из ряда предварительных испытаний и последовательно выполняемых операций.
Химический анализ исследуемых веществ в растворах называют анализом мокрым путем.
Реакции обнаружения при помощи посредством представляют собой примеры мокрым путем.
Реакции окрашивания пламени и получение окрашенных перлов проводят с небольшим количеством вещества, которое вносят на платиновой или нихромовой проволоке в пламя газовой горелки или паяльной лампы.
Для некоторых веществ признаками их качественного состава являются летучесть, способность возгоняться или разлагаться при нагревании. Так, при нагревании в пробирке смеси нитрата ртути с карбонатом натрия происходит разложение соли ртути и на холодных стенках пробирки оседают мельчайшие капельки металлической ртути:
Реакции разложения соли или возгонку проводят в пробирках из тугоплавкого стекла, в фарфоровых и металлических чашках или тиглях.
В. М. Севергин (1765—1826).
К реакциям сухим путем относят также реакции, протекающие при растирании порошков исследуемых веществ с твердыми реагентами (см. § 7). Большинство таких реакций протекает при участии влаги, содержащейся в воздухе.
Читайте также:

