Почему плавление вещества происходит при постоянной температуре кратко
Обновлено: 02.07.2024
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления. Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной.
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — [λ] = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*10 5 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*10 5 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm .
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится. Переход вещества из жидкого состояния в твердое называется отвердеванием, или кристаллизацией. Температура, при которой вещество кристаллизуется, называется температурой кристаллизации.
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А до точки D) и времени охлаждения (от точки D до точки K). На нем по горизонтальной оси отложено время, а по вертикальной — температура.

Из графика видно, что наблюдение за процессом началось с момента, когда температура льда была -40 °С, или, как принято говорить, температура в начальный момент времени tнач = -40 °С (точка А на графике). При дальнейшем нагревании температура льда растет (на графике это участок АВ). Увеличение температуры происходит до 0 °С — температуры плавления льда. При 0°С лед начинает плавиться, а его температура перестает расти. В течение всего времени плавления (т.е. пока весь лед не расплавится) температура льда не меняется, хотя горелка продолжает гореть и тепло, следовательно, подводится. Процессу плавления соответствует горизонтальный участок графика ВС. Только после того как весь лед расплавится и превратится в воду, температура снова начинает подниматься (участок CD). После того, как температура воды достигнет +40 °С, горелку гасят и воду начинают охлаждать, т. е. тепло отводят (для этого можно сосуд с водой поместить в другой, больший сосуд со льдом). Температура воды начинает снижаться (участок DE). При достижении температуры 0 °С температура воды перестает снижаться, несмотря на то, что тепло по-прежнему отводится. Это идет процесс кристаллизации воды — образования льда (горизонтальный участок EF). Пока вся вода не превратится в лед, температура не изменится. Лишь после этого начинает уменьшаться температура льда (участок FK).
Вид рассмотренного графика объясняется следующим образом. На участке АВ благодаря подводимому теплу средняя кинетическая энергия молекул льда увеличивается, и температура его повышается. На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: упорядоченное пространственное расположение его молекул сменяется неупорядоченным, меняется расстояние между молекулами, т.е. происходит перестройка молекул таким образом, что вещество становится жидким. Средняя кинетическая энергия молекул при этом не меняется, поэтому неизменной остается и температура. Дальнейшее увеличение температуры расплавленного льда-воды (на участке CD) означает увеличение кинетической энергии молекул воды вследствие подводимого горелкой тепла.
При охлаждении воды (участок DE) часть энергии у нее отбирается, молекулы воды движутся с меньшими скоростями, их средняя кинетическая энергия падает — температура уменьшается, вода охлаждается. При 0°С (горизонтальный участок EF) молекулы начинают выстраиваться в определенном порядке, образуя кристаллическую решетку. Пока этот процесс не завершится, температура вещества не изменится, несмотря на отводимое тепло, а это означает, что при отвердевании жидкость (вода) выделяет энергию. Это как раз та энергия, которую поглотил лед, превращаясь в жидкость (участок ВС). Внутренняя энергия у жидкости больше, чем у твердого тела. При плавлении (и кристаллизации) внутренняя энергия тела меняется скачком.
Металлы, плавящиеся при температуре выше 1650 ºС, называют тугоплавкими (титан, хром, молибден и др.). Самая высокая температура плавления среди них у вольфрама — около 3400 °С. Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетостроении и космической технике, атомной энергетике.
Подчеркнем еще раз, что при плавлении вещество поглощает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая определенное количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Недаром их можно заметить зимой в морозную погоду сидящими на льду, который покрывает реки и озера. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
Плавление аморфных веществ .
Наличие определенной точки плавления — это важный признак кристаллических веществ. Именно по этому признаку их можно легко отличить от аморфных тел, которые также относят к твердым телам. К ним, в частности, относятся стекла, очень вязкие смолы, пластмассы.
Аморфные вещества (в отличие от кристаллических) не имеют определенной температуры плавления — они не плавятся, а размягчаются. При нагревании кусок стекла, например, сначала становится из твердого мягким, его легко можно гнуть или растягивать; при более высокой температуре кусок начинает менять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса принимает форму того сосуда, в котором лежит. Эта масса сначала густая, как мед, затем — как сметана и, наконец, становится почти такой же маловязкой жидкостью, как вода. Однако указать определенную температуру перехода твердого тела в жидкое здесь невозможно, поскольку ее нет.
Теплота плавления .
Теплота плавления — это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое. Теплота плавления равна тому количеству теплоты, которое выделяется при кристаллизации вещества из жидкого состояния. При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энергии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления измеряют в джоулях на килограмм (Дж/кг) и обозначают греческой буквой λ (лямбда).
Удельная теплота кристаллизации равна удельной теплоте плавления, поскольку при кристаллизации выделяется такое же количество теплоты, какое поглощается при плавлении. Так, например, при замерзании воды массой 1 кг выделяются те же 332 Дж энергии, которые нужны для превращения такой же массы льда в воду.
Чтобы найти количество теплоты, необходимое для плавления кристаллического тела произвольной массы, или теплоту плавления, надо удельную теплоту плавления этого тела умножить на его массу:
Теплота сгорания .
Теплота сгорания (или теплотворная способность, калорийность) — это количество теплоты, выделяющейся при полном сгорании топлива.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обычное топливо (уголь, нефть, бензин) содержит углерод. При горении атомы углерода соединяются с атомами кислорода, содержащегося в воздухе, в результате чего образуются молекулы углекислого газа. Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива. Удельную теплоту сгорания обозначают буквой q и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты Q, выделяющееся при сгорании m кг топлива, определяют по формуле:
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.

Все мы знаем из школьного курса физики, что при изменении веществом своего агрегатного состояния происходит фазовый переход. Вещество в твёрдом состоянии может напрямую перейти в газообразное. Например, когда температура сухого льда (твёрдого диоксида углерода, CO2) повышается, он превращается в газ. Этот процесс называется сублимацией или возгонкой.
Но чаще происходят другие процессы. К примеру, когда вода замерзает, из жидкого состояния она переходит в твёрдое (кристаллизация). Когда камни плавятся в лаве, из твёрдого вещества они превращаются в жидкость (плавление). Когда вода закипает в чайнике, из жидкости она становится газом (испарение и кипение). Пока рассматриваемое вещество при подведении или отведении дополнительного тепла переходит в новое состояние – жидкое, твёрдое или газообразное, температура не меняется. Почему так происходит?
Подробное объяснение почему при плавлении температура не меняется
Представьте, что вы спокойно пьёте лимонад (который имеет примерно ту же теплоёмкость, что и обычная вода). В этом лимонаде плавают кусочки льда. Температура этой наполовину лимонадной, наполовину ледяной смеси находится вблизи нуля градусов по Цельсию. Пока вы держите в ладонях стакан и наблюдаете за происходящим в нём процессом, лёд начинает таять, однако содержимое ёмкости не нагревается, пока весь лёд в ней не растает.
Вопрос. Почему при плавлении температура не меняется? Тепловая энергия, поступающая из окружающей среды, плавит лёд, не нагревая смесь в целом. Делает ли это уравнение для расчёта количества теплоты ( , где — количество теплоты, — масса образца, — изменение температуры) бесполезным? Вовсе нет – это лишь означает, что оно неприменимо к фазовому переходу.
Можно построить график зависимости температуры вещества от количества переданной теплоты . К примеру, на Рис. 1 представлен график фазовых переходов льда, взятого из морозильной камеры. Участок соответствует нагреванию льда, участок — плавлению льда, участок — нагреванию получившейся воды, участок — кипению воды, участок — нагреванию полученного пара.

Рис. 1. График фазовых переходов H20.
Как видно, кривая обычно возрастает, то есть увеличение теплоты приводит к возрастанию температуры. Однако кривая идёт горизонтально при фазовых переходах (при температурах и ), поскольку изменение состояния вещества требует энергии. После того, как переход завершается, температура вновь начинает возрастать.
Давайте представим, что вы взяли мешок со льдом и поставил его на кухонную плиту. Перед этим температура льда была ниже температуры замерзания воды, скажем -5 °C. Но на плите она начала изменяться. Пока фазовый переход не происходит, температура льда линейно возрастает при увеличении количества подведенной теплоты , где c = 2100 Дж/(кг⋅°C) — удельная теплоемкость льда.
Когда же лёд достигает температуры в t1 = 0 °C, он становится слишком тёплым, чтобы оставаться в твёрдом состоянии, и начинает плавиться, испытывая фазовый переход (кривая на графике выравнивается). Этот процесс – разрушение кристаллической решётки льда – нуждается в энергии, которая вырабатывается источником тепла. Вот почему при плавлении температура не меняется.
Вы измеряете температуру воды. Удивительно, но пока вода кипит, её температура также не изменяется. И снова, для завершения перехода – из жидкого состояния в газообразное – требуется определённое количество теплоты.
Что же произойдёт дальше, когда мешок расширится до немыслимых размеров? Лучше не проверять, поскольку мешок может взорваться, и вы ошпаритесь горячим паром и кипящей водой.

В твердых кристаллических телах молекулы расположены упорядоченно, образуя кристаллическую решетку, структура которой воспроизводится во всем объеме – такое расположение частиц называется дальним порядком. При нагревании тела кинетическая энергия молекул увеличивается, и при достижении температуры плавления структура решетки начинает разрушаться, твердое тело теряет форму — начинается процесс плавления. При охлаждении происходит отвердевание — переход из жидкой фазы в твердую.
Почему происходит плавление
В твердом состоянии молекулы и атомы находятся в узлах решетки, совершая непрерывные колебания вблизи фиксированного положения. Такие колебания не нарушают кристаллическую структуру. Прочность решетки обеспечивается межмолекулярными связями. В процессе нагрева тела происходит передача тепловой энергии, которая преобразуется во внутреннюю энергию молекул, увеличивая их скорость и частоту колебаний. При достижении некоторого критического значения температуры Tпл (температуры плавления) происходит разрыв межмолекулярных связей, молекулы покидают свои места, что приводит к изменению формы тела, которое начинает переходить в жидкое состояние.
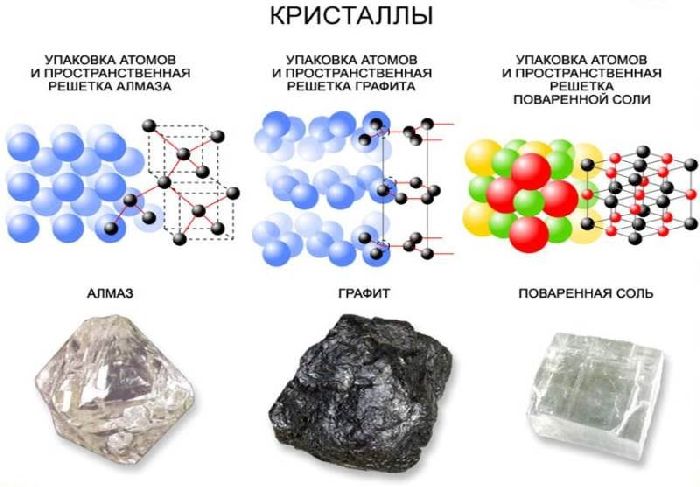
Рис. 1. Примеры строения кристаллических решеток: графит, алмаз,NaCl.
Итак, плавлением называется процесс перехода из твердого состояния в жидкое.
Что такое отвердевание
Наблюдения показывают, что если расплавленное вещество охладить, то при достижении температуры Tотв (температура отвердевания) начинается обратный процесс перехода из жидкого состояния в твердое. Этот фазовый переход называется отвердеванием или кристаллизацией. Экспериментально доказано, что для кристаллических тел Tпл = Tотв. “Горячие” молекулы”, при охлаждении теряют скорость и отдают тепло в окружающую среду. Внутренняя энергия уменьшается, частицы под воздействием сил молекулярного взаимодействия начинают “занимать” постоянные места, восстанавливая структуру решетки.
Процессы плавления и отвердевания происходят не скачкообразно, а постепенно, так, что одновременно могут соседствовать твердая и жидкая компоненты. Эксперименты показывают, что до окончания плавления (или отвердевания) всей массы вещества, его температура остается постоянной.
Металлы, температура плавления которых больше 1650 0 С, называют тугоплавкими. Например, температура плавления вольфрама равна 3370 0 С. Поэтому из него делают долговечные нити накаливания для ламп. Тугоплавкие металлы и их сплавы незаменимы в ракетостроении, атомной энергетике, металлургии, космической технике — везде, где необходимы высокие жаропрочные свойства.
Графическое представление процессов плавления и отвердевания
График плавления и отвердевания кристаллических тел дает наглядное представление о временной зависимости этих фазовых переходов.
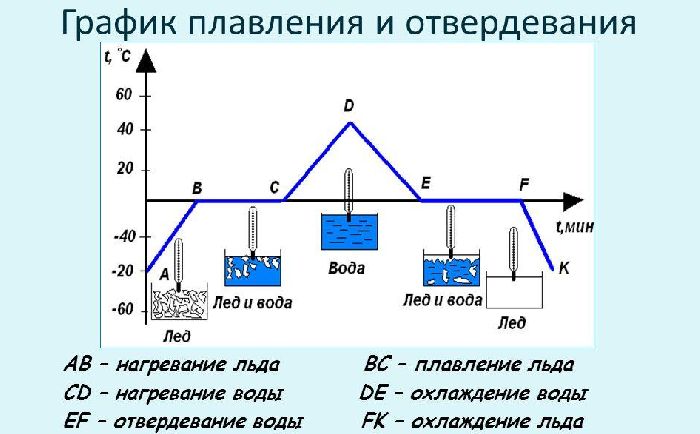
Рис. 2. График плавления и отвердевания вода-лед.
Обычная вода является хорошим примером для иллюстрации обсуждаемых явлений. На представленном графике по оси абсцисс отложено время t, а по оси ординат — температура. Пускай изначально, в момент времени t = 0, когда температура льда (кристалла) была равна -40 0 С, начнется подача тепла — нагрев. Рассмотрим далее временную зависимость температурной зависимости T(t):
- На участке АВ, от -40 0 С до 0 0 С (температура плавления льда) существует лед в кристаллическом виде;
- Участок ВС — происходит стадия плавления, присутствуют одновременно лед и вода. Температура остается постоянной, равной 0 0 С;
- СD — в точке С закончилось плавление, существует только жидкая фаза — вода;
- DЕ — в точке D прекратился нагрев, происходит остывание вплоть до точки Е, т.е. до температуры 0 0 С. Присутствует только вода в жидком виде;
- EF — в точке Е, начинается отвердевание, появляются кристаллы льда, но одновременно присутствует и жидкая фаза. Температура остается постоянной, равной 0 0 С;
- FK — в точке F произошло полное отвердевание, остается только лед в кристаллическом виде, температура которого постепенно понижается.
Что такое удельная теплота плавления
Удельной теплотой плавления λ (греческая буква “лямбда”), называется физическая величина, равная количеству тепла, которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкую фазу. Формула удельной теплоты плавления выглядит так:
m — масса плавящегося вещества, кг;
Q — количество тепла, переданное веществу при плавлении, Дж.
Значения λ для разных веществ определяют экспериментально. Размерность λ следует из формулы (1):
Зная λ, можно рассчитать количество тепла Q, которое необходимо сообщить телу массой m для его полного расплавления:
При отвердевании ровно такое же количество тепла будет возвращено в окружающую среду.
Некоторые вещества при нагревании минуют стадию плавления и сразу испаряются. Такой процесс называют сублимацией или возгонкой. Примером такого вещества может служить кристаллический йод. Обратный переход из газообразного состояния, проходящий без образования жидкой фазы, называется десублимацией. Примерами таких переходов служат образование кристаллов йода из паров йода и выпадение инея и снежинок из водяных паров воздуха.

Рис. 3. Образование узоров инея на стекле.
Что мы узнали?
Итак, мы узнали, что плавление и отвердевание кристаллических тел происходит при одинаковых температурах. В процессе плавления и отвердевания температура вещества остается постоянной. Удельной теплотой плавления λ называется величина, равная количеству тепла, которое необходимо передать твердому телу массой 1 кг, для полного превращения его в жидкое состояние.
Читайте также:
- Как образуется магнитное поле земли кратко
- Что такое ген человека простыми словами кратко
- Как оборудуют рабочее место повара для приготовления гарниров из макаронных изделий кратко
- Что такое симпатия 6 класс обществознание кратко
- Какое место занимает исламский фактор в развитии современного мира кратко

