Почему аминокислоты амфотерные органические соединения кратко
Обновлено: 02.07.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Тема: Аминокислоты как амфотерные бифункциональные
органические соединения
Аминокислоты — это органические соединения, содержащие две функциональные группы — аминогруппу (— NH 2 ) и карбоксилъную группу (- СООН).
Их можно рассматривать как производное карбоновых кислот, в радикале которых атом водорода замещен на аминогруппу рис.
уксусная кислота аминоуксусная кислота
Количество функциональных групп, которые могут входить в состав аминокислот, различно.
Простейшими аминокислотами являются одноосновные моноаминокислоты, состав которых выражают общей формулой
NH 2 – R — СООН или C n H 2 n NH 2 COOH
по рациональной номенклатуре атом углерода, расположенный рядом (соседний) с карбоксильной группой, обозначают буквой а;
по систематической номенклатуре нумеруют углеродную цепь, начиная с атома углерода карбоксильной группы. Многие аминокислоты имеют тривиальное название. На практике чаще используют тривиальную номенклатуру. Наибольшее значение имеют а-аминокислоты, так как они участвуют в построении белковых молекул.
Состав а-аминокислот можно выразить общей формулой:
R - CH - COOH
Физические свойства. Аминокислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических растворителях. Многие кислоты имеют сладкий вкус. При температуре 250—300 °С они разлагаются.
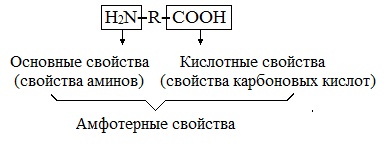
Химические свойства. Аминокислоты содержат в своем составе две функциональные группы противоположного характера. Аминогруппа обуславливает основные свойства аминокислот, а карбоксильная группа — кислотные. Следовательно, по аналогии с неорганическими веществами (гидроксиды алюминия, цинка), аминокислоты — это органические амфотерные соединения.
H 2 N – R - COOH
основные свойства кислотные свойства
(свойства аминов) (свойства карбоновых кислот)
Реакции с участием карбоксильной группы .
Как кислоты они взаимодействуют с активными металлами, оксидами и гидроксидами металлов, солями слабых летучих кислот, а также со спиртами (реакция этерификации):
Реакции с участием аминогруппы
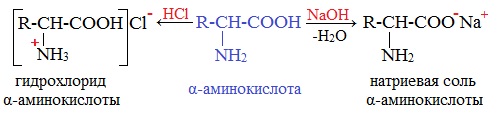
Как основания аминокислоты реагируют с кислотами
NH 2 - CH 2 - COOH + НС 1 [H 3 N - CH 2 — СООН ] + С l -
гидрохлорид (хлороводородная соль)
Особые свойства аминокислот. Наличие в молекуле аминокислоты двух функциональных групп приводит к появлению новых свойств.
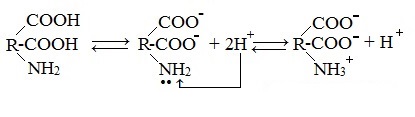
Взаимодействие внутри молекулы. Водные растворы аминокислот могут иметь нейтральную, щелочную или кислую среду в зависимости от того, сколько они содержат амино- и карбоксильных групп. Это объясняется тем, что при растворении в воде карбоксильная группа отщепляет ион водорода, который присоединяется к аминогруппе, т. е. протекает внутримолекулярная нейтрализация (кислота + основание). Это приводит к образованию внутренней соли, молекула которой представляет собой биполярный ион:
H 2 N - CH 2 - COOH H 2 N - CH 2 – COO - + Н + + H 3 N - CH 2 – COO -
внутренняя соль (биполярный ион)
Из примера следует, что водные растворы моноаминомонокарбоновых кислот нейтральны (одна группа —СООН и одна группа — NH 2 ). Глутаминовая же кислота образует кислый раствор, так как содержит две группы — СООН и одну группу — NH 2 , а лизин — щелочной (в его составе одна групп - СООН и две группы - NH 2 ).
Взаимодействие аминокислот друг с другом (реакции конденсации). Молекулы аминокислот могут реагировать друг с другом. При этом происходит взаимодействие карбоксильной группы одной молекулы и аминогруппы другой молекулы. Реакция конденсации сопровождается отщеплением молекулы воды и образованием пептида. При конденсации двух молекул аминокислоты образуется дипептид:
H 2 N - CH 2 - C + Н – NH - CH 2 - СООН H 2 N – CH 2 – C + H 2 O
OH NH – CH 2 – COOH
Пептиды — это органические соединения, состоящие из остатков а-аминокислот, соединенных между собой пептидными (амидными) связями — CO — NH — и имеющие невысокие значения относительных молекулярных масс (до 10000).
Например, природный пептид окситоцин (стимулирует выделение молока молочными железами) имеет относительную молекулярную массу 1007, а инсулин (регулирует содержание сахара в крови) — 5734.
Пептиды являются продуктами частичного гидролиза белков, т. е. это простейшие полипептиды. Они, в кислой или щелочной среде, а также под действием ферментов, подвергаются дальнейшему гидролизу с образованием пептидов с меньшей относительной молекулярной массой или а-аминокислот.
Пептиды, как и белки, играют важную роль в процессах жизнедеятельности. Пептидами являются многие гормоны, некоторые антибиотики и токсины, ферменты. Многие пептиды применяют в медицине и сельском хозяйстве.
Получение аминокислот. Биологически важные (природные) а-аминокислоты получают гидролизом белков.
Одним из синтетических способов получения а -аминокислот является замещение атома галогена на аминогруппу в соответствующих галогенозамещенных карбоновых кислотах. Выделяющийся при замещении галогеноводород связывается избытком аммиака:
В связи с этим аминокислоты делят на заменимые и незаменимые.
Заменимые — это аминокислоты, которые синтезируются в организме . К ним относятся: глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота и др.
Незаменимые — это аминокислоты, которые не синтезируются в организме и поступают только с пищей . Это лизин, валин, фенилаланин, триптофан, лейцин и др. Их недостаток в пище приводит к нарушению многих функций организма и может быть причиной прекращения роста организма, истощения, несмотря на достаточную калорийность питания.
Например, белок кукурузы зеин не содержит лизина. В опытах с животными, которые получали с пищей один только этот белок, наблюдалась, несмотря на обильное кормление, потер веса. Отсутствие в пище триптофана может быть причиной тяжелого заболевания глаз — катаракты.
Поэтому эти аминокислоты нужно добавлять в пищу, так как организм может усваивать их в свободном виде. Необходимо добавлять недостающие аминокислоты и в корм животным. Даже малые их дозы позволяют ускорить рост животных и снизит расход кормов.
Применение. Некоторые аминокислоты применяют в качестве лечебного средства, например, глутаминовую кислоту — при нервных заболеваниях, гистидин — при язве желудка. Лекарственные препараты имеются и среди производных n -аминобензойной кислоты (новокаин, анестезин).
Анестезин и новокаин обладают обезболивающим действием. n -Аминосалициловую кислоту применяют как противотуберкулезный препарат.
Аминокислоты находят применение и в пищевой промышленности. Например, глутаминовую кислоту добавляют в консервы и пищевые концентраты для улучшения вкуса.
Аминокислоты неразветвленного строения с функциональными группами на концах молекул используют в производстве синтетических волокон. Например, поликонденсацией е -аминокапроновой кислоты получают капрон:
е -аминокапроновая кислота
Напишите уравнение реакции поликонденсации этой кислоты.
Отличие этих полимеров от белков (полипептидов) заключается в том, что здесь цепь образована не а-аминокислотами.
1. Составьте структурные формулы изомерных аминокислот состава C 4 H 9 О 2 N назовите их.
2. Докажите амфотерность а-аминопропионовой кислоты (напишите не мене трех уравнений).
3. Напишите структурные формулы и назовите дипептиды, образующиеся при нагревании смеси глицина и а -аланина. Укажите, сколько дипептидов может образоваться.
4. Напишите уравнения реакций получения:
а) хлороводородной соли а-аминомасляной кислоты;
б) аминоуксусной кислоты из ацетилена.
5. При взаимодействии четырех молекул аминокислот выделяется молекул воды:
а) три; б) две; в) четыре; г) одна.
6. Определите формулу одноосновной моноаминокарбоновой кислоты, входящей в состав белков, для полной нейтрализации которой потребовался раствор, содержащий 16,2 г бромоводородной кислоты.
7. Для полной нейтрализации смеси уксусной и аминоуксусной кислот требуется 150 мл 2М раствора гидроксида натрия. Исходная смесь может прореагировать с 73 г 10%-ного раствора соляной кислоты. Определите массовые доли (%) веществ в исходной смеси.
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
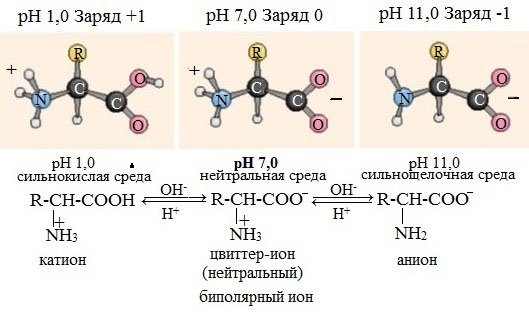
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
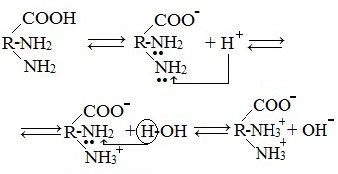
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
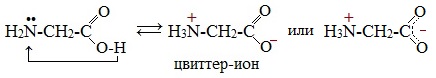
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
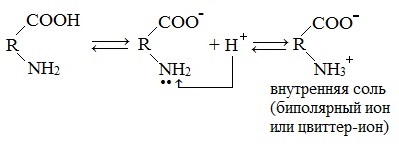
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
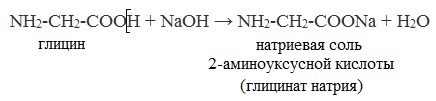
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
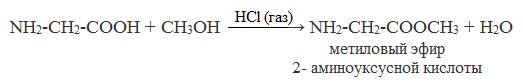
в) взаимодействие с аммиаком
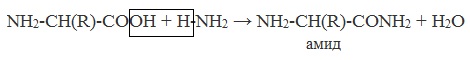
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
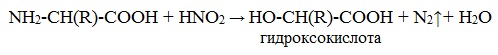
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
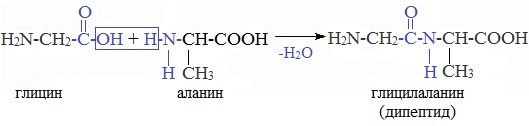
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Для начала давайте выясним, что собой представляют аминокислоты. Это органические соединения, молекулярная структура которых представлена карбоксильной и аминной группами. В состав аминокислот входят такие элементы, как: водород, углерод, кислород, азот. Некоторые их виды представлены в генетическом коде человека.
Аминокислоты являются вторичным продуктом карбоновых кислот, в которых атомы водорода заменены аминогруппами. В итоге мы имеем соединение, которое содержит две группы — карбоксильную и аминогруппу. Аминогруппа определяет основные свойства аминокислот, а карбоксильная отвечает за их кислотные характеристики. Получается, что аминокислоты обладают как основными, так и кислотными свойствами, что характерно для амфотерных соединений. По этой причине они и называются амфотерными.
Кислотные свойства аминокислот обусловлены наличием в них карбоксильных групп. Основные же свойства определяются входящими в их состав аминогруппами, которые могут соединяться с ионами водорода, что приводит к образованию групп замещенного аммония. В данном случае амфотерные свойства аминокислот будут обусловлены взаимодействием карбоксильных групп с аминогруппами.
Примером амфотерных соединений являются белки, в состав которых входят аминокислоты, обладающие, одновременно, свойствами кислот и оснований. По этой причине они способны образовывать соли двух разных видов. Если говорить проще, то при соединении со щелочами аминокислоты будут проявлять свойства кислот, а при взаимодействии с кислотами, будут вести себя как основания. В этом и выражаются их амфотерные свойства.
Белки являются основным строительным материалом живых организмов, будь то человек, животное, или растение. Они несут ответственность за все его основные функции. В свою очередь, в состав белков входят аминокислоты, представленные карбоновыми кислотами, органическими соединениями, карбоксильными группами. По этой причине белки также обладают амфотерными свойствами.
1. Какие органические соединения относятся к классу аминокислот?
К классу аминокислот относят органические соединения, содержащие две функциональные группы (амино) $\mathrm$ и карбоксильную $\mathrm$
2. В чем особенность химического строения аминокислот, выделяемых из природных белков?
Особенностью строения большинства аминокислот, которые выделяют из природных белков, является наличие функциональных групп $\mathrm$ и $\mathrm$ у одного и того же атома углерода.
3. Почему аминокислоты называют амфотерными соединениями?
Аминокислоты обладают свойствами кислот

и свойствами оснований

4. Какую реакцию на индикаторы (кислую, основную или нейтральную) дает раствор аминоуксусной кислоты? Ответ поясните.
Аминокислота в растворе даёт нейтральную реакцию потому, что протон карбоксильной группы присоединяется к аминогруппе с образованием такой внутренней соли.
5. Какие из веществ, формулы которых: $\mathrm$ $\mathrm$ — можно отнести к аминокислотам?
К аминокислотам относят:
6. С какими из веществ может реагировать аминоуксусная кислота: гидроксид калия, вода, соляная кислота, аминокислота аланин $\mathrm?$ Составьте два любых уравнения реакций.

7. Дайте название каждой из групп атомов. В составе веществ каких классов органических соединений они содержатся?
Названия групп: а) $\mathrm$ карбоксильная; б) $\mathrm$ гидроксильная; в) $\mathrm$ амидная; г) $\mathrm аминная.
В составе какие классов: а) карбоновые кислоты и аминокислоты; б) спирты; в) дипептиды; г) амины и аминокислоты.
8. К какому классу соединений относятся вещества, которые образуются в реакции аминокислот: а) со щелочами; б) с минеральными кислотами?
Все эти соединения относятся к классу солей.
9. Рассчитайте массу раствора щелочи с массовой долей гидроксида калия 12 %, который необходимо взять для реакции с аминоуксусной кислотой химическим количеством 0,24 моль.
Дано:
Найти: $m\mathrm-?$
Решения:
1) Составляем уравнение реакции для определения химического количества щёлочи:

2) Вычисляем массу раствора щёлочи:

Ответ: 112 г.
10. В реакции соляной кислоты с избытком аминоуксусной кислоты получили соль массой 13,38 г. Рассчитайте массу аминоуксусной кислоты, вступившей в реакцию.
Дано: $m(соли)=13.38$ г
Найти: $m(аминокислоты)-?$
1) Определяем относительную молекулярную массу образовавшейся соли:

2) Составляем уравнение реакции:

Ответ: масса аминокислоты 9 г.
Природные аминокислоты можно разделить на следующие основные группы:

- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
| α-Аминомасляная кислота | β-Аминомасляная кислота |
 |  |
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

| При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: |

1. Кислотно-основные свойства аминокислот
| Аминокислоты — это амфотерные соединения. |
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
| Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. |
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
| Например, глицин взаимодействует с азотистой кислотой: |

3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
| Например, глицин взаимодействует с этиловым спиртом: |

5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
| Например, глицин взаимодействует с гидроксидом бария при нагревании: |
| Например, глицин разлагается при нагревании: |

6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
| Например, г лицин реагирует с аланином с образованием дипептида (глицилаланин): |

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Читайте также:
- Почему я хочу стать косметологом кратко
- Какие антропологические данные подтверждают естественную эволюцию человека кратко
- Почему каждый человек со школьного возраста должен формировать
- Объясните что означает выражение развитие организма идет без полного превращения кратко
- Результаты подписания каких договоров кардисского бахчисарайского или нерчинского имели кратко

