От каких факторов может зависеть скорость ферментативных реакций кратко
Обновлено: 08.07.2024

Скорость ферментативных реакций во многом зависит от концентрации фермента, природы вещества, температуры, давления, реакции среды (кислой или щелочной).
У многих ферментов при определенных условиях, например в присутствии молекул некоторых веществ, изменяется конфигурация активного центра, что позволяет им обеспечивать наибольшую ферментативную активность.
Скорость ферментативных реакций зависит от многих факторов: природы и концентрации фермента и вещества, температуры, давления, реакции среды и т. д. Для функционирования каждого фермента имеются оптимальные условия. При температуре выше 60 °С большинство ферментов не работает.
Для изучения влияния какого-либо фактора на скорость реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальное значение. Измерять следует только начальные скорости, как указано выше.
Концентрация фермента
При высокой концентрации субстрата и при постоянстве других факторов, таких, например, как температура и pH, скорость ферментативной реакции пропорциональна концентрации фермента (рис. 4.6). Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.

Концентрация субстрата
При данной концентрации фермента скорость ферментативной реакции возрастает с увеличением концентрации субстрата (рис. 4.7). Теоретическая максимальная скорость реакции Vmax никогда не достигается, но наступает момент, когда дальнейшее увеличение концентрации субстрата уже не влечет за собой сколько-нибудь заметного изменения скорости реакции.
Это следует объяснить тем, что при высоких концентрациях субстрата активные центры молекул фермента в любой данный момент оказываются практически насыщенными. Таким образом,

сколько бы ни было в наличии избыточного субстрата, он может соединиться с ферментом лишь после того, как образовавшийся ранее фермент- субстратный комплекс диссоциирует на продукт и свободный фермент.
Температура
С повышением температуры ускоряется движение молекул, вследствие чего у молекул субстрата и фермента оказывается больше шансов столкнуться друг с другом. В результате увеличивается и вероятность того, что реакция произойдет. Температура, обеспечивающая максимальную активность, называется оптимальной температурой.
Если температура поднимается выше этого уровня, скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию (рис. 4.8).

Молекула фермента развертывается и его активный центр постепенно утрачивает присущую ему форму. Наиболее чувствительны к воздействию высокой температуры водородные связи и гидрофобные взаимодействия. Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37—40 °C.
Существуют, однако, ферменты с более высоким температурным оптимумом; у бактерий, живущих в горячих источниках, он может, например, превышать 70 °C. Именно такие фер- менты используются в качестве добавок к стиральным порошкам для стирки в горячей воде. Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются, но денатурации при этом не происходит.
С повышением температуры их каталитическая активность вновь восстанавливается. В наше время для длительного хранения пищевых продуктов широко используют такой способ, как быстрое их замораживание. Оно предотвращает рост и размножение микроорганизмов, а также инактивирует их пищеварительные ферменты, так что они оказываются уже не в состоянии вызвать разложение пищевых продуктов.
Инактивируются также и ферменты, находящиеся в самих пищевых продуктах. Замороженные продукты необходимо хранить при низких температурах, не допуская их размораживания. Последнее следует делать непосредственно перед приготовлением пищи.

Температурный коэффициент Q10 Влияние температуры на скорость ферментативной реакции может быть выражено через температурный коэффициент Q10:
Q10 = Скорость реакции при х °С / Скорость реакции при (х + 10) °С
При постоянной температуре любой фермент, как правило, работает наиболее эффективно в узких пределах pH. Оптимальным считается то значение pH, при котором реакция протекает с максимальной скоростью (рис. 4.10 и табл. 4.1).


При более высоких и более низких pH активность фермента снижается. С понижением pH возрастает кислотность и увеличивается концентрация Н+-ионов. Увеличивается, следовательно, количество положительных зарядов в среде. Сдвиг pH меняет заряд ионизированных кислотных и основных групп, что ведет к разрушению ионных связей, участвующих в поддержании специфичной формы молекул фермента (разд. 3.5.3).
В результате изменяется форма молекул фермента и в первую очередь форма его активного центра. При слишком резких сдвигах pH фермент денатурирует.
Литература. Биология : в 3 т. Т. 1 / Д. Тейлор, Н. Грин, У. Стаут ; под ред. Р. Сопера
Скорость ферментативных реакций. Факторы, влияющие на скорость ферментативных реакций.
Мерой скорости ферментативных реакций служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта.
Скорость определяют по углу наклона касательной к кривой на начальной стадии реакции. Чем круче наклон, тем больше скорость. Со временем скорость реакции обычно снижается, по большей части в результате снижения концентрации субстрата.
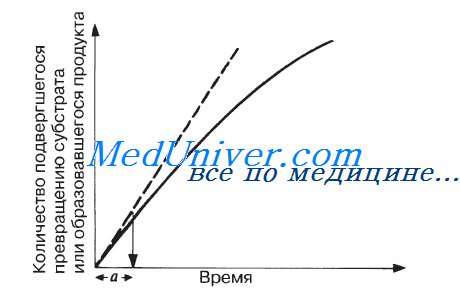
Факторы, влияющие на скорость ферментативных реакций
Для изучения влияния какого-либо фактора на скорость реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальное значение. Измерять следует только начальные скорости, как указано выше.
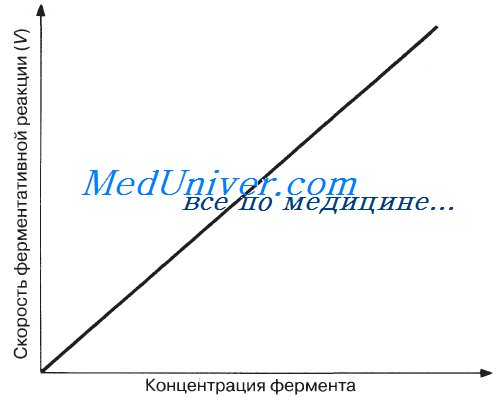
Концентрация фермента
При высокой концентрации субстрата и при постоянстве других факторов, таких, например, как температура и рН, скорость ферментативной реакции пропорциональна концентрации фермента.
Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
- Вернуться в оглавление раздела "Биология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает влияние на:
a) ионизацию аминокислотных остатков, участвующих в катализе,
b) ионизацию субстрата,
c) конформацию фермента и его активного центра.
Ингибирование ферментов
Скорость ферментативной реакции может быть снижена действием ряда химических веществ, называемых ингибиторами. Некоторые ингибиторы являются для человека ядами, например, цианиды, другие – используются в качестве лекарственных препаратов.
Ингибиторы можно разделить на два основных типа: необратимые и обратимые. Необратимые ингибиторы (I) связываются с ферментом с образованием комплекса, диссоциация которого с восстановлением активности фермента невозможна:
E + I EI.
Примером необратимого ингибитора является диизопропилфторфосфат (ДФФ). ДФФ ингибирует фермент ацетилхолинэстеразу, играющего важную роль в передаче нервного импульса. Этот ингибитор взаимодействует с серином активного центра фермента, блокируя тем самым активность последнего. Вследствие этого нарушается способность отростков нервных клеток нейронов проводить нервный импульс. ДФФ является одним из первых веществ нервно-паралитического действия. На его основе создан ряд относительно нетоксичных для человека и животных инсектицидов - веществ, ядовитых для насекомых.
Обратимые ингибиторы, в отличие от необратимых, при определенных условиях могут быть легко отделены от фермента. Активность последнего при этом восстанавливается:
.
Среди обратимых ингибиторов выделяют конкурентные и неконкурентные ингибиторы.
Конкурентный ингибитор, являясь структурным аналогом субстрата, взаимодействует с активным центром фермента и таким образом перекрывает доступ субстрата к ферменту. При этом ингибитор не подвергается химическим превращениям и связывается с ферментом обратимо. После диссоциации комплекса EI фермент может связаться либо с субстратом и преобразовать его, либо с ингибитором (рис. 34.). Поскольку и субстрат и ингибитор конкурируют за место в активном центре, такое ингибирование называется конкурентным.
Рис. 34. Механизм действия конкурентного ингибитора.
Конкурентные ингибиторы используются в медицине. Для борьбы с инфекционными болезнями ранее широко применялись сульфаниламидные препараты. Они близки по своей структуре к пара-аминобензойной кислоте (ПАБК), необходимому фактору роста многих патогенных бактерий. ПАБК является предшественником фолиевой кислоты, которая служит кофактором ряда ферментов. Сульфаниламидные препараты выступают в качестве конкурентного ингибитора ферментов синтеза фолиевой кислоты из ПАБК и тем самым подавляют рост и размножение патогенных бактерий.
Неконкурентные ингибиторы по структуре не сходны с субстратом и при образовании EI взаимодействуют не с активным центром, а с другим участком фермента. Взаимодействие ингибитора с ферментом приводит к изменению структуры последнего. Образование EI-комплекса является обратимым, поэтому после его распада фермент вновь способен атаковать субстрат (рис. 35).
Рис. 35. Механизм действия неконкурентного ингибитора
В качестве неконкурентного ингибитора может выступать цианид CN - . Он связывается с ионами металлов, входящими в состав простетических групп и подавляет активность этих ферментов. Отравления цианидами крайне опасны. Они могут привести к летальному исходу.
Аллостерические ферменты
Рис. 36. Структура аллостерического фермента.
Регуляция мультиферментных систем
Некоторые ферменты действуют согласованно, объединяясь в мультиферментные системы, в которых каждый фермент катализирует определенную стадию метаболитического пути:
В мультиферментной системе есть фермент, который определяет скорость всей последовательности реакций. Этот фермент, как правило, бывает аллостерическим и находится в начале матаболитического пути. Он способен, получая различные сигналы, как повышать, так и понижать скорость катализируемой реакции, тем самым регулируя скорость всего процесса.
Читайте также:
- Как по закону оплачиваются праздничные дни в школе сторожам как на это влияет мрот
- Что ты думаешь о характере николеньки какой он 4 класс кратко
- Можно ли зайти в детский сад без кода
- Можно ли после школы никуда не поступать и идти работать
- Расчеты по уравнениям химических реакций когда одно из веществ взято с избытком план урока

