Какую роль играет вода в процессе электролитической диссоциации кратко
Обновлено: 18.05.2024
Растворы состоят из растворителя и одного (или более) растворенных веществ. Наиболее распространенными являются водные растворы (растворитель вода). В неводных растворах, которые в последнее время находят все большее применение, могут быть использованы другие растворители (бензол, спирт, жидкий аммиак и т.д.).
Растворенное вещество в растворах находится в виде изолированных молекул или ионов. В процессе образования раствора большую роль играет взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя, т.е. сольватация (гидратация, если растворителем является вода). Энергетический эффект, наблюдаемый при растворении 1 моля вещества, называется энтальпией растворения (кДж/моль). Процесс растворения может быть экзотермическим (например, КОН) или эндотермическим (например, КNO3). Сольватация (гидратация) играет решающую роль и в процессах электролитической диссоциации молекул растворенного вещества на ионы.
В соответствии с теорией электролитической диссоциации в растворах некоторых веществ происходит обратимый распад молекул на ионы. Поэтому в растворах таких веществ одновременно присутствуют молекулы и ионы. Количественно способность молекул вещества к электролитической диссоциации описывается степенью электролитической диссоциации a (a % = a × 100 %) и константой электролитической диссоциации Kдис., т.е. константой равновесия, записанной для обратимого процесса электролитической диссоциации. Способность к электролитической диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, концентрации раствора и наличия в растворе одноименных ионов. Закон разбавления (разведения) Оствальда устанавливает взаимосвязь между a, Kдис и молярной концентрацией растворенного вещества в растворе СМ
По величине степени диссоциации a электролиты условно делят на слабые (a 30 %) и средней силы (a = 3-30 %).
| Классы | Электролиты | ||
| сильные | слабые | средние | |
| Кислоты | HCl, HNO3, HI, H2SO4 | HF, HCN, CH3COOH, H2S, H2CO3, H2SO3 | H3PO4 |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2, | Zn(OH)2, Al(OH)3 | - |
| Соли | большинство | - | - |
В растворах сильных электролитов (особенно при малых концентрациях См -16 ). Произведение [Н + ] × [ОН - ] = 10 -14 при t = 22 o C постоянно для чистой воды и водных растворов различных веществ. Возможность и скорость протекания реакций в водных растворах в большей степени зависит от концентрации [Н + ], поэтому эта величина имеет большое значение. Для удобства используют не величину [Н + ], а водородный показатель рН = -lg[Н + ].
Растворы состоят из растворителя и одного (или более) растворенных веществ. Наиболее распространенными являются водные растворы (растворитель вода). В неводных растворах, которые в последнее время находят все большее применение, могут быть использованы другие растворители (бензол, спирт, жидкий аммиак и т.д.).
Растворенное вещество в растворах находится в виде изолированных молекул или ионов. В процессе образования раствора большую роль играет взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя, т.е. сольватация (гидратация, если растворителем является вода). Энергетический эффект, наблюдаемый при растворении 1 моля вещества, называется энтальпией растворения (кДж/моль). Процесс растворения может быть экзотермическим (например, КОН) или эндотермическим (например, КNO3). Сольватация (гидратация) играет решающую роль и в процессах электролитической диссоциации молекул растворенного вещества на ионы.
В соответствии с теорией электролитической диссоциации в растворах некоторых веществ происходит обратимый распад молекул на ионы. Поэтому в растворах таких веществ одновременно присутствуют молекулы и ионы. Количественно способность молекул вещества к электролитической диссоциации описывается степенью электролитической диссоциации a (a % = a × 100 %) и константой электролитической диссоциации Kдис., т.е. константой равновесия, записанной для обратимого процесса электролитической диссоциации. Способность к электролитической диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, концентрации раствора и наличия в растворе одноименных ионов. Закон разбавления (разведения) Оствальда устанавливает взаимосвязь между a, Kдис и молярной концентрацией растворенного вещества в растворе СМ

По величине степени диссоциации a электролиты условно делят на слабые (a 30 %) и средней силы (a = 3-30 %).
| Классы | Электролиты | ||
| сильные | слабые | средние | |
| Кислоты | HCl, HNO3, HI, H2SO4 | HF, HCN, CH3COOH, H2S, H2CO3, H2SO3 | H3PO4 |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2, | Zn(OH)2, Al(OH)3 | - |
| Соли | большинство | - | - |
В растворах сильных электролитов (особенно при малых концентрациях См -16 ). Произведение [Н + ] × [ОН - ] = 10 -14 при t = 22 o C постоянно для чистой воды и водных растворов различных веществ. Возможность и скорость протекания реакций в водных растворах в большей степени зависит от концентрации [Н + ], поэтому эта величина имеет большое значение. Для удобства используют не величину [Н + ], а водородный показатель рН = -lg[Н + ].

В процессе электролитической диссоциации (распаде электролитов на ионы) большую роль играют молекулы воды. Между атомами водорода и кислорода имеются расположенные под углом около 105 ковалентные сильнополярные связи. Поэтому молекулы воды полярны и представляют собой диполи:
При растворении в воде веществ с ионной связью, например, хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.


Рис.1. Диссоциация NaCl Рис.2. Диссоциация HCl.
Теория электролитической диссоциации:
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
6.Электролиты и неэлектролиты:
Электролитическая диссоциация веществ, идущая с образованием свободных ионов, объясняет электрическую проводимость растворов.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.
Электролиты- это вещества, растворы которых проводят электрический ток.
Электролиты при растворении в воде распадаются на ионы. (положительные- катионы, отрицательные- анионы), которые могут взаимодействовать друг с другом, но вновь образовывать молекулы, поэтому этот процесс обратимый.
Сильные электролиты:Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH,Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слабые электролиты:Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
Неэлектролиты: Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы. Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Степень диссоциации.
Степень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N): a = n / N и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
7.Химические свойства воды:
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
Вода реагирует с щелочными металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
2K + 2H2O = H2 + 2KOH (бурно)
Реакция гидратации:
В органической химии реакция гидратации - химическая реакция, в которой вода добавлена к ненасыщенному основанию. Обычно, основание - алкен или alkyne. Этот тип реакции используется промышленно, чтобы произвести этанол, изопропиловый спирт, и с 2 бутанолами. Несколько миллиардов килограммов этиленового гликоля ежегодно производятся гидратацией этиленовой окиси.
Контроль знаний:
1. Виды растворов. Истинные растворы. Классификация веществ по их растворимости в воде.
3.Факторы, от которых зависит растворимость веществ в воде.
4.Значение водных растворов для организма человека.
5.Дать характеристику механизма электролитической диссоциации.
6.Дать определение: электролиты и неэлектролиты. Степень электролитической диссоциации.
Литература:
1.Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2010,
2. Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений.- 2-е издание / О.С. Габриелян, И.Г. Остроумов. – М., 2013.
4. .Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2016.

Самостоятельная работа № 4.
Тема: Гидролиз органических и неорганических соединений. Необратимый гидролиз. Обратимый гидролиз солей. Практическое значение гидролиза для получения гидролизного спирта и мыла. Биологическая роль гидролиза в пластическом и энергетическом обмене веществ и энергии в клетке.
Окислительно-восстановительные реакции.Степень окисления. Понятие об окислительно-восстановительных реакциях. Окисление и восстановление, окислитель и восстановитель.
Электролиз. Электролиз как окислительно-восстановительный процесс. Электролиз расплавов и растворов на примере хлорида натрия. Практическое применение электролиза. Электролитическое получение алюминия.
Основные понятия и термины по теме:гидролиз и его виды, электролиз, окислительно-восстановительные реакции, степень окисления, окислитель, восстановитель.
План изучения темы:
(перечень вопросов, обязательных к изучению):
1.Понятие гидролиза и его виды.
2.Практического значение гидролиза.
3.Окислительно-восстановительные реакции. Степень окисления.
4.Электролиз как окислительно-восстановительный процесс. Практическое применение электролиза.
Содержание:
Гидролизом называют разложение вещества с водой, что приводит к образованию слабого электролита. Эта реакция является обратной к реакции нейтрализации.
Гидролизу подвергаются как неорганические, так и органические вещества в результате обменной реакции между молекулами воды и вещества. Реакции гидролиза могут протекать как обратимо, так и необратимо. Гидролиз имеет большое практическое значение и основан на теории, а именно теории протекания химических явлений, теории растворов.
Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы Н + и ОН – , но в процессе гидролиза один или оба из этих ионов могут связываться ионами, образующимися при диссоциации соли, в малодиссоциированные, летучие или труднорастворимые соединения (молекулы или сложные ионы). Происходит изменение реакции среды.
Электролиты– вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества, имеющие ионную связь: соли, основания, полярные молекулы кислот.
Гидролиз соли - взаимодействие ионов соли с водой, когда образуется слабый электролит [H + ] = [OH - ] - среда нейтральная, [H + ] > [OH - ] - среда кислая, [OH - ] > [H + ] - среда щелочная.
Процесс гидролиза протекает до тех пор, пока не установится равновесие между ионами соли, водой и продуктами гидролиза.
Чтобы точно определить продукты гидролиза, мы должны знать силу кислот и оснований.
В зависимости от своего состава соли по-разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей.
Процесс гидролиза количественно характеризуется степенью гидролиза (h) и константой гидролиза (Кг). Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу (Сгидр.), к общему числу растворенных молекул (Собщ.):
Степень гидролиза зависит от следующих факторов:
2. ее концентрации;
3. температуры раствора.
Гидролизу подвергаются только те соли, которые образуют при диссоциации ион от слабого электролита. Соли, образованные сильными основаниями и сильными кислотами гидролизу, не подвергаются.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (воды) и приводит к усилению гидролиза. Усилению гидролиза способствует: увеличение концентрации исходных веществ, продуктов, добавление спирта, кислоты.
Гидролиз концентрированных растворов происходит слабее. Процесс гидролиза эндотермичен, поэтому с повышением температуры протекает полнее. Следовательно, при гидролизе соблюдается принцип Ле-Шателье.
Роль гидролиза в природе и жизни человека:
в процессах формирования и преобразования земной коры; в создании среды для развития жизни в мировом океане; в народном хозяйстве для производства продуктов из непищевого сырья; в повседневной жизни человека, гидролиз спирта и мыла (стирка, борьба с жесткостью воды, процессы пищеварения), в организме человека: биологическая роль гидролиза в пластическом и энергетическом обмене веществ и энергии в клетке.

Данный видеоурок полностью посвящён теории электролитической диссоциации: истории создания теории, гипотезам, основным положениям теории.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Теория электролитической диссоциации"
Природная вода при всём её многообразии не бывает химически чистой. В ней растворены различные вещества. Всё, что мы называем обычной водой на самом деле – водные растворы.

При изучении проводимости водных растворов было обнаружено, что некоторые из них проводят электрический ток.
Вещества, растворы и расплавы которых проводят электрический ток, называются электролитами. К электролитам относятся соли, кислоты, основания. В этих веществах имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы и расплавы которых не проводят электрический ток. К ним относятся вещества, у которых ковалентные неполярные, или малополярные связи. Например, кислород, водород, многие органические вещества: сахар, эфиры, бензол и другие.
Какова же природа проводимости растворов электролитов?
Для объяснения этого в 1877 году Свантэ Аррениусом была предложена теория электролитической диссоциации.

Согласно этой теории электролиты обладают способностью при растворении или расплавлении диссоциировать, то есть распадаться на заряженные частицы – ионы.

Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд. Ионы бывают простыми, которые состоят из одного вида атомов (например, ион натрия, магния, серы, хлора) и сложными, которые состоят из атомов разных видов (нитрат-ион, ион аммония, сульфат-ион, фосфат-ион).

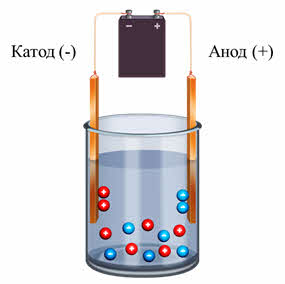
В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительные ионы движутся к отрицательно заряженному электроду – катоду, а отрицательно заряженные ионы движутся к положительно заряженному электроду – аноду. В растворе любого электролита общая сумма зарядов катионов равна общей сумме зарядов анионов, поэтому растворы электролитов электронейтральны.
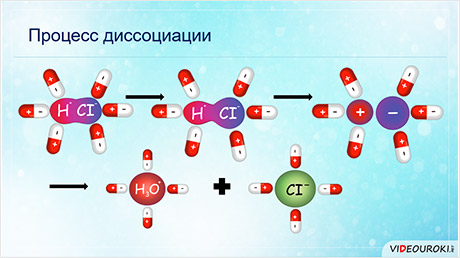
В чём же суть процесса распада электролита на ионы?
Раствор неэлектролита, например сахара, не проводит электрический ток. В отличие от него, раствор поваренной соли, проводит электрический ток.

Как происходит при этом процесс диссоциации?
Кристаллическая решётка хлорида натрия состоит из ионов натрия и хлора. Притяжение между этими ионами обеспечивает устойчивость кристалла.

Чтобы разрушить кристаллическую структуру соли и перевести ионы в раствор необходимо затратить энергию, превышающую энергию кристаллической решётки.
Вода – универсальный растворитель. Она активно участвует в процессе диссоциации. Молекула воды соединяется с ионами в кристалле, при этом положительные полюсы молекулы воды притягиваются к хлорид-ионам, а отрицательные полюсы – к положительным ионам натрия.

В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристалле ослабевает. Кристаллическая решётка разрушается и ионы переходят в раствор. Таким образом, образуются гидратированные ионы. Образование гидратированных ионов сопровождается выделением энергии, равной энергии гидратации, которая расходуется на разрушение кристаллической решётки соли.
Диссоциация соляной кислоты идёт также в результате гидратации. В результате взаимодействия дипольных молекул электролита с дипольными молекулами воды изменяется характер связи в молекуле аш-хлор: сначала связь становится более полярной, а затем переходит в ионную.

При этом соляная кислота существует в растворе только в виде положительных ионов гидроксония и отрицательных ионов хлора. Раствор соляной кислоты проводит электрический ток.

И так, основной причиной диссоциации является эффект гидратации. Взаимодействие молекул воды с ионами в кристаллической решётки и полярными молекулами электролита приводит к образованию и существованию в растворе гидратированных ионов.
Нужно помнить, что ионы по свойствам отличаются от нейтральных атомов, из которых они образовались. Так, ионы натрия и ионы хлора не взаимодействуют с водой, не имеют цвета, запаха, неядовиты. Атом натрия энергично взаимодействует с водой, хлор является газом жёлто-зелёного цвета, ядовит, сильный окислитель. Ионы имеют различную окраску. Гидратированные ионы эс и пэ-элементов обычно бесцветны: ионы водорода, натрия, калия, бария, алюминия. Некоторые ионы дэ-элементов имеют окраску: например, негидратированные ионы меди − бесцветные, а гидратированные имеют голубую окраску.
Процесс распада электролита на ионы при растворении или расплавлении называется электролитической диссоциацией (ионизацией).

О распаде молекул электролита в растворе на ионы можно судить по степени электролитической диссоциации.
Степень электролитической диссоциации (ионизации) – это отношение числа молекул, распавшихся на ионы, к общему числу растворённых молекул.
По степени электролитической диссоциации различают сильные и слабые электролиты. Растворы слабых электролитов состоят из ионов и молекул. Например, раствор уксусной кислоты. Её степень диссоциации в дэцимолярном растворе одна целая тридцать шесть сотых процента.
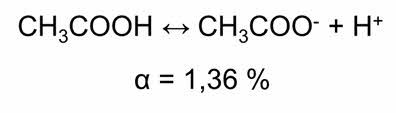
Это означает, что из десяти тысяч молекул уксусной кислоты 136 молекул распадается на ионы. Степень диссоциации зависит от природы растворителя и растворяемого вещества, концентрации раствора и температуры.

При разбавлении растворов электролитов электропроводность увеличивается за счёт усиления процесса диссоциации.
При описании свойств слабого электролита применяется закон действующих масс. Отношение произведения концентрации ионов в растворе к концентрации недиссоциировавших молекул равно константе диссоциации. Это величина постоянная и называется константой диссоциации или ионизации.

Константа диссоциации характеризует способность электролита диссоциировать на ионы. Она не зависит от концентрации раствора, но зависит от природы электролита и растворителя, а также от температуры.
Поваренная соль в растворе диссоциирует полностью, как и соляная кислота. Электролиты, растворы которых состоят из гидратированных ионов, называются сильными.

Наличие в растворе только ионов определяется высокими значениями электропроводности по сравнению с растворами слабых электролитов.
По мере концентрирования растворов сильных электролитов наблюдается уменьшение электропроводности. Создаётся впечатление, что в растворе меньше ионов.

К сильным электролитам относятся все соли, сильные кислоты: хлорная, азотная, серная, соляная, бромоводородная, йодоводородная и марганцовая кислота; щёлочи (гидроксид лития, гидроксид бария, гидроксид калия и другие). Процесс диссоциации сильных электролитов является необратимым.
Так, при диссоциации гидроксида бария образуются ионы бария и гидроксид-ионы, при диссоциации азотной кислоты образуются ионы водорода и нитрат-ионы, при диссоциации сульфата алюминия образуются ионы алюминия и сульфат-ионы.
К слабым электролитам относятся слабые кислоты (азотистая, угольная, хлорноватистая и другие), слабые нерастворимые в воде основания (гидроксид железа два, гидроксид меди два, гидроксид свинца два и другие), к слабым электролитам относится гидроксид аммония и вода. Диссоциация слабых электролитов – процесс обратимый. В растворах слабых электролитов одновременно идут процессы распада молекул на ионы (диссоциация, или ионизация) и соединение ионов в молекулы (ассоциация).
Таким образом, основные положения теории электролитической диссоциации можно представить следующим образом.
Первое. При растворении в воде электролиты диссоциируют на ионы (положительные и отрицательные). Раствор в целом остаётся электронейтральным.
Второе. Причиной диссоциации электролита является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
Третье. Под действием электрического тока положительные ионы движутся к катоду, а отрицательные ионы – к аноду.
Четвёртое. Электролитическая диссоциация – это процесс обратимый для слабых электролитов.
Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Они играют большое значение в физиологических и биохимических процессах.

Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –

При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .

При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).

Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Читайте также:
- Неделя английского языка в школе план мероприятий 10 класс
- Какие ученые развивали учение о ноосфере кратко
- Каков портрет софьи глазами гончарова и какое отношение к ней критика кратко
- Объясните почему моря северного ледовитого океана мелководны в прибрежных частях кратко
- Почему владимир решил крестить русь кратко

