Какое значение имеет закон сохранения массы в химической науке и практике кратко
Обновлено: 25.06.2024
Этот закон является одним из основных стехиометрических законов химии.
Стехиометрия –раздел химии, в котором рассматриваются массовые и объемные соотношения между реагирующими веществами, вывод химических формул и составление уравнений химических реакций.
Составляем уравнения реакций в молекулярной и ионной форме:
Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия их него.
Закон постоянства состава вещества.
Сформулирован Ж.-Л. Прустом в 1799 г.: Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Однако уже в начале XIX в. К. Бертолле показал, что элементы могут соединятся друг с другом в разных соотношениях в зависимости от массы реагирующих веществ.
Современная формулировка закона постоянства состава вещества такова: Состав соединений молекулярной структуры является постоянным независимо от способа их получения. Состав соединений немолекулярной структуры (с атомной, ионной или металлической кристаллической решеткой) не является постоянным и зависит от способа их получения.
Закон Авогадро. Сформулирован А. Авогадро в результате проведения многочисленных экспериментов: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Из закона Авогадро вытекают 2 следствия:
1. Один моль любого газа при одинаковых условиях занимает один и тот же объем. Этот объем, называемый молярным ( ), при нормальных условиях (давление = 101325 Па и абсолютной температуре = 273,15 К) равен 22,4 л:
2. Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой как их молярные массы Отношение масс двух газов, занимающих равный объем при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). где p – давление; V – объем газа; m – масса газа; М – молярная масса газа; Т – температура; n – количество вещества газа, моль; R – универсальная газовая постоянная, значение которой зависит от единиц, в которых измеряют давление и объем.
Вопросы для самоконтроля
¾ Что такое простые вещества?
¾ Что такое сложные вещества?
¾ Каков состав атома, ядра?
¾ Определите число протонов и нейтронов в атомах натрия и фосфора.
¾ Вычислите молекулярные массы хлорида натрия и фосфата кальция.
¾ Найдите относительные молекулярные массы веществ, состав которых описывается формулами: Na2CO3 . Ca(NO3)2 , Ag NO3 , KCl, H2SO4 , Ba(NO3)2 , Na2S
¾ Рассчитайте относительные молекулярные массы медного купороса и кристаллической соды.
¾ Какова масса 5,6 л. (н. у.) углекислого газа?
¾ Каков объем 128 г сероводорода при нормальных условиях?
ПЛАН ЗАНЯТИЯ № 4
Дисциплина: Химия.
Тема: Периодический закон Д.И. Менделеева. Периодическая таблица химических элементов.
Цель занятия: Повторить Периодический закон Д.И. Менделеева, его открытие, современную формулировку и значение. Повторить структурупериодической таблицы химических элементов: периоды (малые и большие), группы (главная и побочная).
Предметные: знание периодического закона Д.И. Менделеева.
Метапредметные: умение характеризовать: элементы малых периодов по их положению в Периодической системе Д.И. Менделеева.
Личностные: владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой.
Норма времени:2 часа
Вид занятия:Лекция с элементами беседы.
Тип занятия: Урок повторения.
План занятия:
1. Открытие Д.И. Менделеевым Периодического закона. Периодический закон в формулировке Д.И. Менделеева.
2.Графическое отображение периодического закона. Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).
3. Современная формулировка периодического закона. Значение периодического закона и периодической системы химических элементов Д.И. Менделеева для развития науки и понимания химической картины мира.
Оснащение: Периодическая система химических элементов, портрет Д.И.Менделеева.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
Преподаватель: Тубальцева Ю.Н.
Эталон единицы силы электрического тока: Эталон – это средство измерения, обеспечивающее воспроизведение и хранение.
Социальное обеспечение и социальная защита в РФ: Понятие социального обеспечения тесно увязывается с понятием .
Закон сохранения массы в химии гласит, что масса в изолированной системе не создается и не разрушается химическими реакциями или физическими превращениями. Согласно этому положению, масса продуктов в химической реакции должна равняться массе реагентов. Закон сохранения полезен для ряда вычислений, например, определения неизвестных масс, таких как количества газа, потребляемого или добываемого в ходе реакции.
Основные условия
Открытие закона сохранения веса помогло превратить химию в респектабельную науку, которой она является сегодня. Она берет свои основы в алхимии, в науке, которая в какой-то степени связана с магией и мистикой. С появлением закона химики отказались от загадочной части исследований и начали верить в предсказуемость и надежность.
Положения о массе крайне важны для изучения и производства химических реакций. Если ученые знают количество и идентичность реагентов для конкретной реакции, они могут предсказать количество продуктов, которые будут произведены. Производители химикатов могут повысить эффективность, применяя положения закона в своей лабораторной практике.
Среди основных условий и положений можно выделить следующие:
- Материя не может быть создана или уничтожена. Она просто существует.
- Продуктом называется химическое вещество, образовавшееся в результате соответствующей реакции.
История создания
Считается, что вывел закон сохранения вещества Ломоносов, однако данное утверждение неверно. Открытие было сделано в 1789 году французским ученым Антуаном Лавуазье. Другие предлагали эту идею раньше, но Лавуазье был первым, кто смог доказать ее. Открыть закон пытались не только химики, но и физики, однако впервые сформулировать его смог именно Лавуазье.

В то время большая часть атомной химии основывалась на учениях греков, и благодаря более поздним идеям считалось, что что-то в огне на самом деле является веществом. Это, рассуждали ученые, объясняло, почему куча пепла легче, чем все, что было сожжено, чтобы произвести пепел.
Лавуазье решил поставить опыт, который будет иметь практическое значение. Он нагрел окись ртути и отметил, что количество уменьшенного веса химического вещества равно весу газообразного кислорода, выделяющегося во время реакции.

До того, как химики смогли объяснить массу вещей, которые было трудно отследить, таких как водяной пар и следовые газы, они не могли адекватно проверить принципы сохранения материи, даже если подозревали, что такие законы и правда могут выполняться.
В любом случае это привело Лавуазье к утверждению, что вещество должно сохраняться в химических реакциях, а это означает, что общее количество вещества на каждой стороне химического уравнения одинаково. Таким образом, общее число атомов (но не обязательно общее количество молекул) в реагентах должно равняться количеству в продуктах независимо от характера химического изменения.
Масса продуктов в химических уравнениях равна массе реагентов — это основа стехиометрии, или процесса учета, с помощью которого химические реакции и уравнения математически сбалансированы с точки зрения как массы, так и числа атомов на каждой стороне.
Практические примеры
Изучение примеров закона полезно для визуализации и понимания этой важной научной концепции. Вот два примера, которые помогут проиллюстрировать, как работает принцип сохранения веса.
Одним из наиболее популярных примеров является изображение костра или открытого огня. Можно представить, что было собрано несколько палочек, которые впоследствии подожгли. После пары жареных маршмеллоу и песен становится ясным, что костер полностью сгорел. Все, что осталось, это небольшая кучка пепла и немного дыма.
Первоначальный инстинкт может заключаться в том, чтобы предположить, что часть изначального веса костра от палок как-то исчезла. Но это на самом деле это не так, ведь причина в том, что содержимое просто трансформировалось.

В этом сценарии, когда палочки горели, они объединялись с кислородом в воздухе, превращаясь не только в пепел, но и в углекислый газ и водяной пар. В результате, если измерить общий деревянных палочек и кислорода перед тем, как поджечь палочки, обнаружится, что эта масса равна весу золы, углекислого газа и водяного пара вместе взятых.
Аналогичным примером закона сохранения является горящая свеча. Для примера можно использовать обычную свечу с воском и фитилем. Когда она полностью сгорит, можно увидеть, что воска осталось намного меньше, чем было до того, как ее зажгли. Это означает, что часть воска превратилась в газы, а именно в водяной пар и углекислый газ.
Таким образом, закон сохранения массы веществ гласит, что в изолированной системе материя не может быть создана или уничтожена, а только изменена. Это означает, что общий вес всех веществ до химической реакции будет равна весу всех веществ после химической реакции.
Проще говоря, материя всегда сохраняется, даже если вещество меняет химическую или физическую форму.
Закон сохранения массы-энергии
Впоследствии этот закон был превращен Эйнштейном в закон сохранения энергии, который описывает следующие факты:
- общая масса и энергия в системе остаются постоянными;
- масса и энергия могут быть преобразованы одна в другую;
- энергия, произведенная или потребленная в типичной химической реакции, составляет незначительное количество веса.

Поэтому можно визуализировать проводимые реакции как перегруппировку атомов и связей, в то время как число атомов, участвующих в реакции, остается неизменным. Это предположение позволяет представить реакцию в виде сбалансированного уравнения, в котором число молей любого участвующего элемента одинаково с обеих сторон уравнения. Дополнительным полезным применением закона является определение массы газообразных реагентов и продуктов. Если суммы твердых или жидких реагентов и продуктов известны, любая оставшаяся масса может быть отнесена к газу.
Лавуазье, автор серии книг и ученый, вывел формулу, которая доказывала изменения атомной и молекулярной структуры вещества, однако неизменность его веса.
При разработке своей теории относительности физик и подумать не мог, что его формулировка массы и классов веществ будет перечить устоявшимся законам химии.
Закон сохранения массы веществ один из важнейших законов химии. Его открыл М. В. Ломоносов, а позже экспериментально подтвердил А. Лавуазье. Так в чем же состоит суть этого закона?
История
Закон сохранения массы веществ впервые сформулировал М. В. Ломоносов в 1748 году, а экспериментально подтвердил его на примере обжига металлов в запаянных сосудах в 1756 году. Закон сохранения массы веществ Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как всеобщий закон природы.

Рис. 1. М. В. Ломоносов.
Но еще до Ломоносова более 20 веков назад древнегреческий ученый Демокрит предполагал, что все живое и неживое состоит из незримых частиц. позже в XVII веке эти догадки подтвердил Р. Бойль. Он проводил эксперименты с металлом и древесиной и выяснил, что вес металла после нагревания увеличился, а вес золы по сравнению с деревом, наоборот, уменьшился.
Независимо от М. В. Ломоносова закон сохранения массы вещества был установлен в 1789 году французским химиком А. Лавуазье, который показал, что при химических реакциях сохраняется не только общая масса веществ, но и масса каждого из элементов, входящих в состав взаимодействующих веществ.
Взгляды Ломоносова и Лавуазье были подтверждены современной наукой. В 1905 году А. Эйнштейн показал, что между массой тела (m) и его энергией (E) существует связь, выражаемая уравнением:
где c – скорость света в вакууме.

Рис. 2. Альберт Эйнштейн.
Таким образом, закон сохранения массы дает материальную основу для составления уравнений химических реакций.
Суть закона сохранения массы вещества
Закон сохранения массы вещества заключается в следующем: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.

Рис. 3. Закон сохранения массы вещества.
При написании уравнений химических реакций надо следить за соблюдением этого закона. Число атомов элемента в левой и правой частях реакций должно быть одинаковым, так как атомные частицы в химических превращениях неделимы и никуда не исчезают, а лишь переходят из одного вещества в другое. Сущность химической реакции – разрыв одних связей и образование других связей. Поскольку эти процессы связаны с затратой и получением энергии, то знак равенства в реакциях можно ставить, если учтены энергетические факторы, условия реакции, агрегатные состояния веществ.
Очень часто знак равенства, особенно в неорганических реакциях, ставят и без учета необходимых факторов,производя упрощенную запись. При уравнивании коэффициентов вначале уравнивают число атомов металла, потом неметалла, затем водорода и в конце производят проверку по кислороду.
Что мы узнали?
Закон сохранения массы вещества изучают в школе по химии 8 класса, так как понимание его сути необходимо для правильного составления уравнений реакций. О том, что любая материя на земле состоит из невидимых частиц предположил еще древнегреческий ученый Демокрит, а его более современные последователи Ломоносов, Лавуазье, Эйнштейн доказали это экспериментально.
Закон сохранения массы в химии изучают в 8 классе. Его сформулировали на основании опытов по прокаливанию металлов. Этот закон имеет основополагающее значение в химии. После его открытия химия стала считаться точной наукой. Закон послужил основой для проведения количественного химического анализа, для составления химических уравнений. Сохранения массы вещества открыто и обоснованно двумя учеными Ломоносовым и Лавуазье.

История открытия

Впервые о принципе сохранения материи люди задумывались еще в древности. Об этом рассуждали древние философы:
- Эмпедокл;
- Аристотель;
- Демокрит;
- Эпикур.
В средневековье тоже считали, что этот закон действует. Фрэнсис Бэкон еще в 1620 году утверждал, что сумма материй постоянна, уничтожить ее не может ничто.
В 1673 году Роберт Бойль выразил сомнения в законе. У него при нагревании металлов вес окалины увеличился. Причиной этого было проведение опытов в открытых сосудах.

Закон сохранения веществ Ломоносов сформулировал на основании философских соображений. Великий ученый не считал, что открыл новую закономерность. Но ученый опирался на это правило в экспериментах.
Параллельно с Михаилом Васильевичем французский ученый Лавуазье занимался этим вопросом. И в 1789 году он провел опыты, доказывающие, что масса металлов в закрытых сосудах остается неизменной. Лавуазье и Ломоносов являются авторами этой закономерности.
Формулировка закона
Определение закона звучит так: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ. Вещества, которые вступили в реакцию, называются реагентами, а получившиеся — продуктами.
Согласно атомно-молекулярному учению, количество молей в закрытой системе не изменяется, потому что атомы не пропадают и не появляются. Атомы реагентов образуют продукты реакции, меняя структуру связи.
Когда энергия из окружающей среды поглощается, масса увеличивается, а если теряется — уменьшается. При ядерных реакциях изменения ощутимы. При тепловом обмене изменение этой весовой характеристики несущественны.
Химические уравнения
На основании этой закономерности в химических уравнениях считается, что можно поставить знак равенства между массой реагентов и продуктов реакции. Образование одних связей за счет разрыва других называется химической реакцией. При этом образуется или затрачивается какая-то доля энергии. Для упрощения записи в уравнениях не всегда учитываются все необходимые факторы.

Считается, что соответствующие атомы реагентов переходят в атомы продуктов. Уравнение состоит из двух частей:
- левой (в ней записываются формулы реагентов через плюс);
- правой (формулы продуктов).
После определения коэффициентов между частями уравнения ставится знак равенства. Расстановка коэффициентов выполняется по очереди:
- Металлы.
- Неметаллы.
- Водород.
- Кислород (по нему определяют правильность вычислений).
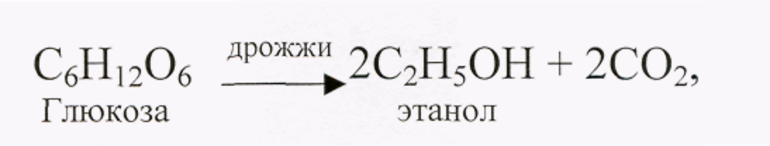
Чтобы уравнять количество атомов, приходится подумать. Например, реакции разложения:
- гидроксида железа (2 Fe (OH)3 = Fe2O3 + 3 H2O);
- оксида серебра (2 Ag2O = 4 Ag + O2);
- карбоната кальция (СаCO3 = СаO + CO2);
- спиртовое брожение глюкозы (С6Н12О6 = 2 С2Н5ОH + 2 CO2);
- серной кислоты (H2SO4 = SO3 + H2O).
Закон сохранения массы веществ в химии применим с большей точностью, чем в физике, потому что можно пренебречь релятивистскими поправками. Эти поправки наблюдаются, когда скорость тела можно сопоставить со скоростью света.
На основании данного правила составляют уравнения, могут производить количественный химический анализ.
Читайте также:

