Какая самая сильная кислота в школе
Обновлено: 06.07.2024
Кислота – сложное химическое соединение, в составе которого находятся атомы водорода, подверженные замещению атомами металла и кислотный остаток.
Подобные продукты обладают разными свойствами и зависят от состава. Кислоты хорошо контактируют с металлами, основаниями, способны изменять цвет индикаторов.
По количеству атомов водорода кислоты делятся на одноосновные, двухосновные и трехосновные.
Виды кислот (список)
Какое соединение считается сильным? Однозначного ответа на подобный вопрос нет. Есть суперкислоты, способные разрушить серьезные соединения.
Большая редкость, поскольку производится искусственным путем в закрытых лабораториях. Точная информация об этом продукте отсутствует, доказано, что раствор в концентрации пятидесяти процентов в миллион раз опаснее серной кислоты (тоже не слабой).
Карборановая кислота (самая опасная)
Соединение считается более сильным из тех продуктов, хранение которых допустимо в специфических емкостях. Подобная едкая кислота сильнее, чем серная. Вещество растворяет металлы и стекло. Соединение создано совместными усилиями ученых из США и России.
Эта кислота считается сильной за счет легкого отделения водородных атомов. Остающийся ион имеет отрицательный заряд и высокую стабильность, за счет чего вступает в повторную реакцию. Токсическое вещество не является теорией, используют в качестве катализатора в реакциях.
Плавиковая кислота
Фтористый водород относят к еще одному сильному соединению. Выпускается в форме растворов с разной концентрацией. У продукта отсутствует цвет, при взаимодействии с водой выделяется тепло. Токсин разрушает стекло, металл, не контактирует с парафином.
Перевозят в полиэтилене. Плавиковая кислота опасна для человека, вызывает наркотическое состояние, нарушение кровообращения, проблемы с дыхательной системой. Соединение способно испаряться. Пары также обладают ядовитыми свойствами, способны раздражать слизистые оболочки и кожные покровы. Быстро всасывается через эпидермис и вызывает мутации.
Серная кислота

Одна из распространенных мощных кислот. Подобный яд опасен для человека. При попадании на открытые участки кожи вызывает обугливание, появление серьезных ран, которые требуют долгого лечения.
Отравление опасно не только при проникновении элемента внутрь организма, но и при вдыхании паров. Серную кислоту получают несколькими способами.
Жидкость с большой концентрацией при взаимодействии с металлическими предметами, окисляет их, переходит в диоксид серы.
Соляная кислота
Едкая кислота, в малом количестве образующаяся в желудке человека. Однако соединение, полученное химическим путем является опасным для живого организма. При контакте с кожными покровами наносит серьёзные ожоги, большую опасность представляет при попадании в глаза.
Отравиться возможно парами соляной кислоты, при открытии емкости с веществом происходит образование токсичного газа, раздражающего слизистые глаз и органы дыхания.
Азотная
Относится к веществам третьего класса опасности. Пары несут вред для дыхательных путей и легких, образуются под действием повышенной температуры. На коже жидкость провоцирует развитие долго заживающих ран.
Азотная кислота используется в промышленных процессах, присутствует в удобрениях. Однако при работе с ней необходима осторожность. Не вступает в реакции со стеклом, поэтому хранится в нем.
Сильные органические кислоты в мире
Существуют опасные кислоты не только химического, но и органического происхождения. Они также несут негативные последствия для здоровья.
Муравьиная кислота
Одноосновная кислота, не имеет цвета, хорошо растворима в ацетоне и перемешивается с водой. Опасна при повышенной концентрации, при попадании на кожу разъедает ткани, оставляет сильные ожоги. В состоянии газа воздействует на слизистые оболочки глаз и дыхательные пути. При попадании внутрь провоцирует серьезное отравление с неблагоприятными последствиями.
Уксусная
Опасное соединение, применяемое в быту. Хорошо контактирует с водой, что снижает ее концентрацию. При попадании внутрь вызывает сильные ожоги внутренних органов, пары неблагоприятно влияют на слизистые оболочки, раздражая их. В высокой концентрации приводит к серьезным ожогам, вплоть до некроза тканей. Требуется немедленная госпитализация при передозировке уксусной кислотой.
Синильная
Опасное и ядовитое вещество. Присутствует в косточках некоторых ягод. При вдыхании в небольшом количестве вызывает нарушение дыхания, головную боль и другие неприятные симптомы.
При проникновении внутрь в большом количестве приводит к быстрой смерти человека из-за паралича дыхательного центра. Если произошло отравлении солями синильной кислоты требуется быстрое введение антидота и доставка в медицинское учреждение.
Самая сильная кислота в мире

Звание одной из сильной и агрессивной кислоты в мире принадлежит карборановой. Это соединение появилось путем экспериментов ученых с целью создать что-то устойчивое.
Она сильнее серной, но не имеет той агрессивности, как у нее. В состав соединения входят одиннадцать атомов брома и столько же атомов хлора. В пространстве молекула приобретает форму правильного многогранника – икосаэдра.
Благодаря подобному расположению атомов соединение обладает высокой устойчивостью.
Сколько кислоты может убить человека?
Сколько ядовитой кислоты требуется, чтобы получить отравление или наступила смерть? Сильные кислоты незамедлительно проявляют реакцию, поэтому в отдельных случаях достаточно маленькой капли либо одного вдоха.
Количество кислоты, способной спровоцировать отравление, зависит от возраста человека, его физического состояния, иммунной системы, способности организма к сопротивлению вредным веществам. У детей отравление развивается быстрее, чем у взрослых из-за ускоренного обмена веществ. Точную дозировку способен установить медицинский работник.
Симптомы отравления кислотой
Как проявляется отравление кислотой? В зависимости от вида соединения возможно развитие разных симптомов. Однако для всех отравлений характерно наличие одинаковых проявлений.
- Болезненные ощущения при глотании, боль в горле, пищеводе, желудке. При серьезных отравлениях возможно развитие болевого шока.
- Тошнота, рвотные позывы. Выходящие массы приобретают черный оттенок из-за кровотечения в желудке.
- Учащенное биение сердца.
- Сильная диарея, каловые массы черного оттенка при наличии кровотечения в кишечнике.
- Пониженное давление.
- Бледные кожные покровы и слизистые оболочки, возможно посинение верхнего слоя эпидермиса.
- Сильная головная боль.
- Пониженное количество мочи.
- Нарушение дыхательного процесса, дыхание частое, прерывистое.
- Потеря сознания, впадение в кому.
При появлении одного из признаков требуется немедленно вызвать бригаду скорой помощи. Жизнь и дееспособность пострадавшего зависят от быстрой реакции окружающих людей.
Лечение при отравлении ядом
До приезда врачей пострадавшему допустимо оказать первую помощь. При отравлении не обойтись без квалифицированной помощи, но некоторые действия способны облегчить состояние пациента.
- Если причиной отравления стал газ, то пациента выводят либо выносят на свежий воздух;
- Человека кладут на горизонтальную поверхность, обеспечивают ему полный покой;
- Запрещено промывать желудок, это способно привести к повторному ожогу пищевода;
- На область живота кладут лед, подобное действие поможет остановить внутреннее кровотечение;
- Нельзя давать человеку таблетки и питье, чтобы не спровоцировать негативные последствия.
Раздражение, ощущение песка в глазах, краснота — лишь небольшие неудобства при нарушенном зрении. Ученые доказали: снижение зрения в 92% случаев заканчивается слепотой.
Crystal Eyes — лучшее средство для восстановления зрения в любом возрасте.
Дальнейшее лечение проводится в отделении реанимации. Врач обследует пациента, подбирает подходящие препараты. Сопровождающему человеку необходимо рассказать доктору о произошедшем отравлении и проведенных действиях.
Процедуры:
- Промывание желудка с использованием зонда;
- Введение лекарственных и очищающих растворов при помощи капельниц;
- Использование кислородных ингаляций;
- Лечение состояние шока;
Все препараты подбираются доктором в зависимости от состояния пациента и степени отравления. Лечение продолжают до полного восстановления пациента.
Последствия и профилактика
Отравление кислотами часто заканчивается летальным исходом. При вовремя начатом лечении возможен благоприятный прогноз, но во многих случаях человек остается инвалидом. Действие всех кислот негативно сказывается на состоянии пищеварительного тракта, страдает мозг и нервная система.
Избежать интоксикации возможно при соблюдении осторожности во время работы с кислотами. Токсичные вещества нельзя оставлять в местах, доступных для детей и животных. При использовании токсичных соединений надевают защитную одежду, глаза скрывают за очками, на руках присутствуют перчатки.
Самая страшная и опасная кислота не доступна для простого обывателя. Однако в лабораториях важно соблюдать осторожность при использовании подобных веществ. При возникновении признаков отравления, требуется срочно обратиться в медицинское учреждение.

Карборановая кислота – самая сильная в мире
В 2005 году ученым, работающим в Калифорнийском университете в США, удалось создать новую кислоту невиданной силы. Изобретенное соединение в миллион раз превосходит по силе концентрированную серную кислоту. Ученые в тот момент задались целью найти новую молекулу, которая станет настоящим открытием в научном мире, и им удалось добиться положительного результата.
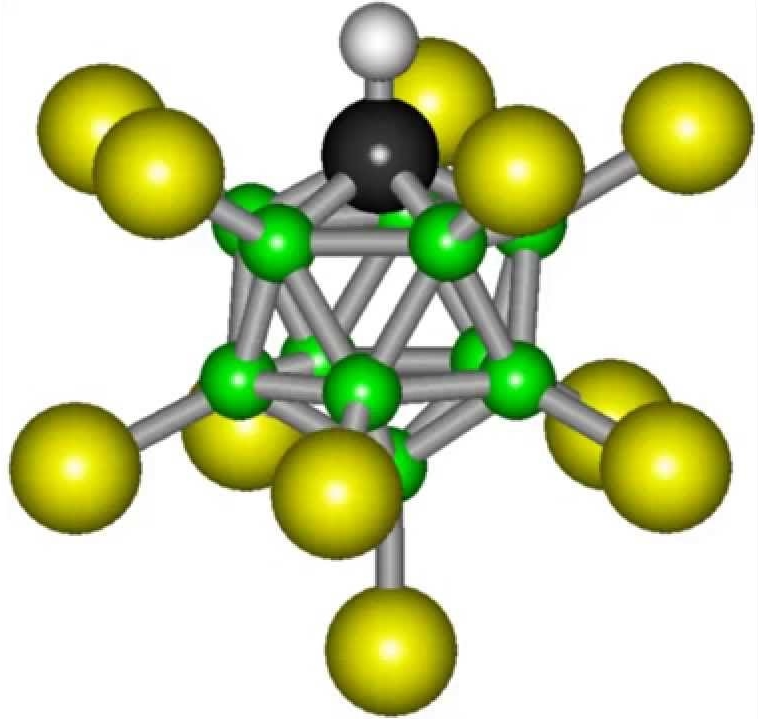
Формула карборановой кислоты не отличается сложностью: H(CHB11Cl11). Но все же синтезировать такое вещество в условиях обычной лаборатории не получится. Карборановая кислота превосходит по кислотности обычную воду в более чем триллиард раз.
Уникальное свойство самой сильной кислоты
Если где-нибудь упоминается о наиболее сильной в мире кислоте, человеческая фантазия рисует вещество, которое растворяет все на своем пути. На самом деле, разрушительные свойства совсем не являются основным признаком силы химического вещества. К примеру, многие полагали, что наиболее мощной кислотой является плавиковая, поскольку она растворяет стекло. Но это далеко от истины. Плавиковая кислота разъедает стеклянную тару, но может храниться в емкостях из полиэтилена.

Признанная наиболее сильной в мире карборановая кислота может легко храниться в стеклянных сосудах. Дело в том, что этому химическому веществу свойственна значительная химическая стабильность. Как и другие подобные соединения, карборановая кислота, вступая в реакцию с реагентами, отдает заряженные атомы водорода. После такой реакции состав имеет незначительный отрицательный заряд и не оказывает разрушительное воздействие на окружающие материалы.
Дальнейшие работы с карборановой кислотой
Конечно, создатели карборановой кислоты стали хорошо известны в мировом научном сообществе. Более того, гениальные ученые были удостоены многих заслуженных наград за значительный вклад в развитие науки. Использование нового вещества уже не ограничивается рамками научных лабораторий: карборановая кислота используется в промышленности в качестве мощнейшего катализатора.

Уникальной особенностью наиболее сильной в мире кислоты является ее способность взаимодействовать с инертными газами. Сегодня проводится множество исследований, целью которых является возможность возникновения реакции между ксеноном и карборановой кислотой. Также ученые не покладая рук работают над изучением других свойств мощнейшей кислоты.
Наиболее известная сильная кислота
О карборановой кислоте хорошо известно ученым. Простые люди чаще всего считают, что самой сильной является серная кислота. Это обусловлено частым использованием вещества в промышленности. Зачастую его применяют производители минеральных удобрений для получения суперфосфатов и сульфатов аммония.
Серная кислота широко применяется в металлургической промышленности. Ее также используют для очистки металлов от окисления. Не обходится без использования серной кислоты производство жидкого топлива. С ее помощью проводят очистку следующих продуктов:
Но не только промышленное использование заставляет многих людей полагать, что серная кислота является самой сильной в мире. Подобное мнение сложилось из-за того, что вещество, попадая на плоть, обугливает ее. Такое свойство серной кислоты часто используется при съемках криминальных фильмов.
Самая сильная органическая кислота
Если говорить о самой сильной кислоте органической химии, то лидерство тут принадлежит муравьиной кислоте. Вещество так было названо из-за обнаружения его в выделениях муравьев. Муравьиная кислота имеет обширную сферу использования. Ее часто используют в медицине, поскольку она обладает анальгезирующими и раздражающими свойствами. Муравьиная кислота присутствует во многих мазях, которые применяются для лечения ушибов, варикозных расширений вен, отеков. Лекарства с этим веществом позволяют избавиться от прыщей.

Муравьиную кислоту также широко применяют в химической промышленности. Ее используют также в сельском хозяйстве и пчеловодстве. Вещество также применяется в пище как добавка Е236.
Несмотря на свою распространенность, муравьиная кислота может представлять серьезную угрозу. Попадание концентрированного вещества на кожные покровы вызывает ожоги или сильную боль. Даже вдыхание паров муравьиной кислоты может стать причиной повреждений дыхательных путей. Но положительным свойством вещества является то, что оно быстро выводится из организма, не накапливаясь в нем.
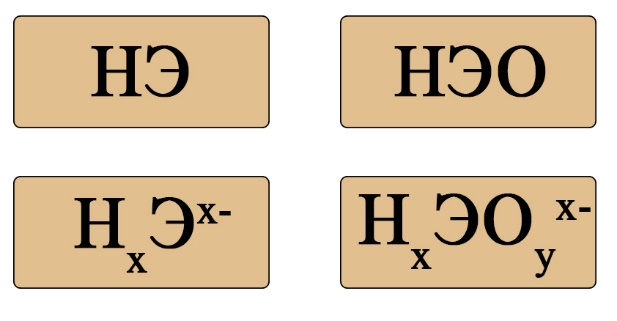
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
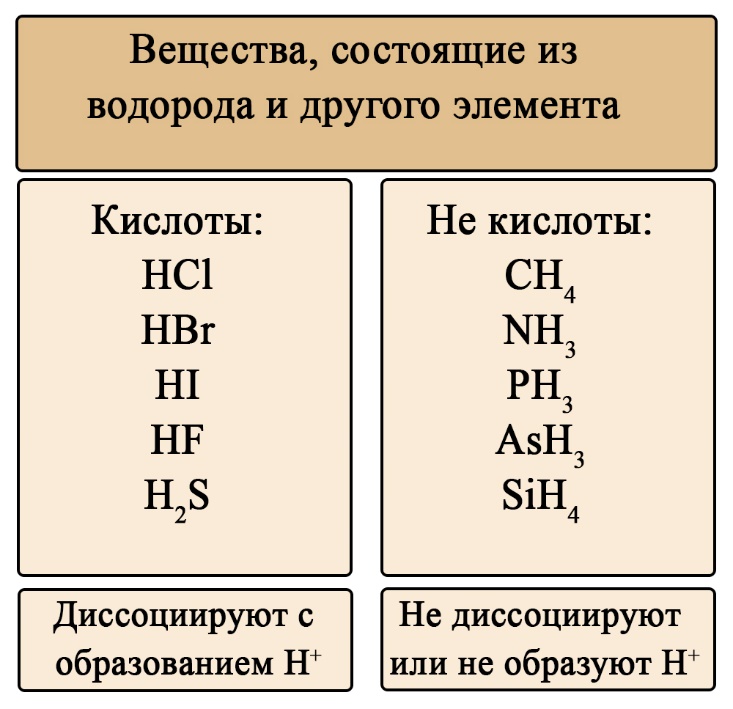
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие - содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
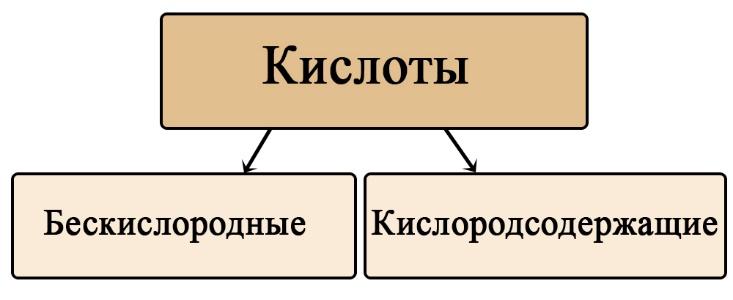
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
Реакция химических элементов всегда приводит к образованию новых веществ. Учёные обратили внимание, что некоторые из таких соединений обладают кислым вкусом, а потому они были названы кислотами.
- Общие свойства
- Концентрация вещества
- Основная классификация
- Сильные и слабые реагенты
- Химические реакции
- Водородный показатель
- Самые опасные кислотные соединения
- Кривые титрования

На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:

- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2H204 и H3BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
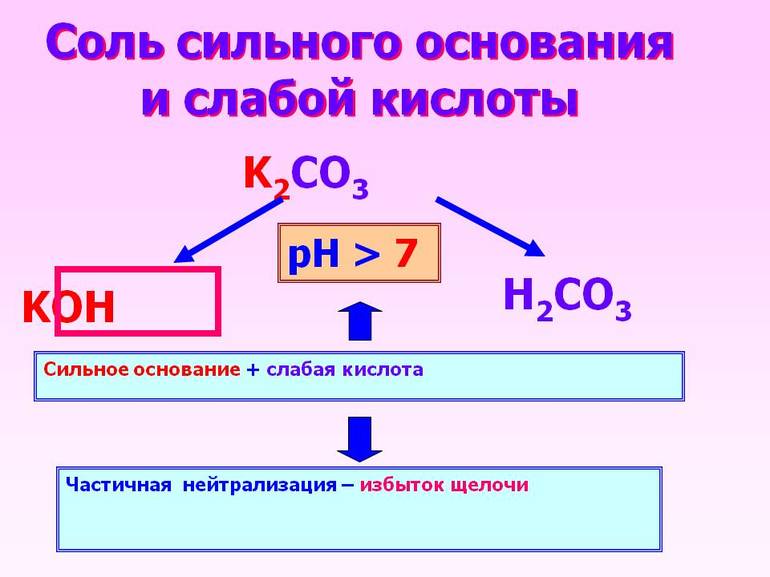
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
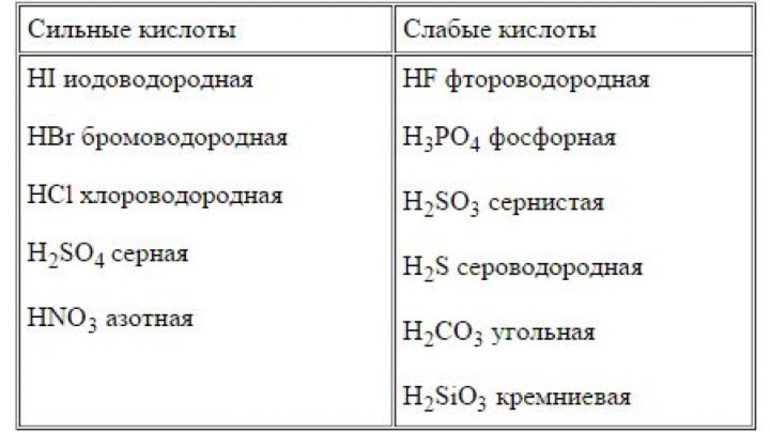
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.

Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.

При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.

Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.

Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Читайте также:


