Как образуются положительно и отрицательно заряженные ионы кратко
Обновлено: 02.07.2024
Атом, при взаимодействии с другими атомами, может отдать один или несколько электронов другому атому или, наоборот, присоединить один или несколько чужих электронов. В результате электрически нейтральный атом становится положительно или отрицательно заряженной частицей — ионом.
Ион — это положительно или отрицательно электрически заряженная частица, образовавшаяся в результате потери атомом или присоединения к нему одного или нескольких электронов.
Если атом теряет один электрон, то образуется положительно заряженный ион с зарядом +1, а если присоединяет электрон, то заряд иона будет равен -1. В случае потери атомом или присоединения к нему двух электронов образуются ионы с зарядами +2 или -2 соответственно и т. д.
Заряд иона записывается рядом с символом химического элемента в верхнем правом углу.
Пример. H 1+ , Ca 2+ , O 2- .
Знаки + и - , в записи заряда иона, ставятся после числа, которое показывает количество потерянных или присоединённых электронов. Число 1 обычно опускается, поэтому, если ион имеет заряд +1 или -1, то в верхнем правом углу ставят только плюс или минус.
Пример. H + , Cl - .
В зависимости от заряда иона (положительного или отрицательного), ионы делятся на катионы и анионы. Катионы — это положительно заряженные ионы. Анионы — это отрицательно заряженные ионы.
Катионы и анионы, то есть противоположно заряженные ионы, притягиваются друг к другу.
Положительно заряженные ионы образуются в случае потери атомом одного и более электронов (с электронами уходит отрицательный заряд).
Отрицательно заряженные ионы образуются при присоединении атомом электронов, которые увеличивают отрицательный заряд.

Напомню, что по модулю заряд протона равен заряду электрона.
Образование ионов путем изменения числа протонов выходит за рамки химии – это уже ядерные реакции (протоны находятся в ядре атома), то есть область ядерной физики.

Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
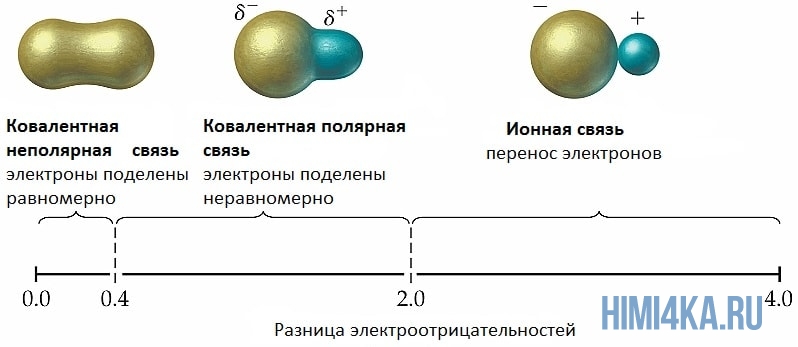
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
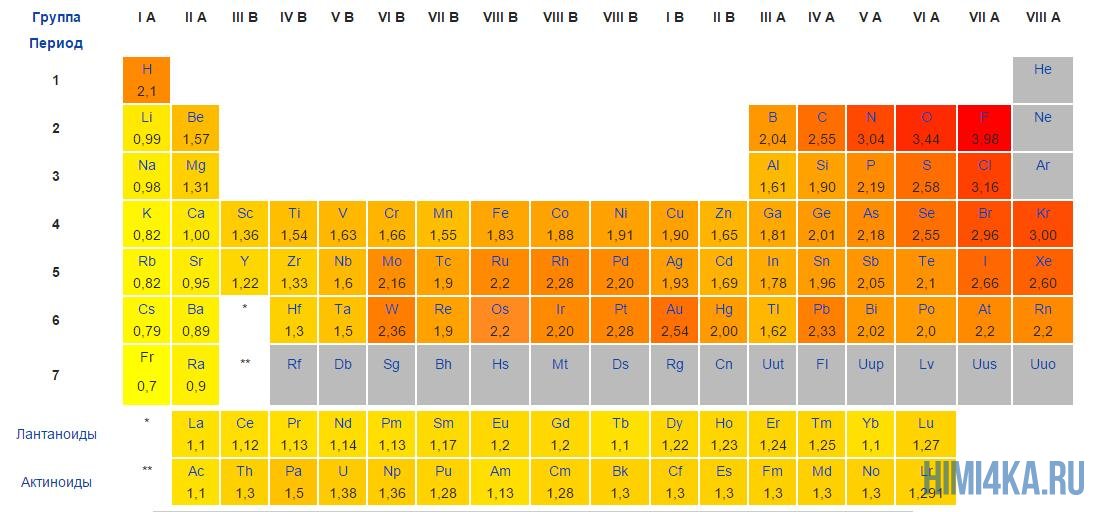
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
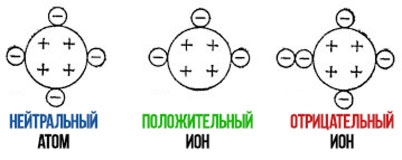
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e — ), образуя положительный ион натрия Na + , а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl — . Это записывается в виде двух реакций:
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
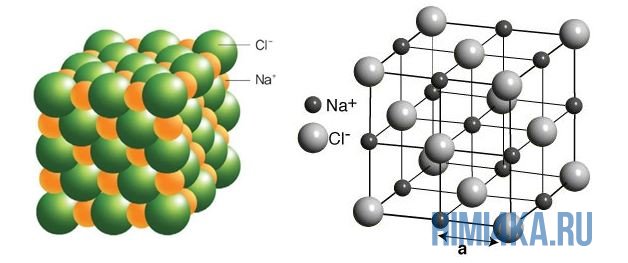
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl — окружен со всех сторон соседними положительными ионами натрия Na + ; ионы натрия Na + точно также окружены ближайшими хлорид-ионами Cl — . Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:

Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:

Степень окисления веществ
Заряд простого, одноатомного иона, например Mg 2+ или F 2- , называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg 2+ + 2e — → Mg
- Реакция окисления: F 2- → F + 2e —
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:

Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl — , имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl 3+ , имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H +1 , O -2 |
| CS2 | C(IV), S(II) | C +4 , S -2 |
| CH4 | C(IV), H(I) | C -4 , H +1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe 2+ железо(II) или ион двухвалентного железа
- Fe 3+ железо(III) или ион трехвалентного железа
- Сu + медь(I) или ион одновалентной меди
- Cu 2+ медь (II) или ион двухвалентной меди
- Sn 2+ олово(II) или двухвалентного олова
- Sn 4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe 3+ + e — → Fe 2+ . Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.

Если электронейтральный атом (т.е. частица, в которой число протонов в ядре равно числу электронов вокруг ядра) теряет электрон (или несколько электронов), то протонов становится больше, чем электронов. Следовательно, атом становится заряжен положительно – такую частицу называют положительно заряженным ионом или катионом.
Наоборот, если электронейтральный атом приобретает один или несколько электронов, то в этом случае уже электронов становится больше, чем протонов. Соответственно, атом становится отрицательным – такую частицу называют отрицательно заряженным ионом или анионом.
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Читайте также:

