Как классифицируют химическое сырье кратко
Обновлено: 30.06.2024
Многие химические реакции, с которыми вы познакомились в лабораторных условиях, или аналогичные им осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи — все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности.
Одиннадцать первых мест по объему производства принадлежит веществам, формулы которых: H2SO4, NH3, N2, СаО, O2, С2Н4, NaOH, Cl2, НСl, H3PO4, HNO3. Эти-то вещества и используют в больших количествах далее для получения столь необходимых видов продукции, как названные выше.
Главная задача химии и химической технологии — производство разнообразных веществ и материалов с определенным комплексом механических, физических, химических и биологических свойств.
Любое химическое производство создается на основе общих научных принципов (табл. 21).
Таблица 21
Научные принципы организации
химических производств
Несмотря на огромное многообразие химических производств веществ и материалов, все они включают составляющие, указанные на схеме 13.
Схема 13
Важнейшие составляющие химического производства

Сырье
Сырьем называют природные материалы (природные ресурсы), используемые в промышленности для получения различных продуктов и еще не прошедшие промышленной переработки. Иногда используют вторичное сырье — это изделия, отслужившие свой срок, или отходы каких-либо производств, которые экономически выгодно снова переработать в химические продукты.
Сырье химической промышленности классифицируют по различным признакам.
По составу сырье делят на минеральное и органическое (растительное и животное).
По агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природный и попутный газы, воздух) сырье.
К минеральному сырью относят руды (из них получают металлы) и нерудные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из них получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относится ископаемое горючее: торф, уголь, нефть, природный и попутный нефтяной газы — это ценное энергетическое сырье и сырье для химических синтезов. К органическому сырью также относится сырье растительного и животного происхождения, его дают сельское, лесное и рыбное хозяйство. В основном оно идет для производства продуктов питания, но частично, к сожалению, является и техническим сырьем. Кроме природных веществ, на химических заводах применяют полупродукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители, катализаторы (схема 14).
Схема 14
Классификация химического сырья

В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие сырьевые источники быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья.
Особое место среди природных ресурсов занимает вода. Она играет важную роль в химической промышленности.
В ряде производств это сырье и реагент, непосредственно участвующий в основных химических реакциях, например при получении водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Будучи универсальным растворителем и одним из наиболее распространенных катализаторов, вода дает возможность осуществлять многие химические реакции с большой скоростью в растворах или в присутствии ее следов. В химической, металлургической, пищевой и легкой промышленности воду используют как растворитель твердых, жидких, газообразных веществ. Часто ее применяют для перекристаллизации, для очистки различных продуктов производства от примесей.
Вода используется как теплоноситель из-за ее большой теплоемкости, доступности и безопасности в применении. Ею охлаждают реагирующие массы, нагретые в результате экзотермических реакций. Водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций или проведения эндотермических процессов.
Современные химические комбинаты расходуют миллионы кубических метров воды в сутки. Например, для получения 1 т аммиака требуется 1500 м 3 воды. Поэтому химические предприятия, нефтехимические заводы строят рядом с водными источниками.
Задачу сокращения расхода воды химическими предприятиями решают в трех основных направлениях: широкое применение оборотного водоснабжения (вода, используемая в теплообменных аппаратах, охлаждается и снова поступает в теплообменные аппараты, и так повторяется многократно), замена водяного охлаждения воздушным, очистка сточных вод и их повторное использование.
Энергия
Вы знаете, что большинство химических процессов требует затраты энергии. В химическом производстве энергию также расходуют на проведение вспомогательных операций: транспортировку сырья и готовой продукции, сжатие газов, дробление твердых веществ, контрольно-измерительное обслуживание и др. Химическая промышленность относится к одной из самых энергоемких. Средний расход только электрической энергии на производство 1 т аммиачной селитры NH4NO3 равен 11 000 кВт•ч; 1т синтетического аммиака — 3200; 1 т фосфора — 16 500; 1 т алюминия — 19 000.
В химической промышленности используют различные виды энергии: электрическую, тепловую, ядерную, химическую и световую.
Электрическую энергию используют для проведения электролиза расплавов и растворов веществ, нагревания, в операциях, связанных с электростатическими явлениями, например, в электрофильтрах при производстве серной кислоты для очистки оксида серы (IV). Электроэнергию вырабатывают тепловые (ТЭС), атомные (АЭС) электростанции и гидроэлектростанции (ГЭС).
Тепловая энергия в химической промышленности необходима для нагревания реагирующих веществ при проведении химических реакций, а также для сушки, плавления, дистилляции, выпаривания и других операций. Ее источником в производстве цемента, стекла, керамики служат различные виды топлива (твердого, жидкого, газообразного). Большинство же химических предприятий используют тепловую энергию в виде пара, горячей воды, получаемых из котельных установок или ТЭЦ.
Ядерную энергию используют главным образом для получения электроэнергии. Но такие реакции, как полимеризация, синтезы фенола и анилина, отверждение полимеров, проводят с помощью радиоактивного излучения.
Химическая энергия выделяется в виде теплоты в результате экзотермических реакций. Ее используют для предварительного подогрева исходных веществ, получения горячей воды, водяного пара. Химическая энергия может превращаться в электрическую, например, в аккумуляторах. А есть такие производства, в которых за счет энергии химических реакций покрывают собственные потребности, а излишки отпускают другим потребителям.
При получении 1 т серной кислоты из серы выделяется 5 МДж теплоты, а общие затраты на ее производство составляют всего 0,36 МДж. Излишки поступают к другим потребителям в виде пара и электроэнергии.
Световую энергию (ультрафиолетовое, инфракрасное, лазерное излучение) используют при синтезе хлороводорода, галогенировании органических веществ, реакциях изомеризации.
Ученые разрабатывают способы использования солнечной энергии, например фотохимическое разложение воды.
Защита окружающей среды и охрана труда
С точки зрения защитников окружающей среды, у химической промышленности плохая репутация. С чем это связано? Попробуем разобраться.
Все отрасли химической промышленности выпускают полезную продукцию. Вы можете сомневаться в необходимости тех или иных продуктов, но экономически они полезны и нужны, иначе бы их не производили.
Например, кому-то может быть неясно, зачем существует производство хлора, зато все согласны с необходимостью строительства завода по выпуску труб из поливинилхлорида.
Некоторые виды химической продукции действительно не вызывают особой симпатии: взрывчатые вещества для мин и снарядов, отравляющие вещества-пестициды, т. е. препараты для борьбы с сорняками, вредителями, возбудителями болезней.
С одной стороны, производство пестицидов возрастает, так как необходимо производить все больше продуктов питания для непрерывно увеличивающегося населения Земли. Но с другой стороны, некоторые пестициды весьма устойчивы в окружающей среде и представляют реальную опасность для существующих экосистем: гибнут полезные насекомые, птицы, рыбы, звери, происходит отравление людей непосредственно пестицидами или продуктами, в которых они накопились.
Любое промышленное предприятие (и химическое, конечно) имеет отходы. Производство без отходов невозможно. Газы выбрасывают в атмосферу, жидкие отходы — в канализацию, а иногда и в реку, твердые и некоторые жидкие сжигают в специальных печах или захоранивают в специально оборудованных местах.
Эти вещества загрязняют окружающую среду, неблагоприятно влияют на здоровье людей.
Поэтому химические предприятия потенциально опасны, их не строят непосредственно в городах. На самих предприятиях существуют жесткие требования охраны труда, что делает работу на них иногда даже безопаснее, чем на строительстве.
Например, установлены безопасные для здоровья людей предельно допустимые концентрации (ПДК) вредных веществ в воздухе производственных помещений и на территории предприятий, а также в атмосфере населенных мест; предусмотрены строгие меры для предотвращения пожаров и быстрой ликвидации возможных возгораний; на некоторых производствах работники имеют индивидуальные средства защиты от вредных веществ. Выполнение правил охраны труда контролируют органы государственной инспекции, а также внутризаводская служба.
Наилучшим способом решения проблемы снижения вредности производства для людей и охраны окружающей среды служит применение безотходных или малоотходных технологий. Пример — синтез аммиака, в котором отходы (непрореагировавшие газы) многократно возвращают в производство.
В других случаях остро стоит вопрос об очистке отходов. К современным ее методам относят фильтрацию, пыле-, газоулавливание, обезвреживание (нейтрализация, поглощение газов жидкими и твердыми поглотителями), биологическую очистку (при помощи микроорганизмов), осаждение в специальных отстойниках, химические методы (перевод веществ в малорастворимые и нерастворимые соединения) и другие способы.
Очистные сооружения, конечно, требуют определенных материальных затрат, а некоторые руководители предприятий стараются избавиться от отходов самыми дешевыми способами. Такой подход, очевидно, объясняется невниманием к проблемам охраны окружающей среды от загрязнения, а может быть, связан с некомпетентностью в этом вопросе.
Характерная черта химической промышленности — сравнительно небольшое количество работающих. Это обусловлено высокой степенью механизации и автоматизации производств, что также способствует охране труда работников.
Производство аммиака и метанола
Любое химическое производство состоит из отдельных взаимосвязанных процессов-стадий (схема 15).
Схема 15
Основные стадии химического производства

Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках (рис. 50), которые часто монтируют на одном предприятии.

Рис. 50.
Схема установки, которую можно использовать в производстве аммиака и метанола
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду. Затраты на производство существенно снижены за счет осуществления непрерывного процесса: исходные вещества постоянно поступают в реактор, а продукты постоянно из него выводятся. Непрерывность процесса позволяет его полностью автоматизировать.
Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии (табл. 22).
Таблица 22
Производство аммиака и метанола
Основные стадии производства
I. Подготовка сырья. Подвод реагирующих веществ в зону реакции с помощью турбокомпрессора и циркуляционного компрессора
Реагирующие вещества: оксид углерода (II) СО и водород Н2 (их смесь называется синтез-газом). Синтез-газ получают конверсией метана водяным паром при высокой температуре:
- аммиак - 25—60 МПа,
- метанол - 25—30 МПа,
а затем смешивают с циркуляционным газом (о нем смотрите далее) и направляют в колонну синтеза
II. Химический процесс проходит в основном аппарате производства — колонне синтеза
Подбор оптимальных условий проведения этих синтезов осуществляют исходя из характеристики химических реакций:
- метанол - 2) смещению равновесия вправо способствует также увеличение концентрации водорода в исходной смеси по сравнению со стехиометрическим;
- аммиак - 450—500 °С
- метанол - 370—400 °С Уменьшение давления и увеличение температуры способствуют увеличению доли побочных продуктов
Исходную смесь газов сначала нагревают в теплообменнике за счет выходящих газов, движущихся противотоком, а затем в зоне экзотермической реакции. Противоток — движение различных веществ навстречу друг другу с целью создания наилучших условий для обмена энергией (в данном случае);
В обоих процессах реагенты и продукты реакции находятся в газовой фазе и образуют гомогенную систему. Реакции протекают на поверхности твердых катализаторов. Такие реакции составляют особый класс — гетерогенно-каталитических реакций.
Важное значение имеет площадь поверхности катализатора. Катализатор изготавливают в виде губчатых гранул или таблеток.
Так как активность катализатора сильно снижается от присутствия примесей, то реагирующие газы подвергают тщательной очистке (от воды, соединений серы и др.);
5) при всех указанных условиях проведения реакций равновесный выход продукта составляет не более 20%. Поэтому синтез продукта осуществляют по способу многократной циркуляции, т. е. непрореагировавшую смесь газов многократно возвращают в производство после отделения от нее полученного продукта
III. Отвод продуктов и непрореагировавших веществ из зоны реакции производят через холодильник с последующим разделением в сепараторе
- аммиак - N2, Н2 и NH3,
- метанол - СО, Н2 и СН3ОН,
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в частности формальдегида


которые используют в производстве фенолформальдегидных смол и полиметилметакрилата (органического стекла) соответственно. Помимо этого, метанол используют как растворитель, экстрагент, а в ряде стран — в качестве моторного топлива, так как добавка его к бензину повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах.
Многие химические реакции, с которыми вы познакомились в лабораторных условиях, или аналогичные им осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи — все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности.
Одиннадцать первых мест по объему производства принадлежит веществам, формулы которых: H2SO4, NH3, N2, СаО, O2, С2Н4, NaOH, Cl2, НСl, H3PO4, HNO3. Эти-то вещества и используют в больших количествах далее для получения столь необходимых видов продукции, как названные выше.
| Химическая промышленность — это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья. Основой ее является химическая технология — наука о наиболее экономичных методах и средствах массовой химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства. |
Главная задача химии и химической технологии — производство разнообразных веществ и материалов с определенным комплексом механических, физических, химических и биологических свойств.
Любое химическое производство создается на основе общих научных принципов.
Научные принципы организации химических производств
| Общие принципы | Частные принципы |
| 1. Создание оптимальных условий проведения химических реакций | Противоток веществ, прямоток веществ, увеличение площади поверхности соприкосновения реагирующих веществ, использование катализатора, повышение давления, повышение концентраций реагирующих веществ |
| 2. Полное и комплексное использование сырья | Циркуляция, создание смежных производств (по переработке отходов) |
| 3. Использование теплоты химических реакций | Теплообмен, утилизация теплоты реакций |
| 4. Принцип непрерывности | Механизация и автоматизация производства |
| 5. Защита окружающей среды и человека | Автоматизация вредных производств, герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу |
Несмотря на огромное многообразие химических производств веществ и материалов, все они включают составляющие, указанные на схеме.
Важнейшие составляющие химического производства
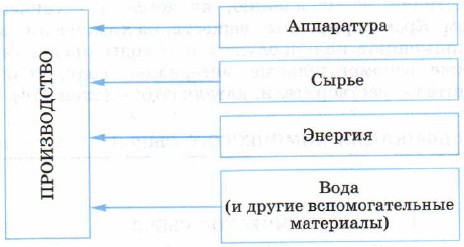
Сырье
Сырьем называют природные материалы (природные ресурсы), используемые в промышленности для получения различных продуктов и еще не прошедшие промышленной переработки. Иногда используют вторичное сырье — это изделия, отслужившие свой срок, или отходы каких-либо производств, которые экономически выгодно снова переработать в химические продукты.
Сырье химической промышленности классифицируют по различным признакам.
По составу сырье делят на минеральное и органическое (растительное и животное).
По агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природный и попутный газы, воздух) сырье.
К минеральному сырью относят руды (из них получают металлы) и нерудные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из них получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относится ископаемое горючее: торф, уголь, нефть, природный и попутный нефтяной газы — это ценное энергетическое сырье и сырье для химических синтезов. К органическому сырью также относится сырье растительного и животного происхождения, его дают сельское, лесное и рыбное хозяйство. В основном оно идет для производства продуктов питания, но частично, к сожалению, является и техническим сырьем. Кроме природных веществ, на химических заводах применяют полупродукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители, катализаторы (схема).

Классификация химического сырья
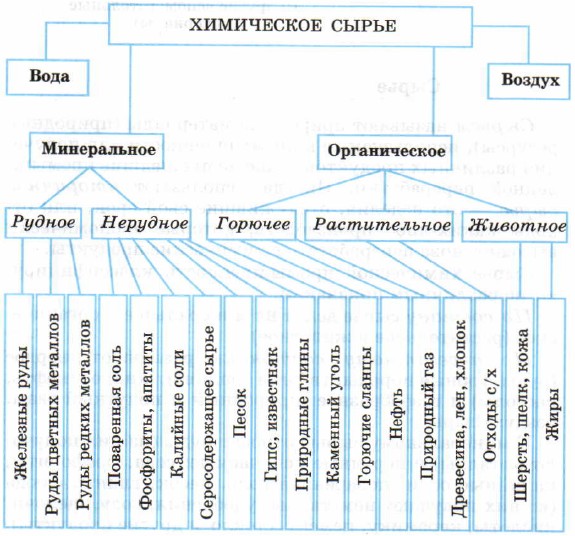
В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие сырьевые источники быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья.
Вода
Особое место среди природных ресурсов занимает вода. Она играет важную роль в химической промышленности.
В ряде производств это сырье и реагент, непосредственно участвующий в основных химических реакциях, например при получении водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Будучи универсальным растворителем и одним из наиболее распространенных катализаторов, вода дает возможность осуществлять многие химические реакции с большой скоростью в растворах или в присутствии ее следов. В химической, металлургической, пищевой и легкой промышленности воду используют как растворитель твердых, жидких, газообразных веществ. Часто ее применяют для перекристаллизации, для очистки различных продуктов производства от примесей.
Вода используется как теплоноситель из-за ее большой теплоемкости, доступности и безопасности в применении. Ею охлаждают реагирующие массы, нагретые в результате экзотермических реакций. Водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций или проведения эндотермических процессов.
Современные химические комбинаты расходуют миллионы кубических метров воды в сутки. Например, для получения 1 т аммиака требуется 1500 м 3 воды. Поэтому химические предприятия, нефтехимические заводы строят рядом с водными источниками.
Задачу сокращения расхода воды химическими предприятиями решают в трех основных направлениях: широкое применение оборотного водоснабжения (вода, используемая в теплообменных аппаратах, охлаждается и снова поступает в теплообменные аппараты, и так повторяется многократно), замена водяного охлаждения воздушным, очистка сточных вод и их повторное использование.
Энергия
Вы знаете, что большинство химических процессов требует затраты энергии. В химическом производстве энергию также расходуют на проведение вспомогательных операций: транспортировку сырья и готовой продукции, сжатие газов, дробление твердых веществ, контрольно-измерительное обслуживание и др. Химическая промышленность относится к одной из самых энергоемких. Средний расход только электрической энергии на производство 1 т аммиачной селитры NH4NO3 равен 11 000 кВт•ч; 1т синтетического аммиака — 3200; 1 т фосфора — 16 500; 1 т алюминия — 19 000.
В химической промышленности используют различные виды энергии: электрическую, тепловую, ядерную, химическую и световую.
Электрическую энергию используют для проведения электролиза расплавов и растворов веществ, нагревания, в операциях, связанных с электростатическими явлениями, например, в электрофильтрах при производстве серной кислоты для очистки оксида серы (IV). Электроэнергию вырабатывают тепловые (ТЭС), атомные (АЭС) электростанции и гидроэлектростанции (ГЭС).
Тепловая энергия в химической промышленности необходима для нагревания реагирующих веществ при проведении химических реакций, а также для сушки, плавления, дистилляции, выпаривания и других операций. Ее источником в производстве цемента, стекла, керамики служат различные виды топлива (твердого, жидкого, газообразного). Большинство же химических предприятий используют тепловую энергию в виде пара, горячей воды, получаемых из котельных установок или ТЭЦ.
Ядерную энергию используют главным образом для получения электроэнергии. Но такие реакции, как полимеризация, синтезы фенола и анилина, отверждение полимеров, проводят с помощью радиоактивного излучения.
Химическая энергия выделяется в виде теплоты в результате экзотермических реакций. Ее используют для предварительного подогрева исходных веществ, получения горячей воды, водяного пара. Химическая энергия может превращаться в электрическую, например, в аккумуляторах. А есть такие производства, в которых за счет энергии химических реакций покрывают собственные потребности, а излишки отпускают другим потребителям.
При получении 1 т серной кислоты из серы выделяется 5 МДж теплоты, а общие затраты на ее производство составляют всего 0,36 МДж. Излишки поступают к другим потребителям в виде пара и электроэнергии.
Световую энергию (ультрафиолетовое, инфракрасное, лазерное излучение) используют при синтезе хлороводорода, галогенировании органических веществ, реакциях изомеризации.
Ученые разрабатывают способы использования солнечной энергии, например фотохимическое разложение воды.
Химия и производство
Многие химические реакции, с которыми вы познакомились в лабораторных условиях, или аналогичные им осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи — все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности.
Одиннадцать первых мест по объему производства принадлежит веществам, формулы которых: H2SO4, NH3, N2, СаО, O2, С2Н4, NaOH, Cl2, НСl, H3PO4, HNO3. Эти-то вещества и используют в больших количествах далее для получения столь необходимых видов продукции, как названные выше.
| Химическая промышленность — это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья. Основой ее является химическая технология — наука о наиболее экономичных методах и средствах массовой химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства. |
Главная задача химии и химической технологии — производство разнообразных веществ и материалов с определенным комплексом механических, физических, химических и биологических свойств.
Любое химическое производство создается на основе общих научных принципов.
Научные принципы организации химических производств
| Общие принципы | Частные принципы |
| 1. Создание оптимальных условий проведения химических реакций | Противоток веществ, прямоток веществ, увеличение площади поверхности соприкосновения реагирующих веществ, использование катализатора, повышение давления, повышение концентраций реагирующих веществ |
| 2. Полное и комплексное использование сырья | Циркуляция, создание смежных производств (по переработке отходов) |
| 3. Использование теплоты химических реакций | Теплообмен, утилизация теплоты реакций |
| 4. Принцип непрерывности | Механизация и автоматизация производства |
| 5. Защита окружающей среды и человека | Автоматизация вредных производств, герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу |
Несмотря на огромное многообразие химических производств веществ и материалов, все они включают составляющие, указанные на схеме.
Важнейшие составляющие химического производства

Сырье
Сырьем называют природные материалы (природные ресурсы), используемые в промышленности для получения различных продуктов и еще не прошедшие промышленной переработки. Иногда используют вторичное сырье — это изделия, отслужившие свой срок, или отходы каких-либо производств, которые экономически выгодно снова переработать в химические продукты.
Сырье химической промышленности классифицируют по различным признакам.
По составу сырье делят на минеральное и органическое (растительное и животное).
По агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природный и попутный газы, воздух) сырье.
К минеральному сырью относят руды (из них получают металлы) и нерудные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из них получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относится ископаемое горючее: торф, уголь, нефть, природный и попутный нефтяной газы — это ценное энергетическое сырье и сырье для химических синтезов. К органическому сырью также относится сырье растительного и животного происхождения, его дают сельское, лесное и рыбное хозяйство. В основном оно идет для производства продуктов питания, но частично, к сожалению, является и техническим сырьем. Кроме природных веществ, на химических заводах применяют полупродукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители, катализаторы (схема).
Классификация химического сырья

В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие сырьевые источники быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья.
Вода
Особое место среди природных ресурсов занимает вода. Она играет важную роль в химической промышленности.
В ряде производств это сырье и реагент, непосредственно участвующий в основных химических реакциях, например при получении водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Будучи универсальным растворителем и одним из наиболее распространенных катализаторов, вода дает возможность осуществлять многие химические реакции с большой скоростью в растворах или в присутствии ее следов. В химической, металлургической, пищевой и легкой промышленности воду используют как растворитель твердых, жидких, газообразных веществ. Часто ее применяют для перекристаллизации, для очистки различных продуктов производства от примесей.
Вода используется как теплоноситель из-за ее большой теплоемкости, доступности и безопасности в применении. Ею охлаждают реагирующие массы, нагретые в результате экзотермических реакций. Водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций или проведения эндотермических процессов.
Современные химические комбинаты расходуют миллионы кубических метров воды в сутки. Например, для получения 1 т аммиака требуется 1500 м 3 воды. Поэтому химические предприятия, нефтехимические заводы строят рядом с водными источниками.
Задачу сокращения расхода воды химическими предприятиями решают в трех основных направлениях: широкое применение оборотного водоснабжения (вода, используемая в теплообменных аппаратах, охлаждается и снова поступает в теплообменные аппараты, и так повторяется многократно), замена водяного охлаждения воздушным, очистка сточных вод и их повторное использование.
Энергия
Вы знаете, что большинство химических процессов требует затраты энергии. В химическом производстве энергию также расходуют на проведение вспомогательных операций: транспортировку сырья и готовой продукции, сжатие газов, дробление твердых веществ, контрольно-измерительное обслуживание и др. Химическая промышленность относится к одной из самых энергоемких. Средний расход только электрической энергии на производство 1 т аммиачной селитры NH4NO3 равен 11 000 кВт•ч; 1т синтетического аммиака — 3200; 1 т фосфора — 16 500; 1 т алюминия — 19 000.
В химической промышленности используют различные виды энергии: электрическую, тепловую, ядерную, химическую и световую.
Электрическую энергию используют для проведения электролиза расплавов и растворов веществ, нагревания, в операциях, связанных с электростатическими явлениями, например, в электрофильтрах при производстве серной кислоты для очистки оксида серы (IV). Электроэнергию вырабатывают тепловые (ТЭС), атомные (АЭС) электростанции и гидроэлектростанции (ГЭС).
Тепловая энергия в химической промышленности необходима для нагревания реагирующих веществ при проведении химических реакций, а также для сушки, плавления, дистилляции, выпаривания и других операций. Ее источником в производстве цемента, стекла, керамики служат различные виды топлива (твердого, жидкого, газообразного). Большинство же химических предприятий используют тепловую энергию в виде пара, горячей воды, получаемых из котельных установок или ТЭЦ.
Ядерную энергию используют главным образом для получения электроэнергии. Но такие реакции, как полимеризация, синтезы фенола и анилина, отверждение полимеров, проводят с помощью радиоактивного излучения.
Химическая энергия выделяется в виде теплоты в результате экзотермических реакций. Ее используют для предварительного подогрева исходных веществ, получения горячей воды, водяного пара. Химическая энергия может превращаться в электрическую, например, в аккумуляторах. А есть такие производства, в которых за счет энергии химических реакций покрывают собственные потребности, а излишки отпускают другим потребителям.
При получении 1 т серной кислоты из серы выделяется 5 МДж теплоты, а общие затраты на ее производство составляют всего 0,36 МДж. Излишки поступают к другим потребителям в виде пара и электроэнергии.
Световую энергию (ультрафиолетовое, инфракрасное, лазерное излучение) используют при синтезе хлороводорода, галогенировании органических веществ, реакциях изомеризации.
Ученые разрабатывают способы использования солнечной энергии, например фотохимическое разложение воды.

Вещества, которые используются для изготовления самой разнообразной продукции называют химическое сырье или сырьем химической промышленности, которое включает в себя: фосфаты, серу, каменную соль, калийные соли, натрон (натуральная сода), барит и буру. В настоящее время в качестве сырья для промышленности органической химии имеют большое значение также: сырая нефть и каменный уголь.
Классифицируют химическое сырье как:
- натуральные, минеральные и растительные вещества – по происхождению;
- неорганические и органические вещества – по составу;
- твердые, жидкие и газообразные – по агрегатному состоянию.
Некоторые важные химические сырьевые материалы, использовавшиеся в прошлом, например, натрон (натриевая сода - гидратированный карбонат натрия) или натриевая соль, а также чилийская селитра или нитрат натрия - используемая при производстве удобрений и нитроглицерина, теперь получают синтетическим путем.
Фосфиты представляют собой осадочные породы, состоящие в основном из фосфатов (в основном апатит - фосфат кальция). Они возникают в результате осаждения фосфата кальция из морской воды, процессов диагенеза, а также из костей и экскрементов вымерших животных в условиях сухого климата. Основным продуктом фосфатной обработки являются фосфорные удобрения (супертомаза).
Фосфаты (в основном кальций и магний) также содержатся в гуанофекалах, накапливающихся в колониях морских птиц. Он использовался в прошлом (XIX век) как отличное натуральное удобрение. В настоящее время его потребление снова растет (эффект от развития органического земледелия).
Каменная соль (галит - NaCl) - это эффект кристаллизации соединений, растворенных в морской воде или соленых озерах в условиях жаркого сухого климата (это один из эвапоритов). В такой среде (на краю морей и соленых озер) сегодня создается соль. При сходных условиях образовались ископаемые отложения солей, в настоящее время часто принимающая форму диапирно-соляного купола. Каменная соль обычно используется в кулинарии (кухонная соль) для приправы и консервирования пищи. Зимой он также используется для поддержания дорожного движения (помогает таять снег и лед). В химической промышленности (неорганическая химия) является основным сырьем для производства каустической соды (гидроксид натрия - NaOH) и хлора (Cl2), которые, помимо прочего, используются в качестве сырья в производстве бумаги, мыла и пластика (поливинилхлорид - ПВХ). Месторождения каменной соли широко распространены, например, в США. Теоретически огромным резервуаром галита (хлорида натрия) является морская вода. В ней растворено более 10,3 трлн. тонн хлористого натрия.
Калиевые соли (или более широко калиево-магниевые) представляют собой несколько десятков неорганических солей, содержащих катион калия. Подобно каменной соли (сопровождающей отложения галита и ангидрита), они испаряются, среди прочего, на Мертвом море.
Сера используется главным образом в производстве серной кислоты ( в частности, для производства красителей, искусственных волокон, взрывчатых веществ, лекарств, для очистки масел, керосина и парафина), в качестве ингредиента в искусственных удобрениях, для производства пороха, лекарств и вакцин (содержится, среди прочего, в пенициллине), средствах защиты растений, вулканизации каучука и др.
В природе сера встречается в естественном виде (образуется в результате вулканических выделений непосредственно или из окисленного сероводорода и в результате восстановления гипса и других сульфатов в испарительных слоях.
В настоящее время более 90% производимой серы поступает из процесса извлечения (полученного при десульфурации обработанной сырой нефти, природного газа и металлических руд). Поэтому место производства серы не всегда совпадает с местом добычи сырья, из которого оно поступает (например, извлечение серы из нефти, добываемой в Саудовской Аравии, может осуществляться на нефтеперерабатывающем заводе в США).
Глобальные ресурсы природной серы из осадочных и вулканических месторождений, а также серы, содержащейся в сырой нефти, природном газе, нефтяных песках и сульфидах металлов (металлических рудах), оцениваются примерно в 5 миллиардов тонн (около 20% этих ресурсов находится в США).
Барит (сульфат бария BaSO4) широко распространен в жилах (сопровождается цинковыми и свинцовыми рудами и железными рудами) и вблизи гидротермальных источников. Большая часть продукции используется в буровых растворах в качестве отягчающей добавки. Он также используется в производстве металлического стержня в рентгенодиагностике, а также в соединениях, получаемых на нем в резиновой, красильной, бумажной и текстильной промышленности. Выявленные глобальные ресурсы барита составляют около 740 миллионов тонн.
Сырье химической промышленности классифицируют по различным признакам:
– по происхождению ‑ минеральное, растительное и животное;
– по химическому составу ‑ неорганическое и органическое;
– по агрегатному состоянию ‑ твердое, жидкое (нефть, рассолы) и газообразное (воздух, природный газ и газы нефтепереработки);
– по запасам – возобновимое и невозобновимое.
Минеральное сырье делят на рудное (металлическое), нерудное и горючее (органическое).
Рудное минеральное сырье, используемое для получения металлов в технически чистом виде, состоит из природных минералов. Минералы руд содержат в основном оксиды и сульфиды металлов (оксиды железа, сульфиды меди, цинка) и оксиды соединений, составляющих пустую породу (оксиды кремния, алюминия, кальция, магния).
По составу минералов руды бывают окисленными ‑ состоящими из оксидов, сульфидными и самородными.
Руды, в состав которых входят соединения разных металлов, называют полиметаллическими.
Нерудное минеральное сырье разнообразно по химическому составу и либо применяется в естественном состоянии ‑ песок, глина, асбест, слюда и др., либо поступает на химическую переработку ‑ сульфаты, фосфаты, карбонаты, хлориды, алюмосиликаты и т. п.
Горючие минеральные ископаемые ‑ торф, бурые и каменные угли, сланцы, а также нефть и природный газ ‑ относят к органическим соединениям и используют в качестве сырья и источников энергии.
Особенностью минерального сырья является его невозобновляемость, а также неравномерность распределения по поверхности земли и ее недрам.
Растительное и животное сырье ‑ древесина, хлопок, масла и жиры, молоко, кожа, шерсть и т. п. ‑ перерабатывают или в продукты питания (пищевое сырье), или в продукты бытового и промышленного назначения (техническое сырье). Источниками растительного и животного сырья являются ресурсы естественной среды обитания: земельные, лесные, водные. Многие виды растительного и животного сырья перед поступлением в производство сортируют, перебирают и очищают. Коэффициент использования растительного и животного сырья невелик, поэтому задача комплексного и максимального использования этого сырья имеет еще большее значение, чем для минерального.
В химической промышленности широко применяются и такие доступные и дешевые виды сырья, как вода и воздух.
Невозобновимое сырье не восстанавливается совсем или восстанавливается значительно медленнее, чем идет его использование человеком в обозримый период времени.
Возобновимое сырье – это растительное и животное, некоторое минеральное сырье (например, соли, осаждающиеся в озерах). Темпы расхода этого вида сырья должны соответствовать темпам его потребления, иначе оно станет невозобновимым.
Полупродукты – вещества и материалы, являющиеся исходными
в производстве продуктов и полученные из природного сырья в другом
производстве.
Вторичное сырье – используемые в производстве вещества и материалы, являющиеся невостребованными в других производствах. Источниками их являются отходы производства и отходы потребления.
Отходы производства ‑ это остатки, которые получают при технологической переработке сырья, материалов или полуфабрикатов в конечные продукты, они не соответствуют требованиям, предъявляемым к готовой продукции, но после предварительной обработки (или без нее) могут быть использованы в другом производстве в качестве сырья.
Отходы потребления – бывшие в употреблении вещества и изделия, восстановление которых экономически не выгодно.
Стоимость сырья в химической промышленности составляет в среднем 60-70 % себестоимости продукта. Решение сырьевой проблемы осуществляется разнообразными путями: приближением источников сырья к производству, т. е. использованием более дешевого местного сырья; переработкой отходов, пылевых и газовых уносов основного производства в новые продукты, непосредственным использованием отходов, предварительным обогащением сырья в целях повышения концентрации полезных компонентов; заменой одного вида сырья другим, более экономичным. Например, переход с каменного угля как основного сырья химической промышленности на нефть и природный газ дал большой экономический эффект. Расчетные данные свидетельствуют, что себестоимость добычи и подготовки нефти в пересчете на единицу условного топлива в 3,5 раза, а природного газа ‑ в 12 раз меньше, чем угля, добытого шахтным способом. Дешевый и доступный природный газ и продукты нефтепереработки обеспечивают снижение себестоимости продуктов массового производства: пластических масс, синтетических волокон, каучуков, моющих средств и др. Использование природного газа вместо кокса снижает почти вдвое себестоимость аммиака и, соответственно, уменьшает себестоимость азотных удобрений.

КЛАССИФИКАЦИЯ И ОБЛАСТИ ПРИМЕНЕНИЯ СЫРЬЯ В ХИМИЧЕСКИХ ПРОИЗВОДСТВАХ
1 Владимирский государственный университет имени Александра Григорьевича и Николая Григорьевича Столетовых
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Сырье-это природные материалы (природные ресурсы), которые используются в промышленности для производства различных продуктов и еще не прошли промышленную переработку. Иногда используется вторичное сырье — это продукты, отслужившие свой срок, или отходы какого-либо производства, которые экономически выгодно перерабатывать снова в химические продукты.
Сырье химической промышленности классифицируется по различным признакам:
1) по составу сырье делится на минеральное и органическое (растительное и животное).
2) по агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природные и попутные газы, воздух) сырье.
К минеральному сырью относятся руды (из которых получают металлы) и нерудные полезные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из которых получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относятся ископаемые виды топлива: торф, уголь, нефть, природные и попутные нефтяные газы - это ценное энергетическое сырье и сырье для химического синтеза. Органическое сырье также включает сырье растительного и животного происхождения, которое производится в сельском хозяйстве, лесном хозяйстве и рыбоводстве. Он используется в основном для производства продуктов питания, но, к сожалению, это также частично техническое сырье. Кроме природных веществ, химические заводы используют промежуточные продукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители и катализаторы.
Классификация химического сырья
В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие источники сырья быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья.
Вода занимает особое место среди природных ресурсов. Он играет важную роль в химической промышленности. В ряде отраслей промышленности это сырье и реагент, непосредственно участвующие в основных химических реакциях, например, в производстве водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Являясь универсальным растворителем и одним из наиболее распространенных катализаторов, вода позволяет проводить многие химические реакции с высокой скоростью в растворах или в присутствии ее следов. В химической, металлургической, пищевой и легкой промышленности вода используется в качестве растворителя для твердых, жидких и газообразных веществ. Его часто используют для перекристаллизации, для очистки различных продуктов от примесей.
Вода используется в качестве теплоносителя из-за ее высокой теплоемкости, доступности и безопасности в использовании. Он охлаждает реагирующие массы, нагретые в результате экзотермических реакций. Водяной пар или горячая вода используются для нагрева взаимодействующих веществ для ускорения реакций или проведения эндотермических процессов.
Кроме того, большинство химических процессов требуют энергии. В химическом производстве энергия расходуется также на вспомогательные операции: транспортировку сырья и готовой продукции, сжатие газов, дробление твердых частиц, контрольно-измерительные услуги и др. Химическая промышленность - одна из самых энергоемких.
Химическая энергия выделяется в виде тепла в результате экзотермических реакций. Он используется для предварительного нагрева сырья, получения горячей воды, водяного пара. Химическая энергия может быть преобразована в электрическую энергию, например, в батареях. И есть некоторые отрасли промышленности, которые используют энергию химических реакций для покрытия своих собственных потребностей, а излишки высвобождаются другим потребителям.
Области применения химического сырья
Химическое сырье используется для производства большинства продуктов во всех сферах жизни, от изготовления детских игрушек до автомобильных запчастей.
Продукция строительной отрасли пользуется высоким спросом. Ведь с помощью различных строительных компонентов есть отличный шанс улучшить качество используемых материалов. В свою очередь, это позволит повысить их эксплуатационный ресурс, устойчивость к различным внешним факторам-температуре и атмосферным явлениям.
Для производства и выпуска любой продукции необходимо иметь не только качественное и надежное сырье, но и современное оборудование с последовательным применением современных технологий и технологий в этой области. Ни для кого не секрет, что мировая химическая промышленность в настоящее время развивается очень хорошо в самых разных областях. Поэтому для поддержания должного состояния отрасли большинство предприятий и организаций предлагают различное необходимое химическое сырье в большом ассортименте.
Такие материалы остро необходимы для производства продукции, которая необходима в пищевой промышленности, сельском хозяйстве и сельском хозяйстве, фармакологии, фармации, текстильной промышленности, биологии и медицине.
Список литературы
1. Доронин А. А. Новое открытие американских химиков. / Коммерсантъ, №56, 2004г.
2. Килимник А. Б. Физическая химия: Учебное пособие. Тамбов: Изд-во Тамб. гос. техн. ун-та, 2005. 80 с.
3. Ким А.М., Органическая химия, 2004.
4. Перепелкин К. Е. Полимерные композиты на основе химических волокон, их основные виды, свойства и применение / Технический текстиль №13, 2006
5. Травень В.Ф. Органическая химия: Учебник для вузов в 2-х томах. – М.: Академкнига, 2004. - Т.1. – 727 с., Т.2. – 582 с.
6. Вторичное использование полимерных материалов / Под ред. Е.Г. Любешкиной. — М.: Химия, 1985. — 192 с
7. Основы переработки пластмасс\ Гуль В.Е., Акутин М.С. — М.: Химия, 1985.-399 с.
8. Основы технологии переработки пластмасс / С.В. Власов, Э.В. Калинчев, Л.Б. Кандырин и др.: Учебник для вузов / Под ред. В.Н.Кулезнева, В.К.Гусева. М.: Химия, 1995. — 526 с.
9. Шварц, О. Переработка пластмасс / О. Шварц, Ф.В. Эбелинг, Б. Фурт; Под общ. ред. А.Д. Паниматченко. — СПб.: Профессия, 2005. – 320 с.
10. Карякина, М.И. Технология полимерных покрытий / М.И. Карякина, В.Е. Попцов. - М.: Химия, 1993. - 335 с.
Читайте также:

