Из чего состоят вещества кратко
Обновлено: 05.07.2024
Пример. Вода состоит из атомов водорода и кислорода в отношении 2:1. Графит и алмаз состоят из атомов углерода.
Атомы могут входить в состав веществ в незаряженном состоянии или в виде заряженных атомов (ионов).
Пример. Атомы аргона входят в состав аргона незаряженными, а атомы хлора и натрия в составе поваренной соли образуют ионы.
В состав многих веществ входят (и имеют очень важное значение для их свойств) свободные электроны.
Пример. В составе металлов электроны являются носителями заряда, а в составе особых ионных соединений (они называются электриды) электроны играют роль отрицательных ионов.
Строение веществ
В некоторых веществах соседние атомы объединены друг с другом в частицы, называемые молекулами. Связи между атомами в одной и той же молекуле гораздо прочнее, чем связи между атомами, входящими в соседние молекулы, поэтому молекулы способны к самостоятельному существованию при переходе вещества в различные агрегатные состояния и в растворах.
Пример. Вода, лёд, водяной пар состоят из молекул, а в графите, алмазе, аргоне молекул нет.
Все вещества состоят из атомов, но по своему строению все вещества делятся на вещества молекулярного и немолекулярного строения.
Общее название частиц, участвующих в строении вещества — структурные частицы. К структурным частицам относятся: молекулы, атомы, ионы, электроны.
Вещества молекулярного строения называются молекулярными веществами, а немолекулярного — немолекулярными веществами.
Молекулярные вещества — это вещества, мельчайшими структурными частицами которых являются молекулы.
Пример. Вода, кислород, водород, сахар — молекулярные вещества.
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы, ионы, электроны.
Пример: поваренная соль, перманганат калия (марганцовка) — немолекулярные вещества (состоят из ионов). Алмаз, аргон — немолекулярные вещества (состоят из атомов). Алюминий, медь — немолекулярные вещества (металлы) — состоят из положительных ионов и свободных электронов.

Силы и частицы
Вещества — скопления очень маленьких компонентов
Согласно решению Международного съезда химиков в 1860 году, атом — наименьшая частица, входящая в состав простого или сложного вещества. Молекула — система из ядер и электронов двух или более атомов. Частицы, незаметные невооруженным глазом, становятся различимыми только при сильном увеличении электронного микроскопа.
Атомы, изотопы
Атомы состоят из ядер и электронов. Первые заряжены положительно. Вблизи с огромной скоростью движутся отрицательно заряженные электроны. Ядра содержат элементарные частицы: протоны (положительные), нейтроны (отрицательные).
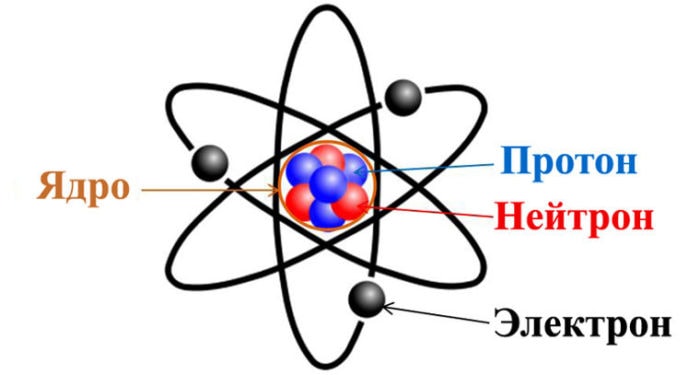
Строение атома
Все многообразие неорганических веществ, минералов, горных пород, изобилие органических соединений обусловлено:
- идентичностью частиц одного вещества;
- наличием разных структурных единиц (атомов, молекул, ионов);
- отличиями зарядов, масс и размеров видов атомов (химических элементов);
- способностью атомов и молекул терять или приобретать электроны, превращаясь в ионы — заряженные частицы;
- огромным количеством электронных конфигураций, кристаллических структур;
- различиями в энергетическом состоянии частиц.
Интересный факт: атомы Na, K, Ca, Cl опасны для жизни при попадании внутрь тела, ионы Na+, K+, Ca2+, Cl- безопасны и жизненно необходимы организму.
Особенности строения веществ
Вещества могут быть молекулярными и ионными. Газообразные водород, кислород, углекислый газ, азот, хлор, аммиак состоят из молекул небольшого размера с малой массой. Они имеют сравнительно низкие температуры плавления и кипения.
Интересный факт: знания о веществах имеют практический интерес для простых людей. Можно сэкономить на приобретении лекарств. В цену оригинальных лекарств заложены расходы на маркетинг (до 90% стоимости препаратов). Дженерики — дешевые аналоги оригинальных препаратов. Содержат одни и те же действующие вещества, а различия заключаются в производстве, компонентах, объеме клинических исследований.
Индивидуальные вещества и смеси
Интересный факт: при недостатке в продуктах питания химического элемента в виде иона или молекул человек не чувствует насыщения. Возникает подсознательное стремление восполнить существующий дефицит за счет других компонентов пищи, что нередко приводит к нарушению обмена, ожирению.
Вещества вокруг и внутри живых организмов многообразны, состоят из атомов, молекул, ионов. Видов частиц немного, однако они создают великое разнообразие простых и сложных соединений. Представлять, хотя бы в общем, из чего состоят вода, воздух, лекарства, продукты питания необходимо. Такие знания дают преимущества в жизни, помогают лучше ориентироваться в окружающем мире, обеспечить свою безопасность, выживание.
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Молекула состоит из атомов . Число атомов и их распределение в молекуле является различным. В природе существует немногим более сотни атомов различного вида. Элементы обобщены и расположены в периодической таблице химических элементов, им даны наименования, например: водород, азот, углерод.


В твёрдых веществах атомы или молекулы расположены близко друг к другу, и в результате их взаимодействия могут происходить только колебательные движения около определённой точки.

В твёрдых кристаллических веществах атомы расположены в определённом порядке и образуют кристаллическую решётку . Кристаллическим веществом является поваренная соль (атомы натрия — красного цвета, атомы хлора — синего).
В твёрдых аморфных веществах атомы расположены беспорядочно. Аморфными веществами являются смола, янтарь.
В жидкостях расстояние между молекулами больше, чем в твёрдых веществах, и движение молекул свободнее.
Молекулы газа находятся на больших расстояниях друг от друга. Поэтому взаимодействие молекул газа не учитывается. Пространство между молекулами позволяет сильно сжимать газы.

Газ не имеет своей формы. Газ заполняет весь предоставленный объём, легко смешивается с другими газами. Энергия газа заключена в скорости движения его молекул. Каждая молекула пролетает большое расстояние, прежде чем столкнётся с другой молекулой или стенкой сосуда. Если молекулы находятся на очень большом расстоянии, то силы между ними уже не действуют.
О том, что все тела состоят из отдельных частиц, когда-то задумался Демокрит, философ из Древней Греции. По его представлению, эти частицы между собой сцепляются, как пазлы и образуют материальные тела. Эти предположения ученые смогли подтвердить только в восемнадцатом веке. В настоящее время этот раздел физики хорошо изучен. Первоначальные сведения о строении вещества школьники получают в 7 классе.

Строение физических тел
На сегодняшний день есть научно доказанная теория о строении материи. Кратко основные положения по этому поводу таковы:
- Все физические тела состоят из вещества. Например, ножницы состоят из металла, стакан из стекла и т. д. Различаются они еще и своим состоянием, т. е. некоторые могут быть представлены в твердом, жидком и газообразном виде, например, вода. Лед — твердый вид воды, собственно вода — это жидкий вид и пар — газообразный. Все они имеют разные свойства.
- Все состоит из частиц. Между частицами есть расстояния, поэтому они могут сдвигаться относительно друг друга, при этом объем веществ увеличивается или уменьшается. Частицы, из которых состоят вещества очень малы, а значит твердые и жидкие тела выглядят сплошными.
Молекулы

Мельчайшую частицу вещества называют молекулой. Наименьшая частица воды или кислорода — молекулы воды или кислорода.
Ученые доказали, что молекулы одного и того же вещества одинаковы, т. е. лед, вода и водяной пар имеют одинаковый молекулярный состав.
Григорий Остер по этому поводу придумал вот такую загадку:
С разных концов медного провода длиной в тысячу километров парочка физиков отколупнула по одной молекуле меди. Чем отличаются эти молекулы?
И правильный ответ на этот вопрос — они ничем не отличаются. Они совершенно одинаковы, а еще они не статичны:
- Все молекулы постоянно находятся в движении. Скорость движения зависит от температуры вещества. Чем выше температура, тем быстрей их движение. В твердых материях амплитуда движения молекул гораздо меньше, чем у веществ в жидком и газообразном состоянии.
- Молекулы совершают колебательные движения, и твердый предмет сохраняет свою форму почти неизменной. А еще известно, что когда вещество нагревается, расстояния между его частицами увеличиваются, а при охлаждении уменьшаются. Соответственно, при изменении температуры некоторые предметы либо увеличивают свой объем, либо уменьшают. В качестве примера можно привести подъем столбика в медицинском ртутном термометре при увеличении температуры тела.
Атомы

Отчего же физики, зная о существовании атома, называют мельчайшей частицей молекулу? А все потому что в целом виде она может быть самостоятельной и с присущими лично ей химическими свойствами, а если ее разделить, эти свойства теряются.
Зачем все это знать

Зная о строении вещества, можно объяснить различные физические явления. Например, почему вода в чайнике выкипает и ее количество уменьшается? А потому что молекулы воды при нагреве испаряются, т. е. переходят в газообразное состояние. Именно поэтому их количество в чайнике постепенно уменьшается и, соответственно, уменьшается и объем воды. Почему снашивается и уменьшается подошва на ботинке? Потому что при трении о поверхность (асфальт, пол, песок и т. д. ) часть молекул остается там, а их количество в подошве становится меньше.
Первоначальные сведения о строении вещества в 7 классе изучаются подробно, что позволяет объяснять различные физические явления. Человечеству в целом это помогает создавать новые материалы с заданными нужными свойствами.
Читайте также:
- Какие простые правила следует соблюдать чтобы избежать травматизма кратко
- Как хранится текст в компьютере кратко
- Может ли работник обжаловать наложенное на него дисциплинарное взыскание кратко
- Почему война способствовала обострению противоречий в стране кратко
- Что такое кшу в гражданской обороне кратко

