Электролит что это кратко
Обновлено: 05.07.2024
Что такое электролиты — общие понятия
Электролиты — это вещества, которые могут проводить электрический ток после распада на ионы (или диссоциации). Это происходит в растворах и расплавах или, если электролит является твердым, — в кристаллических решетках. Примеры электролитов:
- кислоты. При диссоциации образуют ионы водорода, которые определяют общие свойства этого класса соединений. Пример уравнения диссоциации:
- соли. При их диссоциации образуется катион и анион кислотного остатка:
K 3 P O 4 → 3 K + + P O 43 -
- основания. Их общие свойства обусловлены наличием гидроксид-ионов OH-. Распадаются следующим образом:
- некоторые кристаллы ( A g I , Z r O 2 ) также обладают ионной проводимостью:
Для электролитов характерна сильно полярная ковалентная или ионная химическая связь. В противном случае вещество не способно распадаться на ионы в растворах и расплавах, вследствие чего они не проводят электрический ток. К неэлектролитам в химии относят вещества с ковалентной слабо полярной связью (в основном, это органические соединения, например, глицерин, сахароза и т.д.) и вещества с ковалентной неполярной связью (простые вещества неметаллы, например, водород, сера и т.д.)
Впервые теорию электролитической диссоциации (распада электролитов на ионы) предложил шведский физик и химик С. Аррениус. Он обнаружил, что в растворах, проводящих ток, содержится больше частиц и сделал вывод о том, что в растворах и расплавах эти виды веществ распадаются на ионы.
Наблюдая за движением частиц, ученый также установил, что они обладают различными зарядами. Так положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
Определение сильных и слабых, как распознать
Аррениус является автором теории электролитической диссоциации. Под этим понятием подразумевается процесс, при котором вещество распадается на отдельные ионы. Степень диссоциации зависит от характера электролита и вычисляется по формуле:
α = ( N д и с ) / ( N о б щ ) × 100 %
Краткий вид формулы:
α = ( N д и с ) / ( N о б щ )
- соли: N a H C O 3 → N a + + H C O 3 -
- сильные кислоты: H 2 S O 4 → H + + H S O 4 -
- сильные основания (щёлочи): K O H → K + + O H -
Электроли́т — химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Содержание
Степень диссоциации
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации [1] .
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты.
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот, основания p-, d-, и f-элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина "Электролит"
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., "всасывание электролитов" в кишечнике).
Электролиты в технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Электролит в электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
Электролит аккумуляторный
Обиходное название раствора серной кислоты для свинцовых аккумуляторов
Электролитический конденсатор
- при очень маленьких габаритныхразмерах обладают на несколько порядков большей ёмкостью
- при проектировании электрических схем и при монтаже электролитов необходимо соблюдать полярность подключения, в противном случае они обязательно взрываются (в худшем случае) или просто вздуваются и вытекают (в лучшем) [2]
- работают на существенно низких частотах, в пределах всего лишь нескольких десятков кГц, конденсаторы большинства других типов могут работать на частотах до десятков, сотен, тысяч мГц и выше.
Примечания
- ↑Степень дисссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
- ↑ Исключением являются специальные неполярные электролитические конденсаторы, которые представляют из себя два электролитических конденсатора в одном корпусе, включённые последовательно и обязательно встречной друг другу полярностью (плюс к плюсу или минус к минусу)
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Электролит (химия)" в других словарях:
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
Наводороживание ПТК при катодной поляризации (i=1500 А/м 2 , электролит: 250±5 г/л K2CO3 +35±3 г/л) — Толщина платинового покрытия, мкм Длительность катодной поляризации, ч Температура, °С Содержание H2, мл/100 г металла 2,7 45 … Химический справочник
Числа переноса катионов в водных растворах при 25 °С — Электролит Эквивалентная концентрация, моль/л 0 0,01 0,02 0,05 0,1 0,2 … Химический справочник
Электрохимия — Электрохимия раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и… … Википедия
КОЛЛОИДЫ — КОЛЛОИДЫ, КОЛЛОИДНАЯ ХИМИЯ. Коллоиды (от греч. ко 11а клей, желатина), название, данное Грэмом (Graham) группе веществ, типичными представителями которых являются желатина или гум ми арабик. Коллоидная химия является наиболее молодой хим.… … Большая медицинская энциклопедия
Тетрахлороаурат(III) водорода — Общие Т … Википедия
Цезий — 55 Ксенон ← Цезий → Барий … Википедия

Электролиты – вещества, расплавы или растворы которых проводят электрический ток. К электролитам относятся кислоты, основания и большинство солей.
Диссоциация электролитов
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. Первые в виде ионов существуют еще до перевода их в растворенное или расплавленное состояние. К электролитам относятся соли, основания, кислоты.
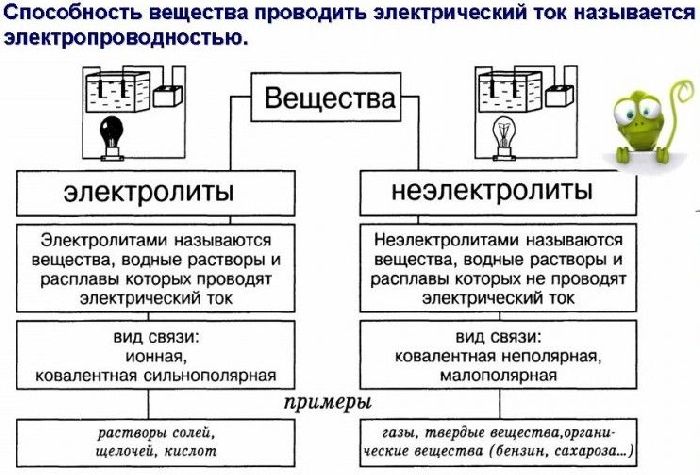
Рис. 1. Таблица отличие электролитов от неэлектролитов.
Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся: почти все растворимые соли, многие неорганические кислоты (например, H2SO4, HNO3, HCl), гидроксиды щелочных и щелочноземельных металлов. Слабые электролиты при растворении в воде незначительно диссоциируют на ионы. К ним относятся почти все органические кислоты, некоторые неорганические кислоты (например, H2CO3), многие гидроксиды (кроме гидроксидов щелочных и щелочноземельных металлов).
Рис. 2. Таблица сильные и слабые электролиты.
Вода также является слабым электролитом.
Как и другие химические реакции, электролитическую диссоциацию в растворах записывают в виде уравнений диссоциации. При этом для сильных электролитов рассматривают процесс как идущий необратимо, а для электролитов средней силы и слабых – как обратимый процесс.
Кислоты – это электролиты, диссоциация которых в водных растворах протекает с образованием ионов водорода в качестве катионов. Многоосновные кислоты диссоциируют ступенчато. Каждая следующая ступень идет все с большим и большим трудом, так как образующиеся ионы кислотных остатков являются более слабыми электролитами.
Основания – электролиты, диссоциирующие в водном растворе с образованием гидроксид-иона ОН- в качестве аниона. Образование гидроксид-иона является общим признаком оснований и обуславливает общие свойства сильных оснований: щелочной характер, горький вкус, мылкость на ощупь, реакцию на индикатор, нейтрализацию кислот и т. д.
Щелочи, даже малорастворимые (например, гидроксид бария Ba(OH)2) диссоциируют нацело, пример:
Соли – это электролиты, диссоциирующие в водном растворе с образованием катиона металла и кислотного остатка. Соли диссоциируют не ступенчато, а нацело:
Теория электролитической диссоциации
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов.
Теория электролитической диссоциации (С. Аррениус, 1887) в современном понимании включает следующие положения:
- электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные (катионы) и отрицательные (анионы). Ионизация происходит легче всего для соединений с ионной связью (солей, щелочей), которые при растворении (эндотермический процесс разрушения кристаллической решетки) образуют гидратированные ионы.
Гидратация ионов – экзотермический процесс. Соотношение затраты и выигрыша энергии определяет возможность ионизации в растворе. При растворении вещества с полярной ковалентной связью (например, хлороводород HCl) диполи воды ориентируются у соответствующих полюсов растворяемой молекулы, поляризую связь и превращая ее в ионную с последующей гидратацией ионов. Этот процесс является обратимым и может идти как полностью, так и частично.
- гидратированные ионы устойчивы, беспорядочно передвигаются в растворе. Под действием электрического тока движение приобретает направленный характер: катионы движутся к отрицательному поясу (катоду), а анионы – к положительному (аноду).
- диссоциация (ионизация) – обратимый процесс. Полнота ионизации зависит от природы электролита (соли щелочи диссоциируют практически нацело), его концентрации (с увеличением концентрации ионизация идет труднее), температуры (повышение температуры способствует диссоциации), природы растворителя (ионизация происходит только в полярном растворителе, в частности, в воде).
Что мы узнали?
Электролиты – это соли, кислоты, основания, способные проводить электрический ток. Электролиты бывают сильные и слабые. Также в статье приводится информация кратко о соединениях электролитов.
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно![Электролит щелочной]()
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
• Если электролит пролили, его собирают опилками, потом промывают нейтрализатором и вытирают насухо.

При работе с электролитом следует выполнять все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
Что такое электролит
Вещества, в которых электрический ток обусловлен движением ионов, то есть ионной проводимостью, называются электролитами. Электролиты относятся к проводникам второго рода, поскольку ток в них связан с химическими процессами, а не просто с движением электронов, как например в металлах.
Молекулы данных веществ в растворе способны к электролитической диссоциации, то есть они распадаются при растворении на положительно заряженные (катионы) и отрицательно заряженные (анионы) ионы. В природе можно встретить твердые электролиты, ионные расплавы и растворы электролитов. В зависимости от вида растворителя, электролиты бывают водные и неводные, а также особый вид - полиэлектролиты.

В зависимости от вида ионов, на которые распадается вещество при растворении в воде, можно выделить электролиты без ионов Н+ и ОН- (солевые электролиты), электролиты с обилием ионов Н+ (кислоты) и электролиты с преобладанием ионов ОН- (основания).

Если при диссоциации молекул электролита образуется равное число положительных и отрицательных ионов, такой электролит называется симметричным. Или же несимметричным, если количество положительных и отрицательных ионов в растворе не одинаково. Примеры симметричных электролитов — KCL-1,1-валентный электролит и CaSO4 – 2,2-валентный электролит. Представителем несимметричного электролита является, например, H2SO4 – 1,2-валентный электролит.

Все электролиты можно условно разделить на сильные и слабые, в зависимости от их способности к диссоциации. Сильные электролиты в разбавленных растворах почти полностью распадаются на ионы. К ним относится большое количество неорганических солей, некоторые кислоты и основания в водных растворах или растворителях с высокой диссоциирующей способностью, таких как спирты, кетоны или амиды.
Слабые электролиты распадаются лишь частично, и пребывают в динамическом равновесии с недиссоциированными молекулами. К ним относится большое количество органических кислот, а также многие основания в растворителях.
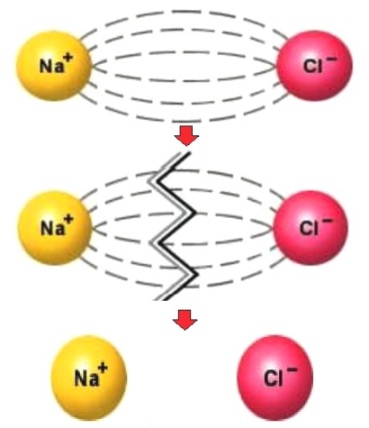
Степень диссоциации зависит от нескольких факторов: от температуры, от концентрации, от вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени.
Поскольку электролитическая диссоциация по определению порождает большее количество частиц в растворе, это приводит к значительным различиям в физических свойствах растворов электролитов и веществ иного рода: увеличивается осмотическое давление, изменяется температура замерзания по отношению к чистому растворителю и т. д.
Часто ионы электролита участвуют в электрохимических процессах и химических реакциях как самостоятельные кинетические единицы, независимо от других присутствующих в растворе ионов: на электродах, погруженных в электролит, при прохождении через электролит тока, протекают окислительно-восстановительные реакции, продукты которых добавляются в состав электролита.
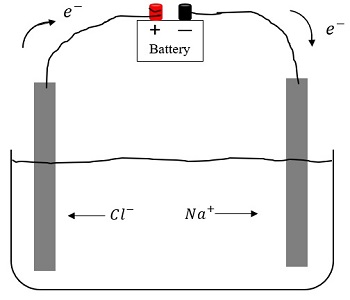
Таким образом, электролиты — это сложные системы веществ, включающие в себя ионы, молекулы растворителя, недиссоциированные молекулы растворенного вещества, ионные пары и более крупные соединения. И свойства электролитов определяются поэтому целым рядом факторов: характером ион-молекулярных и ион-ионных взаимодействий, изменением структуры растворителя при наличии растворенных частиц и т. д.
Ионы и молекулы полярных электролитов очень активно взаимодействуют друг с другом, что приводит к формированию сольватных структур, роль которых становится значительнее с уменьшением размеров ионов и с ростом их валентностей. Энергия сольватации является мерой взаимодействия ионов электролита с молекулами растворителя.

Электролиты, в зависимости от их концентрации, бывают: разбавленными растворами, переходными и концентрированными. Разбавленные растворы близки по структуре к чистому растворителю, но присутствующие ионы нарушают эту структуру своим влиянием. Такие слабые растворы сильных электролитов отличаются от идеальных растворов по свойствам в силу электростатического взаимодействия между ионами.
Переходная область концентрации характеризуется значительным изменением структуры растворителя из-за влияния ионов. При еще более высокой концентрации большинство молекул растворителя участвуют в сольватационных структурах с ионами, создавая таким образом дефицит растворителя.
Концентрированный же раствор имеет структуру близкую к ионному расплаву или кристаллосольвату, отличающуюся высокой упорядоченностью и единообразием ионных структур. Такие ионные структуры связываются друг с другом и с молекулами воды в ходе сложных взаимодействий.
Для электролитов характерны высокотемпературная и низкотемпературная области их свойств, а также области высоких и нормальных давлений. С ростом давления или температуры снижается молярная упорядоченность растворителя, слабеет влияние ассоциативных и сольватационных эффектов на свойства раствора. А когда температура падает ниже температуры плавления — некоторые электролиты переходят в стеклообразное состояние. Примером такого электролита может служить водный раствор LiCl.

Сегодня электролиты играют особую важную роль в мире техники и биологии. В биологических процессах электролиты выступают средой неорганического и органического синтеза, а в технике — основой электрохимических производств.
Электролиз, электрокатализ, коррозия металлов, электрокристаллизация — данные явления занимают важные места во многих современных производствах, особенно применительно к энергетике и защите окружающей среды.
Читайте также:


