Дайте определение понятию аллотропия как это явление объясняет многообразие простых веществ кратко
Обновлено: 05.07.2024
Из нашей статьи вы узнаете, что такое аллотропия. Это понятие широко распространено в природе. К примеру, кислород и озон - это вещества, состоящие только из химического элемента оксигена. Как это возможно? Давайте разбираться вместе.
Определение понятия
Аллотропией называют явление существования одного химического элемента в виде двух или более простых веществ. Его открывателем по праву считается химик и минеролог из Швеции Йенс Берцелиус. Аллотропия - это явление, которое имеет много общего с полиморфизмом кристаллов. Это вызвало долгие споры среди ученых. В настоящее время они пришли к мнению, что полиморфизм характерен только для твердых простых веществ.
Причины аллотропии
Образовывать несколько простых веществ могут не все химические элементы. Способность к аллотропии обусловлена строением атома. Чаще всего она встречается у элементов, имеющих переменное значение степени окисления. К ним относятся полу- и неметаллы, инертные газы и галогены.
Аллотропия может быть обусловлена несколькими причинами. К ним относится разное количество атомов, порядок их соединения в молекулу, параллельность спинов электронов, тип кристаллической решетки. Рассмотрим данные виды аллотропии на конкретных примерах.
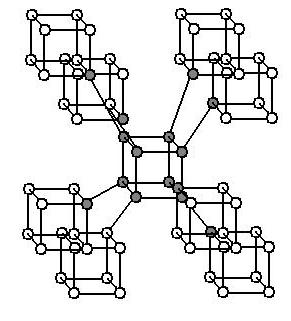
Кислород и озон
Данный вид аллотропии - пример того, как разное количество атомов одного химического элемента определяет физические и химические свойства вещества. Это касается и физиологического влияния на живые организмы. Так, кислород состоит из двух атомов оксигена, озон - из трех.
В чем же отличия этих веществ? Оба они газообразны. Кислород не имеет цвета, вкуса и запаха, он в полтора раза легче озона. Это вещество хорошо растворяется в воде, причем с понижением температуры скорость этого процесса только увеличивается. Кислород необходим всем организмам для дыхания. Поэтому это вещество является жизненно важным.
Озон имеет голубой цвет. Его характерный запах ощущал каждый из нас после дождя. Он резкий, но довольно приятный. По сравнению с кислородом, озон более химически активен. В чем же причина? При разложении озона образуется молекула кислорода и свободный атом оксигена. Он тут же вступает в реакции соединения, образуя новые вещества.
Удивительные свойства углерода
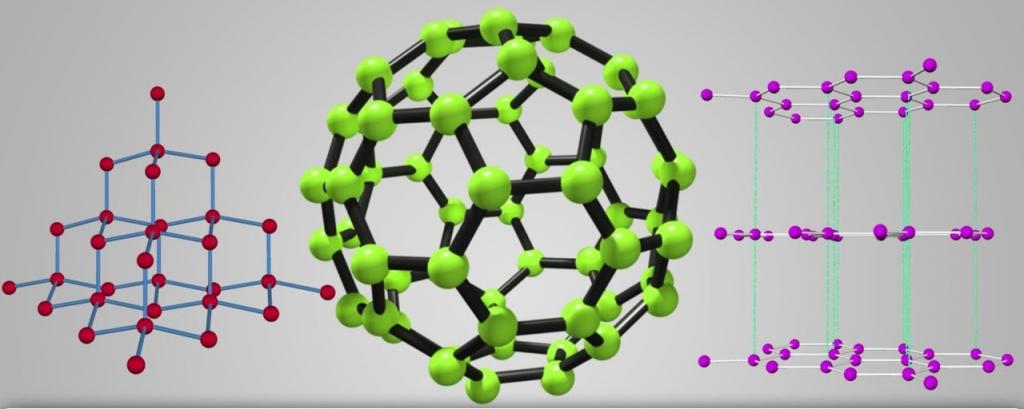
А вот количество атомов в молекуле углерода всегда остается неизменным. При этом он образует абсолютно разные вещества. Самыми распространенными модификациями углерода являются алмаз и графит. Первое вещество считается самым твердым на планете. Это свойство обусловлено тем, что атомы в алмазе связаны прочными ковалентными связями по всем направлениям. В совокупности они образуют трехмерную сеть из тетраэдров.

У графита прочные связи формируются только между атомами, расположенными в горизонтальной плоскости. По этой причине разломать графитовый стержень вдоль практически невозможно. А вот связи, которые соединяют горизонтальные слои углерода между собой, очень слабые. Поэтому каждый раз, когда мы проводим простым карандашом по бумаге, на ней остается серый след. Это и есть слой углерода.
Аллотропия серы
Причина модификаций серы также заключается в особенностях внутренней структуры молекул. Самой устойчивой формой является ромбическая. Кристаллы этого вида аллотропии серы называют ромбоидальными. Каждый из них образован коронообразными молекулами, в состав каждой из которой входит 8 атомов. По физическим свойствам ромбическая сера является твердым веществом желтого цвета. Она не только не растворяется в воде, но даже не смачивается ею. Показатели тепло- и электропроводности очень низкие.

Структура моноклинной серы представлена параллелепипедом со скошенными углами. Визуально это вещество напоминает иглы темно-желтого цвета. Если серу расплавить, а потом поместить в холодную воду, образуется ее новая модификация. Ее первоначальная структура разрушится до полимерных цепей разной длины. Так получают пластическую серу - резиноподобную массу коричневого цвета.
Модификации фосфора
Ученые насчитывают 11 видов фосфора. Его аллотропия была открыта практически случайно, как и само это вещество. В поисках философского камня алхимик Бранд получил светящуюся сухую субстанцию в результате выпаривания мочи. Это был белый фосфор. Данное вещество характеризуется большой химической активностью. Достаточно повышения температуры до 40 градусов, чтобы белый фосфор вступил в реакцию с кислородом и воспламенился.

Для фосфора причина аллотропии - это изменение в структуре кристаллической решетки. Изменить ее можно только при определенных условиях. Так, увеличив давление и температуру в атмосфере углекислого газа, получают красный фосфор. Химически он менее активен, поэтому для него не характерно свечение. При нагревании он превращается в пар. Мы наблюдаем это каждый раз, зажигая обычные спички. Терочная поверхность как раз содержит красный фосфор.
Итак, аллотропия - это существование одного химического элемента в виде нескольких простых веществ. Чаще всего встречается среди неметаллов. Основными причинами этого явления считаются разное количество атомов, образующих молекулу вещества, а также изменение конфигурации кристаллической решетки.
Химия изучает свойства и строение простых веществ. В большинстве своем они остаются неизменными в любых ситуациях. Однако есть ряд элементов, способных менять свои свойства в различных своих состояниях. Такое явление называется аллотропией. Знание о поведении элементов, подверженных аллотропии, расширяет понимание устройства мира и поведения в нем веществ и элементов.
Определение
Аллотропия - это возможность элемента трансформироваться в другой. В некоторых случаях даже в два или три. Если переводить название термина с греческого языка, то аллотропия - это "другое свойство". То есть буквальный перевод раскрывает сущность явления.
Виды аллотропии

Аллотропия, свойственная некоторым веществам, условно делится на два вида - по составу и по строению. В первом случае различно число атомов в молекуле. Во втором - строение кристаллической решетки.
В химии аллотропия - это изменение вещества независимо от того, жидкое оно, твердое или газообразное. Единственное отступление от терминологии появляется в работе с твердыми веществами, их строение сложнее, для их трансформации используется слово "полиморфизм", в переводе с греческого означающее "многообразный".
Каким веществам свойственна аллотропия
Не все вещества способны преобразоваться из сложных в простые даже под действием температур или других воздействий. Это может происходить только с теми из них, у которых есть способность к образованию гомоцепных структур или хорошо окисляющихся. Именно поэтому аллотропия веществ свойственна неметаллам. Хотя справедливости ради следует сказать, что есть металлы, способные преобразовываться в простые элементы, но это, скорее, полуметаллы.
Примеры аллотропии
Для понимания процесса существует ряд примеров преобразования вещества, причем оно бывает обратимым и необратимым. То есть вещество может после воздействия на него температуры или давления вернуться к первоначальному состоянию. Но бывает так, что оно остается в видоизмененном состоянии. Например, ромбическая сера - при нагревании ее до температуры 95,5 градуса по Цельсию она преобразуется в моноклинную форму. При снижении температуры до 95,5 градуса наступает обратное преобразование - из моноклинной формы в ромбическую.
Другой пример аллотропии - это изменение белого фосфора в черный. В данном случае для проведения преобразования требуется температура в 200 градусов по Цельсию и давление в 1,25 г Па. При воздействии тех же температур и давления на преобразованный черный фосфор он не сможет вернуться к первоначальному состоянию.
Как уже упоминалось, явление аллотропии свойственно и некоторым металлам. Но из-за сложности их структуры переходы из одного в другое состояние могут чередоваться. Например, в нормальных условиях белое олово является пластичным металлом, но при нагревании его при температуре 173 градуса по Цельсию оно перестраивает свою кристаллическую решетку до очень хрупкого состояния, а при снижении температуры до 13 градусов кристаллическая решетка принимает вид кубической алмазоподобной и делает вещество порошкообразным.
Модификации неметаллов

Самыми яркими и многообразными физическими свойствами аллотропии обладает углерод. Он способен перерождаться в самое большое количество аллотропных форм, причем с различными не только свойствами, но и строением кристаллической решетки. Взять, например, графит и алмаз. Формы одного вещества, но с разными строениями кристаллических решеток – графит чуть плотнее порошка, а алмаз - самое крепкое вещество на земле. И это уже не говоря об углеродных нанотрубках, лонсдейлите, фуллерене, карбине и других формах углерода.
Аллотропия характерна для серы. В нормальных условиях структура вещества моноклинная, а под воздействием температур может преобразоваться в пластическую и следом за этим в ромбовидную.
Фосфор способен изменяться в 11 форм. Причем 3 из них - белый, черный, красный - даже встречаются в природе, остальные можно получить искусственным путем. Отличается одна форма вещества от другой количеством атомов в молекуле. Различными цветами в химии представлен селен. Он также бывает серный, черный и красный.
Очень известная аллотропия - это кислород. Он видоизменяется до озона под действием температуры или электрического тока. Известный пример природного воздействия – молния. Во время разряда электрического поля кислород превращается в озон.
Модификации полуметаллов

Бор - это полуметалл, встречающийся в природе в аморфной и кристаллической форме. Но у него есть еще 10 известных науке форм.
Аморфным и кристаллическим бывает кремний. Сурьма в четырех формах по своей структуре представляется металлом, и в трех она аморфная, аллотропная.
Как и в случае с фосфором или селеном, мышьяк бывает серый или черный, в зависимости от формы – полимер или неметаллическая структура.
Модификации металлов

Самым широким спектром форм среди металлов обладает железо. В первом виде феррита, с характерной объемно-центрированной кубической кристаллической решеткой, железо способно существовать в температурных пределах от 0 до 769 градусов по Цельсию. Имеет свойства ферромагнетиков.
Второй тип феррита существует при температурах в диапазоне 769-917 градусов по Цельсию. Отличается объемно-центрированной кубической кристаллической решеткой. Магнетические свойства проявляет как парамагнетик.
Третий тип железа называется аустенит, характерен гранецентрированной кубической кристаллической решеткой. Способен существовать только при температурах от 917 до 1394 градусов по Цельсию. Магнитных свойств не имеет.
Четвертый тип железа возникает при температурах свыше 1397 градусов по Цельсию. Магнитных свойств не имеет, характерен объемно-центрированной кубической кристаллической решеткой.
Другой металл, имеющий несколько типов преобразования, - это олово. В аллотропной форме может существовать в виде порошка с кристаллической решеткой, подобной алмазной. Это так называемое серое олово. Есть и более привычная форма металла – белое олово. Оно встречается в виде пластичного метала серебряного цвета. Третья форма характерна тугоплавкостью, так как обладает ромбической кристаллической решеткой, называется она гамма-оловом.
Заключение

Все металлы, полуметаллы и неметаллы различных аллотропных типов с характерным строением кристаллических решеток, массой, количеством и зарядом протонов и нейтронов могут встречаться в природе в чистом, натуральном виде или получаются только в лаборатории. В обычных условиях они не сохраняют своей стабильности. Все это говорит о многообразии химических элементов и перспективах открытий новых доселе неизвестных науке форм и типов веществ. Такие исследования ведут к развитию всех отраслей жизнедеятельности человека.
FOR-DLE.ru - Всё для твоего DLE ;)
Привет, я Стас ! Я занимаюсь так называемой "вёрсткой" шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и "статейки" для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2019 §5 АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
Задание 2
На какие типы делятся вещества по элементному составу?
Делятся на простые и сложные вещества, а простые вещества в свою очередь ― на металлы и неметаллы.
Задание 3
Что такое ион? Ионы — это положительно или отрицательно заряженные частицы, которые образуются из атомов или групп атомов.
Сформулируйте первое положение атомно-молекулярного учения с учётом этого понятия.
Вещества состоят из молекул, которые находятся в непрерывном движении. Молекулы – мельчайшие частицы вещества, состоящие из атомов или ионов. Молекулы определяют химические свойства вещества.
Задание 4
Как можно объяснить тот факт, что известно 118 химических элементов, а природные вещества образованы только 90 элементами? Оставшиеся элементы являются радиоактивными, мало распространены в природе, очень неустойчивы, существуют долю секунды или синтезированы искусственно.
Задание 5
Вспомните с курса физики, что такое броуновское движение и диффузия.
Беспорядочное движение частиц вещества, взвешенных в жидкости или газе, которое происходит под влиянием соударений этих частиц с молекулами окружающей среды, называется броуновским движением.
Диффузия — это самопроизвольное распространение молекул одного вещества между молекулами другого.
Объясните, как эти явления доказывают реальность существования молекул и иллюстрируют положения атомно-молекулярного учения.
Движение частиц акварельной краски в нескольких каплях воды является броуновским движением и есть доказательством существования молекул и их постоянного движения. О наличии молекул можно судить по ударам, которые они производят, заставляя частицы краски двигаться.
Распространение запаха, распыленного дезодоранта в помещении, или исчезновение хорошо заметных невооружённым глазом малиновых разводов при растворении несколько кристалликов перманганата калия (марганцовки) и получение со временем совершенно однородного раствора являются примерами диффузии газообразных и жидких веществ ― доказательством наличия частиц вещества и их постоянного движения.
Задание 6
Объясните многообразие простых и сложных веществ.
Атомы химических элементов соединяются между собой в самых разнообразных сочетаниях и количественных соотношениях. Очевидно, что таких сочетаний образуется значительно больше из атомов различных химических элементов сложного вещества, чем из атомов одного химического элемента простого вещества.
На данной странице представлено детальное решение задания 5 Атомно-молекулярное учение по химии для учеников 8 классa автор(ы) Минченков Е.Е.
Аллотропия – способность одного химического элемента образовывать несколько простых веществ. Аллотропия объясняет многообразие простых веществ тем, что атомы одного химического элемента могут соединяться в разные молекулы или кристаллы.
Вещества по элементарному составу делятся на простые (состоят из одного химического элемента) и сложные вещества (состоят из двух и более химических элементов).
Ион – это положительно или отрицательно заряженная частица, которая образуются из атомов или групп атомов.
Тогда первое положение атомно-молекулярного учения можно дополнить:
Вещества состоят из молекул, атомов или ионов, которые находятся в непрерывном движении.
Природные вещества образованы только 90 элементами из 118, поскольку другие элементы открыли искусственно с помощью радиоактивных реакций, и данные элементы не встречаются в природе.
Процесс диффузии, объясняется способностью молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении (броуновское движение) и между ними имеются промежутки.

Многообразие простых и сложных веществ объясняется способностью атомов одного или разных химических элементов соединятся в разные молекулы.
Ломоносов развил и обосновал учение о материальных атомах и корпускулах. Он приписывал атомам не только неделимость, но и активное начало — способность к движению и взаимодействию.
Учения и мысли М. В. Ломоносова:
Тела в природе состоят из корпускул (молекул), в состав которых входят неделимые элементы (атомы).
Многообразие веществ объяснено соединением разных атомов в молекулах и различным расположением атомов в них.
Некоторые молекулы могут состоять из одинаковых атомов.
Учения и мысли Дж. Дальтона (развивал теорию после Ломоносова).
Сформулировал: Все вещества состоят из атомов, мельчайших неделимых частиц, которые не могут быть ни созданы, ни уничтожены. Ввёл понятие атомного веса.
Считал, что все атомы одного итого же элемента совершенно идентичны, например, имеют одинаковые массы.
На основе химических законов (закон кратных отношений, закон эквивалентов и закон постоянства состава) создал атомистическую теорию, основанную на количественных соотношениях, возникающих при взаимодействии между химическими элементами.
Озоновый слой исполняет несколько функций:
нейтрализация углекислого газа;
отражение космического и частично ультрафиолетового излучения;
температурная регуляция поверхности Земли.
Озоновый слой поглощает вредное солнечное излучение, а также опасный ультрафиолет, оберегая живые организмы от контакта с солнечной радиацией. Таким образом, озоновый слой уберегает растительность от ее полного выжигания солнцем, а животных - от лучевой болезни и рака кожи. Озон пропускает видимый свет, почти не поглощая его, таким образом растения получают необходимый им для фотосинтеза ультрафиолет. Благодаря поглощению озоном солнечных лучей, температура возрастает с увеличением высоты. Таким образом, делая затруднительным смешивание газов тропосферы и стратосферы с атмосферой. Другими словами, вода в виде пара и другие газы нашей атмосферы не улетают в космос. Для обеспечения экологической безопасности необходимо принимать меры по защите озонового слоя, нужно снижать выбросы вредных веществ в атмосферу, ведь если исчезнет озоновый слой -исчезнет и жизнь на Земле.
Читайте также:
- Прошел ли обломов претрудную школу жизни почему
- Что общего имеют и чем различаются склоняемые части речи кратко
- Проект чистота залог здоровья во второй младшей группе детского сада
- Рассказ почему саша опоздал в школу
- Как влияют различные метеорологические параметры на теплообмен человека с окружающей средой кратко

