Что такое углерод в биологии 6 класс определение кратко
Обновлено: 01.06.2024
Что такое хроматида, углерод, азот, эндосперм, гормон, система органов, рост. Зараннее спасибо, только не слишком замудренные ответы, потому что 6 класс многие понятия не изучали.
1)Хроматидой называют структурный элемент хромосомы, формирующийся в интерфазе ядра клетки в результате удвоения хромосом.
это понятие используется, пока центромеры остаются в контакте. после разделения хромосом в ходе анафазы митоза или мейоза нити называют дочерними хромосомами.
2)Углерод - Химический элемент, важнейшая составная часть всех органических веществ в природе.
3) Азот - Химический элемент, газ без цвета и запаха, составляющий основную часть воздуха и являющийся одним из главных элементов питания растений.
4) Эндосперм - (от эндо. и греч. sperma - семя) - запасающая ткань семенирастений, в которой откладываются питательные вещества, необходимые дляразвития зародыша. Хорошо развит у злаков, пасленовых, зонтичных инекоторых других растений.
5) Гормон - Биологически активное вещество, вырабатываемое специальными органами или клетками в одной части организма и регулирующее деятельность органов и тканей в других частях организма.
6). Увеличение организма или отдельного органа в процессе развития. // перен. Совершенствование в процессе развития, качественное улучшение.
7) 1 орган + 1 орган + 1 орган. = система органов.
Система органов - это неделимая, неразрывная совокупность частей организма, выполняющая связь с другими органами и одну определённую функцию.
Допустим выделительная система: почки + мочеточника + мочевой пузырь = выделительная система. Система органов-совокупность органов одинаковой или сходной функции.
1)Хроматидой называют структурный элемент хромосомы, формирующийся в интерфазе ядра клетки в результате удвоения хромосом.
это понятие используется, пока центромеры остаются в контакте. после разделения хромосом в ходе анафазы митоза или мейоза нити называют дочерними хромосомами.
2)Углерод - Химический элемент, важнейшая составная часть всех органических веществ в природе.
3) Азот - Химический элемент, газ без цвета и запаха, составляющий основную часть воздуха и являющийся одним из главных элементов питания растений.
4) Эндосперм - (от эндо. и греч. sperma - семя) - запасающая ткань семенирастений, в которой откладываются питательные вещества, необходимые дляразвития зародыша. Хорошо развит у злаков, пасленовых, зонтичных инекоторых других растений.
5) Гормон - Биологически активное вещество, вырабатываемое специальными органами или клетками в одной части организма и регулирующее деятельность органов и тканей в других частях организма.
6). Увеличение организма или отдельного органа в процессе развития. // перен. Совершенствование в процессе развития, качественное улучшение.
7) 1 орган + 1 орган + 1 орган. = система органов.
Система органов - это неделимая, неразрывная совокупность частей организма, выполняющая связь с другими органами и одну определённую функцию.
Допустим выделительная система: почки + мочеточника + мочевой пузырь = выделительная система. Система органов-совокупность органов одинаковой или сходной функции.

УГЛЕРО́Д, -а, м. Химический элемент, важнейшая составная часть всех органических веществ в природе.
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
- Углеро́д (химический символ — C; лат. Carboneum) — химический элемент четырнадцатой группы (по устаревшей классификации — главной подгруппы четвёртой группы), 2-го периода периодической системы химических элементов. Порядковый номер 6, атомная масса — 12,0107.
УГЛЕРО'Д, а, м. (хим.). Химический элемент, являющийся важнейшей составной частью всех органических веществ в природе.
углеро́д
2. исч. хим. жарг. атом углерода [1]
Фразеологизмы и устойчивые сочетания
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов. Я отлично умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова эластик (существительное):
Ассоциации к слову «углерод»
Синонимы к слову «углерод»
Предложения со словом «углерод»
- Он знал, разумеется, что молекула двуокиси углерода поглощает энергию в инфракрасном диапазоне и что человечество выпускает эти молекулы в атмосферу в нарастающих количествах.
- Пальховский объявлял, что труд женщины, по законам природы, должен ограничиваться рождением детей; как г. Куторга (натуралист) относил углерод к числу газов; как г. Берви утверждал, что иногда часть бывает равна своему целому, и пр. и пр.
Сочетаемость слова «углерод»
Окси́ды углеро́да — бинарные химические соединения (оксиды) углерода с кислородом. Кроме двух неорганических представителей - угарного газа и углекислого газа, все остальные оксиды углерода относят к органическим соединениям.
Моноокси́д углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO.
Углеро́д (C, лат. carboneum) — химический элемент, символизируемый буквой C и имеющий атомный номер 6. Элемент является четырехвалентным неметаллом, т. е. имеет четыре свободных электрона для формирования ковалентных химических связей. Он располагается в 14 группе периодической системы. Три изотопа данного элемента встречаются в окружающем нас мире. Изотопы 12C и 13C являются стабильными, в то время как 14C- радиоактивный (период полураспада данного изотопа составляет 5,730 лет). Углерод был известен.

В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
О чем эта статья:
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s 2 2s 2 2р 2 .

Возможные валентности: II, IV.
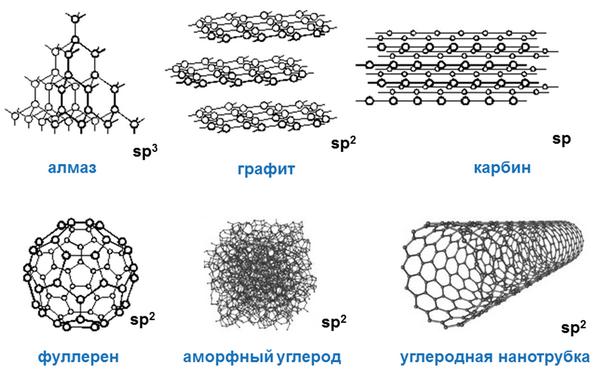
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода

Нахождение углерода в природе
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.

Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12 С (98,892%) и 13 С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14 С с периодом полураспада 5,73*10 3 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s 2 2s 2 2p 2 . Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
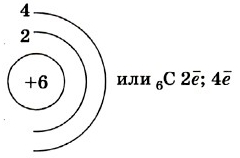
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C 0 + O2 – t° = CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C 0 + O2 – t° = 2C +2 O угарный газ
— с водяным паром
C 0 + H2O – 1200° = С +2 O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C 0 + 2CuO – t° = 2Cu + C +4 O2
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
Ca + 2C 0 = CaC2 -4
Вступая в реакцию с водородом, углерод образует метан:
Роль в природе
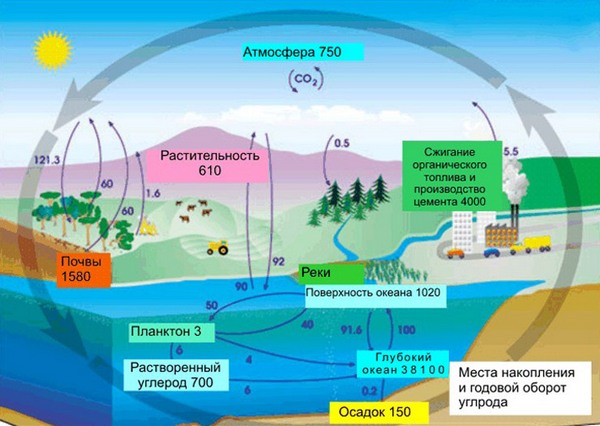
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
Применение
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
Читайте также:

