Что такое связь кратко
Обновлено: 02.07.2024
В словаре Ефремовой
- Взаимные отношениямежду кем-л ., чем-либо
- Общность, взаимопонимание, внутреннее единство.
- Общение с кем-л .
- Любовные отношения, сожительство.
- Соединение, скрепление чего-л .
- Сцепление, взаимное притяжение (молекул, атомов, электронов и т.п.).
- NH4 + - в ионе аммония
- NH4 + Cl, NH4 + Br - внутри иона аммония во всех его солях
- NO3 - - в нитрат ионе
- KNO3, LiNO3 - внутри нитрат иона во всех нитратах
- O3 - озон
- H3O + - ион гидроксония
- CO - угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] - во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
В словаре Д.Н. Ушакова
В словаре Синонимов
В словаре Энциклопедии
В словаре Синонимов 2
сущ1.2. касательство, отношение
В словаре Синонимов 3
Сцепление, соединительное звено.
Сцепление мыслей, понятий - ассоциация идей. См. союз..
влиятельная связь.
В словаре Синонимы 4
География. Современная иллюстрированная энциклопедия. — М.: Росмэн . Под редакцией проф. А. П. Горкина . 2006 .
Полезное
Смотреть что такое "связь" в других словарях:
связь — связь, и … Русский орфографический словарь
СВЯЗЬ — СВЯЗЬ, связи, о связи, в связи и (с кем чем нибудь быть) в связи, жен. 1. То, что связывает, соединяет что нибудь с чем нибудь; отношение, создающее что нибудь общее между чем нибудь, взаимную зависимость, обусловленность. «…Связь науки и… … Толковый словарь Ушакова
связь — и, предл. о связи, в связи и в связи; ж. 1. Отношение взаимной зависимости, обусловленности. Прямая, косвенная, логическая, органическая, причинная с. С. фактов, явлений, событий. С. между промышленностью и сельским хозяйством. С. науки и… … Энциклопедический словарь
Связь — Связь отношение общности, соединения или согласованности. Связь возможность передачи информации на расстоянии (в том числе: радиорелейная связь, сотовая связь, спутниковая связь и другие виды). Химическая связь соединение атомов … Википедия
связь — Сцепление, соединительное звено. Сцепление мыслей, понятий ассоциация идей. См. союз.. влиятельная связь. Словарь русских синонимов и сходных по смыслу выражений. под. ред. Н. Абрамова, М.: Русские словари, 1999. связь логичность, связность,… … Словарь синонимов
связь — сущ., ж., употр. часто Морфология: (нет) чего? связи, чему? связи, (вижу) что? связь, чем? связью, о чём? о связи; мн. что? связи, (нет) чего? связей, чему? связям, (вижу) что? связи, чем? связями, о чём? о связях 1. Связью называют отношения… … Толковый словарь Дмитриева
СВЯЗЬ — в философии взаимообусловленность существования явлений, разделенных в пространстве и во времени. связи классифицируют по объектам познания, по формам детерминизма (однозначные, вероятностные и корреляционные), по их силе (жесткие и… … Большой Энциклопедический словарь
СВЯЗЬ — в психологии тот факт, что раздражения, воспринимаемые органами чувств, образуют основу восприятий, в которых между частями воспринимаемого существует связь, благодаря чему получается некое целостное образование, а не отдельные восприятия,… … Философская энциклопедия
Связь — в диаграммах сущность связь идентификатор требований, в соответствии с которыми сущность вовлекается в отношение. Каждая связь соединяет сущность и отношение и может быть направлена только от отношения к сущности. См. также: Диаграммы сущность… … Финансовый словарь
связь — передача и приём информации с помощью различных технических средств. С древних времён люди нуждались в общении, и обмен информацией был присущ им всегда, со временем совершенствовались лишь способы хранения и передачи информации. Вначале связь… … Энциклопедия техники

Какая сила удерживает вместе атомы в молекуле вещества и почему они не разбегаются в разные стороны? Эта сила называется химической связью, школьники узнают о ней в 8 классе. Еще Ньютон предположил, что она имеет электростатическую природу, но подробнее в этом разобрались лишь в начале ХХ века. Сейчас расскажем, что такое химическая связь и какой она бывает.
О чем эта статья:
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.

Основные типы химических связей
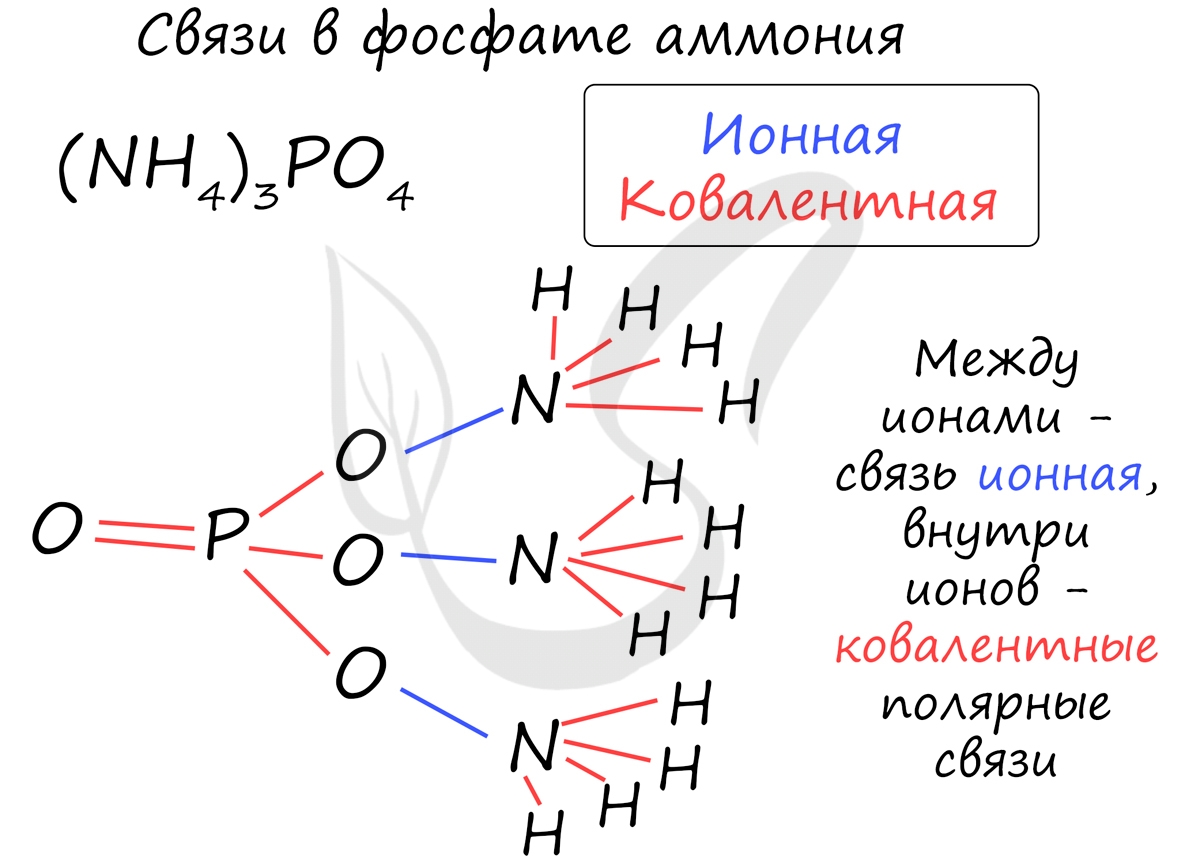
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.

Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.

Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.

Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:

Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.

Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
не имеет направленности.

Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
Металлическая связь
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.

Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:

M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:

Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.

Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.

В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
Характеристики водородной связи:

Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
В широком значении слово связь означает любые взаимоотношения или контакт, установленный между двумя объектами. В технической сфере с помощью установленной связи можно передавать информацию на расстоянии.
Для предприятий туриндустрии телефонная связь является самым распространенным и широко применяемым видом связи. Она используется не только для оперативного административного управления предприятиями, но и для ведения финансово-хозяйственной деятельности. Например, по телефону можно забронировать номер в гостинице, получить информацию об интересующем туриста маршруте или турпакете.
В зависимости от способа использования телефонную связь можно разделить на два вида:
- общего пользования (городская, междугородная, международная);
- офисную (внутренняя) связь, используемую в пределах одной организации.
Компьютерной телефонией называется технология, в которой компьютер играет главную роль как в управлении телефонным соединением, так и в осуществлении приема и передачи телефонных звонков.
Использование компьютерной телефонии намного ускоряет процесс управления на предприятии, повышая его эффективность и качество при общем снижении совокупных затрат. Особенно это относится к предприятиям туриндустрии, для которых телефон является одним из необходимых инструментов функционирования. Современные компьютерные технологии позволяют значительно снизить затраты на междугородные, а тем более международные переговоры, без которых не обходится ни одно предприятие турбизнеса. Связь с партнерами осуществляется по компьютерным сетям, в частности по сети Интернет. Такая связь называется IP-телефония.
Под радиотелефонной связью понимают беспроводные системы телефонной связи, которые не требуют проведения сложных инженерных работ по прокладке дорогостоящих телекоммуникаций и поддержке их в рабочем состоянии.
Связь может быть организована быстро и независимо от рельефа местности и погодных условий (хотя погодные условия и рельеф местности могут оказывать непосредственное влияние на качество связи).
На современном этапе развития техники и технологии радиотелефонная связь становится альтернативой использования проводной телефонии и значительно повышает оперативность в принятии управленческих решений и общую эффективность функционирования предприятий туриндустрии.
Появление сотовой связи было связано с необходимостью создания широкой сети подвижной радиотелефонной связи в условиях достаточно жесткого ограничения на доступные полосы частот.
В настоящий момент сотовая связь используется более чем в 140 странах мира на всех континентах земного шара. Россия тоже вошла в число стран, использующих сотовую связь. В России сотовая связь начала внедряться с 1990 г., ас 1991 г. началось ее коммерческое использование. В настоящий момент в России насчитывается около 188 миллионов абонентов (на конец 2009 г. — 188 млн.).
Несмотря на то, что сотовая связь существует около 30 лет, можно выделить три периода ее развития, которые определяются не только количественными характеристиками, но и качественными изменениями. Такое разделение осуществляется с достаточной степенью условности, но тем не менее можно выделить три поколения систем сотовой связи:
универсальные системы (системы будущего).
К первому поколению сотовой связи, или стандартам, относятся аналоговые системы, которые в настоящее время заменяются на цифровые системы.
Для дальнейшего развития и распространения сотовой связи шел поиск и велась разработка более совершенных технических решений, что привело к появлению на свет цифровых сотовых систем — систем второго поколения на основе стандарта GSM. В цифровых системах сигналы передаются в цифровом коде. Цифровая обработка сигналов обеспечила возможность совершенствования методов множественного доступа, увеличения емкости системы, улучшения качества связи.

В широком значении слово связь означает любые взаимоотношения или контакт, установленный между двумя объектами. В технической сфере с помощью установленной связи можно передавать информацию на расстоянии.
Для предприятий туриндустрии телефонная связь является самым распространенным и широко применяемым видом связи. Она используется не только для оперативного административного управления предприятиями, но и для ведения финансово-хозяйственной деятельности. Например, по телефону можно забронировать номер в гостинице, получить информацию об интересующем туриста маршруте или турпакете.
В зависимости от способа использования телефонную связь можно разделить на два вида:
- общего пользования (городская, междугородная, международная);
- офисную (внутренняя) связь, используемую в пределах одной организации.
Компьютерной телефонией называется технология, в которой компьютер играет главную роль как в управлении телефонным соединением, так и в осуществлении приема и передачи телефонных звонков.
Использование компьютерной телефонии намного ускоряет процесс управления на предприятии, повышая его эффективность и качество при общем снижении совокупных затрат. Особенно это относится к предприятиям туриндустрии, для которых телефон является одним из необходимых инструментов функционирования. Современные компьютерные технологии позволяют значительно снизить затраты на междугородные, а тем более международные переговоры, без которых не обходится ни одно предприятие турбизнеса. Связь с партнерами осуществляется по компьютерным сетям, в частности по сети Интернет. Такая связь называется IP-телефония.
Под радиотелефонной связью понимают беспроводные системы телефонной связи, которые не требуют проведения сложных инженерных работ по прокладке дорогостоящих телекоммуникаций и поддержке их в рабочем состоянии.
Связь может быть организована быстро и независимо от рельефа местности и погодных условий (хотя погодные условия и рельеф местности могут оказывать непосредственное влияние на качество связи).
На современном этапе развития техники и технологии радиотелефонная связь становится альтернативой использования проводной телефонии и значительно повышает оперативность в принятии управленческих решений и общую эффективность функционирования предприятий туриндустрии.
Появление сотовой связи было связано с необходимостью создания широкой сети подвижной радиотелефонной связи в условиях достаточно жесткого ограничения на доступные полосы частот.
В настоящий момент сотовая связь используется более чем в 140 странах мира на всех континентах земного шара. Россия тоже вошла в число стран, использующих сотовую связь. В России сотовая связь начала внедряться с 1990 г., ас 1991 г. началось ее коммерческое использование. В настоящий момент в России насчитывается около 188 миллионов абонентов (на конец 2009 г. — 188 млн.).
Несмотря на то, что сотовая связь существует около 30 лет, можно выделить три периода ее развития, которые определяются не только количественными характеристиками, но и качественными изменениями. Такое разделение осуществляется с достаточной степенью условности, но тем не менее можно выделить три поколения систем сотовой связи:
универсальные системы (системы будущего).
К первому поколению сотовой связи, или стандартам, относятся аналоговые системы, которые в настоящее время заменяются на цифровые системы.
Для дальнейшего развития и распространения сотовой связи шел поиск и велась разработка более совершенных технических решений, что привело к появлению на свет цифровых сотовых систем — систем второго поколения на основе стандарта GSM. В цифровых системах сигналы передаются в цифровом коде. Цифровая обработка сигналов обеспечила возможность совершенствования методов множественного доступа, увеличения емкости системы, улучшения качества связи.
Химическая связь - связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.

Ковалентная связь ( лат. со - совместно + valens - имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет "полюса" - электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется "полюс" - электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.

Ковалентная связь может быть образована по обменному механизму - обобществлению электронной пары. В таком случае каждый атом "одинаково" вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
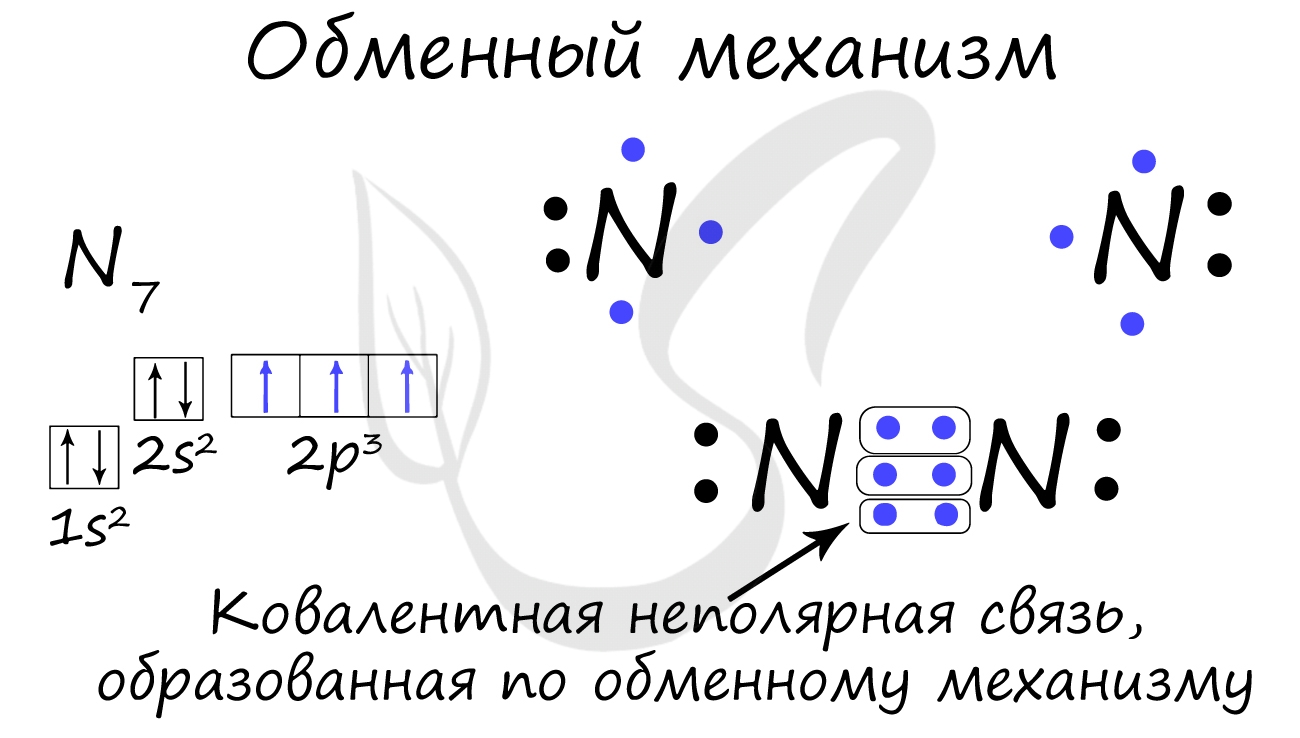
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
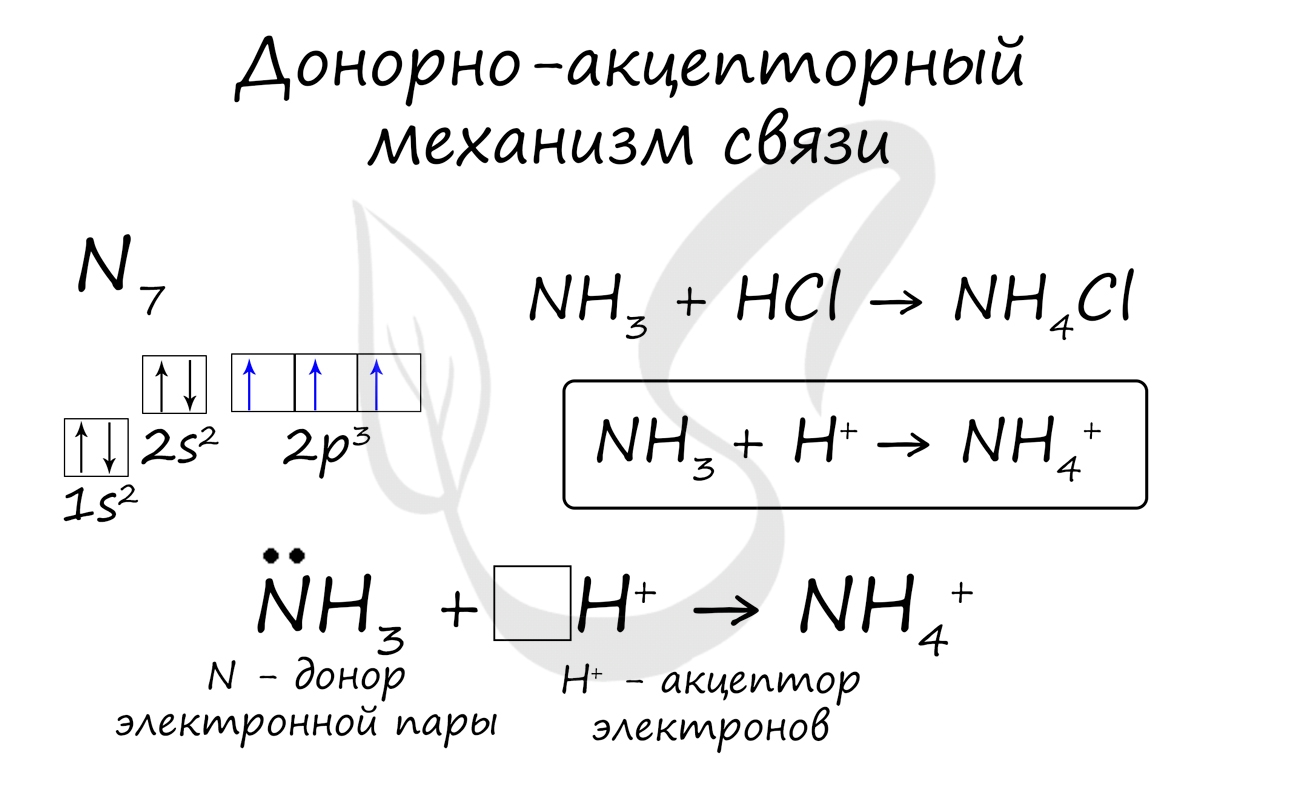
Ионная связь
Ионная связь - один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа". По природе металлическая связь близка к ковалентной.
"Облако" электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь
Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи - это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).

Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

