Что такое изомеры и гомологи кратко
Обновлено: 05.07.2024
Гомологи — вещества, имеющие сходное строение и свойства, но различающиеся по составу на одну или несколько групп CH 2 .
Изомеры могут различаться порядком соединения атомов в молекуле (химическим строением) или расположением атомов в пространстве. Поэтому различают структурную и пространственную изомерию.
Этот вид изомерии может быть обусловлен разным строением углеродного скелета, положением кратных связей или функциональных групп. Также есть межклассовая изомерия.
По расположению атомов в пространстве выделяют оптическую (энантиомерию) и геометрическую (цис-транс) изомерию.
Оптические изомеры являются зеркальным отражением друг друга. Оптические изомеры существуют в том случае, если в молекуле есть хотя бы один атом углерода, связанный с четырьмя разными группами. Такой атом называют оптически активным.
Геометрические изомеры отличаются расположением групп атомов относительно двойной связи: у цис-изомеров одинаковые группы атомов находятся с одной стороны, а у транс-изомеров — по разные стороны от двойной связи C = C . Этот вид изомерии возможен, если каждый из атомов, соединённых двойной связью, связан с разными атомами или группами атомов.
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.

Темы, которые нужно знать:
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
- Одинаковая общая формула (на примере алканов — (СnH2n+2) и
- Схожие химические свойства, которые определяются одинаковым строением веществ.
- Гомологи отличаются друг от друга на одну или несколько -CH2— групп
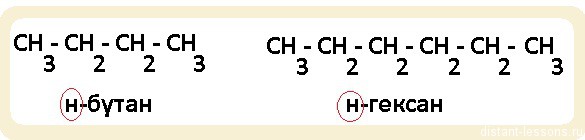
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
- Межклассовая изомерия — характерна для соединений, имеющих одинаковую общую формулу, но принадлежащих к разным классам (и следовательно, иемющим разные химические и физические свойства)
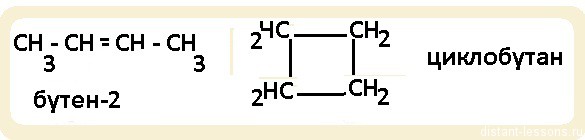
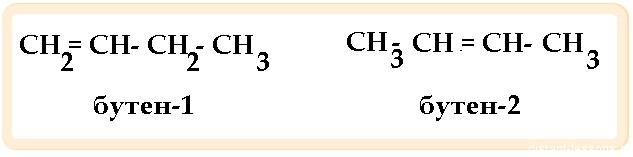
- Изомерия положения кратной связи — вид изомерии, характерный для соединений с количеством атомов углерода больше 3-х и имеющих двойные или тройные связи:
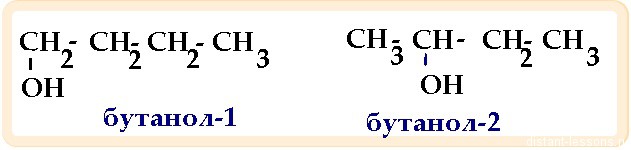
- Изомерия положения функциональной группы -вид изомерии, характерный для кислород- и азотсодержащих органических соединений:
- Пространственная изомерия — в школьном курсе подготовки к ЕГЭ рассматривают пространственную цис-транс-изомерию алкенов. Этот вид изомерии характерен для симметричных относительно двойной связи алкенов:

Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
- В углеводородах эта связь — ковалентная малополярная;
- В кислород-, азот- и серасодержащих органических соединениях — ковалентная полярная;
- В случаях алкоголятов или солей органических кислот — ионная (CH3COONa например).
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Когда ковалентная связь -С-С- или -C-H разрывается, образуются частицы — радикалы. Это частицы, имеющие один электрон: (СH3• — метил ). Называют их соответственно классу соединения с окончанием -ил.
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации :
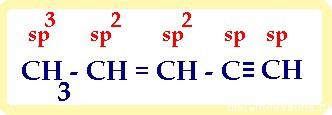
2) если нужно посчитать суммы s -и π-связей, то нужно учитывать не только связи -С-С-, но и -С-H:
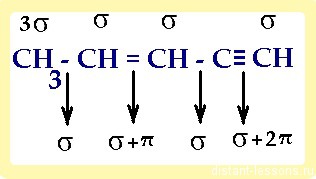
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов
положения кратной связи
межклассовая
(алкены изомерны циклоалканам)
положения кратной связи
межклассовая
(алкины изомерны алкадиенам)
положения кратной связи
межклассовая
(алкадиены изомерны алкинам)
положения функциональной группы
межклассовая
(спирты изомерны простым эфирам, только
один из радикалов будет ароматический)
положения функциональной группы
межклассовая
(кислоты изомерны сложным эфирам)
межклассовая
(сложные эфиры изомерны кислотам)
Какое бы задание вам не попалось, все сводится к определению строения органического соединения, поэтому чтобы не ошибиться, рисуйте структурные формулы данных соединений, а уже из этого вы определите и тип связи, и гибридизацию, и виды изомерии.
Кстати, ответы на наши примеры вопросов:
А13 первый вариант: изомером гексена-2 не является гексадиен-1, 3 Ответ: 4)
А 13 второй вариант: только Sp 2 гибридизация — в молекуле бутадиена Ответ: 4)
А 13 третий вариант: гомологами являются: пропан и пентан Ответ: 1)
Органическая химия – это раздел химии, который изучает структуру, свойства и методы получения (синтеза) углеводородов и их производных. Сейчас число известных органических соединений составляет почти 30 млн, однако оно продолжает расти (в мае 1999 года было известно около 12 млн органических веществ). Этот рост обусловлен необычными свойствами углерода. Например, данный элемент может образовать цепи любой длины, способные замыкаться и образовывать циклы, а также атом углерода способен создавать одинарные, двойные или тройные связи. Валентность углерода всегда равна 4-м, поэтому он всегда будет создавать вокруг себя 4 связи. Это могут быть четыре одинарных, две двойных, одна тройная и одна одинарная и др. В любом случае, способов образовывать связи много, однако чаще всего углерод связывается с водородом, кислородом, фосфором, азотом и некоторыми другими атомами этих элементов.
Теория строения органических соединений
Ещё в глубокой древности люди могли получать органические вещества, но теория их строения была сформулирована только в 1860-х годах русским химиком Александром Михайловичем Бутлеровым. Теория получила название в честь своего автора и стала фундаментом органической химии. До возникновения этой теории существовала такая точка зрения, что органические вещества нельзя получить из неорганических, то есть для их синтеза необходима некая сила, существующая только у живых организмов. Естественно, что появление теории, противоречащей всем знаниям в области органики, вызвало непонимание у химиков того времени. Научившись самостоятельно синтезировать органические вещества, ученые столкнулись с соединениями с одинаковой молекулярной формулой и молярной массой, но абсолютно другими свойствами. Например, диметиловый эфир при нормальных условиях представляет собой газ, а этиловый спирт, имеющий такой же состав, – жидкость. Подобные соединения стали называть изомерами, а явление – изомерией.
Основные положения теории Бутлерова
- Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностью.
- Химическое строение можно устанавливать химическими методами.
- Свойства любого органического вещества зависят от последовательности соединения атомов в молекуле.
- По свойствам вещества можно определить строение его молекулы, а по строению молекулы – предугадать свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Данная теория оказала сильное влияние на скорость развития органической химии. С ее помощью А.М. Бутлеров объяснил явление изомерии, а также самостоятельно получил некоторые изомеры, в очередной раз доказав верность своих мыслей.
Гомология и изомерия.
Углеводороды, в молекулах которых атомы углерода соединены между собой простой σ – связью, а все остальные валентности атомов углерода насыщены атомами водорода, называются предельными углеводородами или алканами.
Гомология. Изомерия. Номенклатура
Гомологи – это соединения, сходные по строению и обладающие близкими химическими свойствами, но отличающие друг от друга по составу на одну или несколько групп атомов СН2 (гомологическая разность).
Алканы образуют гомологический ряд, общая формула которого СnH2n+2, где n – число атомов углерода.
Изомеры– это вещества, имеющие одинаковый качественный и количественный состав, но различное строение молекул (разную структурную формулу) и обладающие поэтому разными свойствами.
Для предельных углеводородов характерна структурная изомерия или изомерия углеродной цепи. У первых трёх членов ряда: метана, этана и пропана – изомеров нет. Для них возможна только одна структурная формула:
H – C – H H – C – C – H H – C – C – C – H
метан этан пропан
Обычно пользуются упрощенными формулами, в которых указывают общее число атомов водорода при каждом углеродном атоме, например: СН3-СН3.
Следующий гомолог, бутан С4Н10 может существовать в виде двух изомеров:
н – бутан изобутан
Соединения с прямой (неразветвленной) цепью углеродных атомов называются нормальными, а с разветвленной цепью – изосоединениями.
Для углеводорода С5Н12 существует три изомера:
н – пентан изопентан неопентан
Атом углерода, соединенный с одним атомом углерода, называется первичным, с двумя – вторичным, с тремя – третичным, с четырьмя - четвертичным. В приведённых выше формулах изомеров пентана эти атомы углерода обозначены: I – первичный атом, II – вторичный атом, III – третичный атом, IV-четвертичный атом углерода
От пропана можно образовать два радикала состава С3Н7-:

перв-пропил (пропил) втор.-пропил (изопропил)
Радикал состава С4Н9 существует в виде четырёх изомеров:
перв.-бутил (бутил) втор-бутил
В приведённых названиях слова втор- (вторичный) и трет- (третичный) указывают, у какого атома углерода находится свободная валентность.
Названия углеводородов изостроения строятся следующим образом:
I. Выбирают главную цель молекулы – самую длинную и разветвлённую углеродную цепь.
II. Нумеруют атомы углерода, начиная с того конца цепи, к которому ближе находится радикал (боковое ответвление).
Если разные радикалы находятся на равном расстоянии от обоих концов цепи, то нумерацию начинают с того конца цепи, к которому ближе радикал с меньшим числом углеродных атомов (метил, этил, пропил и т.д.).
III. Указывают цифрами номера углеродных атомов, при которых находятся радикалы.
IV. Называют радикалы. Если имеется несколько одинаковых радикалов, то их число указывают греческими числительными (ди-, три-, тетра- и т.д.) перед названиями радикалов. Номера радикалов разделяют запятыми.
V. Называют углеводород по числу атомов углерода в главной цепи. При этом слово от цифр отделяют черточкой.
В молекулах алканов атомы углерода могут свободно вращаться вокруг оси связи С – С, поэтому углеводородная цепь будет принимать в пространстве разные формы, которые называются конформациями, или поворотными изомерами. Конформации сравнительно легко переходят друг в друга и не являются разными соединениями, так как химическое строение их (т.е. порядок связи атомов в молекуле) остаётся неизменным.
Химические свойства
В алканах атомы углерода находятся в состоянии sp 3 – гибридизации и все связи σ – типа. Связь С-С образуется при перекрывании гибридных орбиталей двух атомов углерода. Длина связи С-С равна 0,154 нм, энергии связи С-С – 339 кДж/моль. Связь С-Н образуется при перекрывании гибридной орбитали атома углерода с s – орбиталью атома водорода. Длина связи С-Н равна 0,109 нм, энергия связи С-Н 414 кДж/моль.
Алканы химически мало активны вследствие большой прочности и малой полярности σ – связей С-С и С-Н. Все валентности атомов углерода в алканах полностью насыщены, поэтому они не вступают в реакции присоединения. Концентрированная серная кислота и сильные окислители (KMnO4) при обычной температуре на алканы не действуют. Характерными реакциями для алканов являются:
1) реакции замещения атомов водорода на другие атомы или группы атомов, идущие за счёт разрыва связи С-Н,
2) реакции расщепления молекулы (крекинг) – за счёт разрыва связи С-С.
I. Галогенирование.При взаимодействии алканов с галогенами на свету происходит постепенно замещение атомов водорода на галоген. При этом образуется смесь галогенопроизводных углеводородов. Например, при действии хлора на метан образуется 4 различных продута замещения:
Читайте также:
- В чем заключались особенности политического развития монархии габсбургов кратко
- Основные направления деятельности субъектов рф кратко ст 72 ч 1
- Какие растения относятся к высшим споровым в чем состоит их основное отличие от водорослей кратко
- Проблемы педагогического мастерства в школьной практике
- Как защитить лес от пожара кратко

