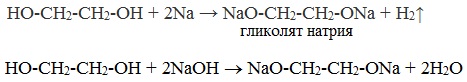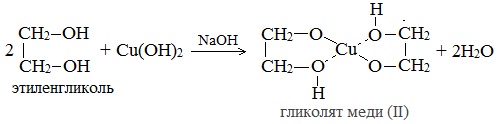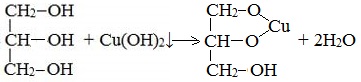Что собой представляет глицерат меди кратко
Обновлено: 08.07.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Щелочной раствор глицерата меди применяется для клинического определения глюкозы в моче под названием реактива Гайнеса. Преимущество его состоит в том, что определение происходит быстрее, чем при пробе Троммера. Кроме того, при небольшом количестве глюкозы избыток гидроксида меди ( II), находящийся в виде комплексного соединения с глицерином, не разрушается при кипячении с образованием черного осадка оксида меди ( II), маскирующего реакцию ( см. оп. [3] Щелочной раствор глицерата меди применяется для клинического определения глюкозы в моче под названием реактиваГайнеса Преимущество его состоит в том, что определение происходит быстрее, чем при пробе Троммера. [4] Щелочной раствор глицерата меди синего цвета применяется в клиническом анализе для открытия виноградного сахара в моче под названием реактива Гайнеса ( стр. [5] Полученный фильтрат, содержащий глицерат меди , переводят в мерную колбу емкостью 250 мл, объем доводят до метки дистиллированной водой и IB аликвотной части раствора определяют медь иодоме-прическйм методом. Солянокислый раствор, содержащий никель, нейтрализуют аммиаком, осаждают никель диметилглиоксимом и определяют его весовым методом. [6] По новым данным, образующийся глицерат меди имеет хелатное строение, подобное гликоляту меди ( стр. [7] С гидроокисью меди глицерин дает глицерат меди ( стр. [8] С гидроокисью меди глицерин дает глицерат меди ( стр. [9] Na CI использована р-ция образования глицерата меди в водном р-ре. Чувствительность определения составляет 0 02 г / л глицерина. [10] Очень легко образуются глицераты тяжелых металлов, например глицерат меди ( II), в которых ион металла связан в виде внутреннего комплекса, поэтому гидроксид металла щелочью не осаждается. [11] Глицерин, взаимодействуя с гндроксидом меди, образует глицерат меди . [12] Глицерин, взаимодействуя с гидроксидом меди ( II), образует глицерат меди . [13] Так, ион Си открывается по синей окраске раствора, присущей глицерату меди , а также реакцией с K4 [ Fe ( CN) e ] после подкисления части раствора уксусной кислотой. [14] В микрохимическую пробирку вводят 2 - 3 капли заранее приготовленного щелочного раствора глицерата меди ( реактив Гайнеса) ( см. опыт 35, стр. Держа пробирку наклонно, ее осторожно нагревают. [15]
Глицинат меди (II) — химическое соединение, соль меди и аминокислоты глицин с формулой Cu(NH2CH2COO)2, голубые кристаллы, растворяется в воде. СодержаниеПолучениеФизические свойстваГлицинат меди (II) образует голубые кристаллы. Плохо растворяется в воде и этаноле, не растворяется в углеводородах, эфирах, кетонах. Образует кристаллогидрат состава Cu(NH2CH2COO)2•H2O — кристаллы ромбической сингонии, пространственная группа P 212121, параметры ячейки a = 1,078 нм, b = 0,5208 нм, c = 1,347 нм, Z = 4. 16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ! 1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
Получение глицерата меди Качественная реакция на определение наличия глицецерина в растворах проводится с раствором сульфата меди (II) и раствором гидроксида натрия. Таким образом, происходит получение глицерата меди – комплексного соединения сине-василькового цвета. Химический эксперимент проводится так: к раствору сульфата меди (II) приливается раствор гидроксида натрия. Раствор окрашивается в синий цвет – это выпал осадок гидроксида меди (II). Далее добавляется несколько мл глицерина и раствор перемешивается. Наблюдается растворение осадка – образуется комплексное соединение цвета индиго - глицерат меди. Получение его записывается в уравнении: Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп. Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах. Кислотные свойства1. С щелочными металлами Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
2. С гидроксидом меди(II) — качественная реакция! Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2). При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты. Гликолят меди
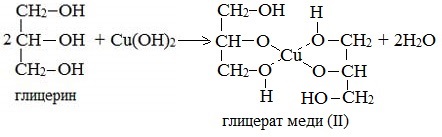
Глицерат меди
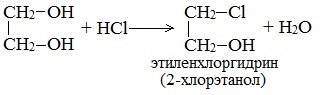
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами. Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН). Основные свойства1. С галогенводородными кислотами При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген: Вторая гидроксогруппа замещается труднее, под действием РСl5. 2. Реакция этерификации (с органическими и неорганическими кислотами) Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров. С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
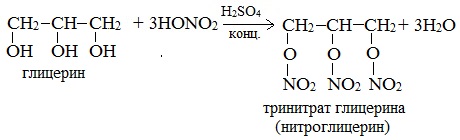
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина): Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление Какая разница между третичным и трехатомным спиртом? Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН. Читайте также:
|