Что называется кристаллизацией расплавов кратко
Обновлено: 06.07.2024
Образование кристаллов из паров, растворов, расплавов, вещества в твёрдом состоянии (аморфном или другом кристаллическом), в процессе электролиза и при химических реакциях. К. приводит к образованию минералов. К. воды играет важную роль в атмосферных и почвенных явлениях. К. лежит в основе металлургии, получения полупроводниковых, оптических, пьезоэлектрических и др. материалов, плёнок для микроэлектроники, металлических покрытий, широко используется в химической, пищевой, медицинской промышленности (очистка веществ, производство удобрений, соли, сахара, химикалиев, лекарств).
Условия К. Если кристалл не плавится, не растворяется, не испаряется и не растет, то он находится в термодинамическом равновесии с маточной средой (расплавом, раствором или паром). Равновесие кристалла с расплавом того же вещества возможно лишь при температуре плавления Тпл, а равновесие с раствором и паром — если последние насыщены. Пересыщение или переохлаждение среды — необходимое условие для роста погруженного в неё кристалла, причём скорость роста кристалла тем больше, чем больше отклонение от равновесия.
К. — фазовый переход вещества из состояния переохлажденной (пересыщенной) маточной среды в кристаллическое соединение с меньшей энергией. Избыточная энергия выделяется при К. в виде скрытой теплоты К. Часть этой теплоты может превращаться в механическую работу; например, растущий кристалл может поднимать положенный на него груз, развивая кристаллизационное давление порядка десятков кГ/см 2 . В частности, кристаллы солей, образующиеся в порах бетонных плотин в морской воде, могут вызывать разрушение бетона.
Выделение скрытой теплоты К. ведёт к нагреванию расплава, уменьшению переохлаждения и замедлению К., которая заканчивается исчерпанием вещества или достижением равновесных значений температуры, концентрации и давления.
Зародыши К. Переохлажденная среда может долго сохранять, не кристаллизуясь, неустойчивое метастабильное состояние (например, мелкие, диаметром 0,1 мм капли хорошо очищенных металлов можно переохладить до температуры ~ 0,8 Тпл). Однако при достижении некоторого предельного для данных условий критического переохлаждения в жидкости или паре почти мгновенно возникает множество мелких кристалликов (зародышей). Происходит спонтанная К. Возникшие кристаллики растут и, т. к. переохлаждение уменьшается, новые зародыши, как правило, больше не возникают. Критическое переохлаждение зависит от температуры, концентрации, состава среды, её объёма, от присутствия посторонних частиц (например, пылинок, на которых образуются зародыши, кристалликов др. веществ и т. п.), от материала и состояния поверхности стенок сосуда, от интенсивности перемешивания, действия излучений и ультразвука.
Выращивание крупных совершенных Монокристаллов часто ведут из метастабильных растворов и расплавов, вводя в них небольшие затравочные кристаллы и избегая самопроизвольного зарождения. Наоборот, в металлургических процессах стремятся иметь максимальное число зародышей.
Эпитаксия. Кристаллы, возникающие на поверхностях др. кристаллов, ориентированы относительно них закономерно. Например, при К. Au (из атомарного пучка) на поверхности кристалла NaCl кристаллики Au ориентированы параллельно грани NaCl либо гранями куба, либо гранями октаэдра. Явление ориентированного нарастания называется эпитаксией Эпитаксия из газовой фазы происходит, если температура подложки выше некоторой критической (если температура ниже, то кристаллики ориентированы хаотично) и сильно зависит от чистоты и дефектности подложки, состава окружающей среды, а также от предварительного облучения подложки электронами или рентгеновскими лучами. Подложка ориентирует кристаллики даже через тонкие (~1000Ǻ) плёнки угля, поливинилхлорида, окиси цинка, селена, если последние нанесены не в сверхвысоком вакууме (См. Сверхвысокий вакуум).
Эпитаксия используется для получения монокристаллических плёнок, применяемых, в частности, в микроэлектронике (См. Микроэлектроника). При этом на монокристальной подложке образуются отдельные, одинаково ориентированные кристаллики, которые затем срастаются в сплошную плёнку. Чистота и совершенство подложки сильно влияют на качество плёнки и её структуру. Дефекты плёнки возникают на примесях, а также в местах срастания отдельных кристалликов.
Рост кристаллов. Из слабо переохлажденных паров, растворов и реже расплавов кристаллы растут в форме многогранников. Их наиболее развитые грани обычно имеют простые кристаллографические индексы (см. Миллеровские индексы), например для алмаза это грани куба и октаэдра. Взаимная ориентация граней, как правило, такова, что размер каждой из них тем больше, чем меньше её скорость роста. Т. к. скорость роста увеличивается с переохлаждением по-разному для разных граней, то с изменением переохлаждения меняется и облик (габитус) кристалла. Рост простых кристаллографических граней идёт послойно, так что края незавершённых слоев — ступени — движутся при росте вдоль грани. Высота ступени, т. е. толщина откладывающегося слоя, колеблется от долей мм до нескольких Ǻ. На тонких двупреломляющих кристаллических пластинках ступени наблюдаются в поляризованном свете как границы областей различной окраски (рис. 3). Тонкие ступени наблюдают методом декорирования, а высокие ступени — непосредственно, с помощью оптического или электронного микроскопов. Тонкие ступени движутся при росте быстрее толстых, догоняют их и сливаются с ними. В свою очередь, высокие ступени расщепляются на более низкие. Формирующаяся т. о. ступенчатая структура поверхности сильно зависит от условий роста (температуры, пересыщения, состава среды) и влияет на совершенство формы кристалла. Например, появление на кристаллах сахарозы высоких ступеней ведёт к захвату капелек маточного раствора и растрескиванию кристаллов.
Если кристалл содержит винтовую дислокацию (См. Дислокации), то его атомные слои подобны этажам гаража с винтовым выездом в середине. Надстройка такого кристалла происходит присоединением атомов к торцу последней ступени (рис. 4, а). В результате кристаллический слой растет, непрерывно накручиваясь сам на себя, надстраивая дислокацию, а ступень в процессе роста принимает форму спирали (рис. 4, б, в). Дислокация обеспечивает при малых переохлаждениях квадратичную зависимость скорости роста грани от переохлаждения (пересыщения), т. е. заметную скорость роста уже при малых отклонениях от равновесия.
В случае бездислокационного кристалла отложению каждого нового слоя должно предшествовать его зарождение. При малых пересыщениях новые слои зарождаются лишь около дефектов поверхности, а при больших отклонениях от равновесия и на совершенных кристаллах зарождение слоев возможно в любых точках поверхности. При больших отклонениях от равновесия как зародышевый, так и дислокационный механизмы создают высокую плотность ступеней, а скорость роста увеличивается с переохлаждением линейно.
Ступени, расходящиеся по грани от уколов, царапин, а при больших пересыщениях от вершин кристалла, образуют холмики роста. Поверхность растущей грани целиком состоит из них. Склоны холмиков отклонены от грани на углы порядка нескольких градусов, причём тем меньше, чем меньше пересыщение.
Из расплава кристаллы (например, для большинства металлов) часто растут не огранёнными, а округлыми. Округлые поверхности растут не послойно (тангенциально), а нормально, когда присоединение новых частиц к кристаллу происходит практически в любой точке его поверхности.
Поверхности кристаллов, растущих послойно, являются атомно гладкими. Это означает, что основная масса возможных атомных положений в слое занята (рис. 5). Поверхности, растущие нормально, в атомном масштабе являются шероховатыми. В них количество вакансии и атомов, адсорбированных на поверхности и занимающих отдельные места, подлежащие заполнению в следующем слое, соизмеримо с полным числом возможных атомных положений (рис. 6). Атомно шероховатые поверхности, а часто и торцы ступеней на атомно гладких поверхностях содержат множество изломов. На изломах атомы могут переходить в кристаллическую фазу поодиночке, не объединяясь в агрегаты и потому не преодолевая связанных с этой коллективностью потенциальных барьеров. Поэтому рост шероховатой поверхности и ступеней обусловлен главным образом присоединением отдельных частиц к изломам. В результате скорости роста шероховатых поверхностей почти одинаковы во всех направлениях и форма растущего кристалла — округлая, а атомно гладкие поверхности растут послойно.
Формы роста кристаллов. Простейшая форма роста — многогранник, причём размеры граней сильно зависят от условий роста. Отсюда пластинчатые, игольчатые и др. формы кристаллов. При росте больших огранённых кристаллов из неподвижного раствора пересыщение выше у вершин и рёбер кристалла и меньше в центральных частях грани. Поэтому вершины становятся ведущими источниками слоев роста. Если пересыщение над центральными участками граней достаточно мало, то грань уже не может больше расти, и вершины обгоняют центры граней. В результате возникают скелетные формы кристаллов (рис. 7). Поэтому совершенные кристаллы выращивают из хорошо перемешиваемых растворов и расплавов.
Примесь, содержащаяся в маточной среде, входит в состав кристалла. Отношение концентрации примеси в кристалле и в среде называется коэффициентом распределения примеси. Захват примеси зависит от скорости роста. Разные грани захватывают при К. разные количества примесей. Поэтому кристалл оказывается как бы сложенным из пирамид, имеющих своими основаниями грани кристалла и сходящимися своими вершинами к его центру (рис. 8). Такой секториальный захват примеси вызван различным строением разных граней.
Если кристалл плохо захватывает примесь, то избыток её скапливается перед фронтом роста и растёт. Обогащенный примесью пограничный слой, из которого идёт К., не успевает перестраиваться, в результате чего возникает зонарная структура (полосы на рис. 8). Аналогичная картина возникает, если кристалл обогащается примесью, а пограничный слой обедняется.
Если расплав перед фронтом роста переохлажден, то выступ, случайно возникший на поверхности, попадает в область большего переохлаждения, скорость роста его вершины увеличивается ещё больше и т. д. В результате плоский фронт роста разбивается на округлые купола, имеющие в плоскости фронта форму полос или шестиугольников,— возникает ячеистая структура (рис. 9, а). Линии сопряжения ячеек (канавки) оставляют в теле растущего кристалла дефектные и обогащенные примесью слои, так что весь кристалл оказывается как бы сложенным из гексагональных палочек или пластинок (карандашная структура; рис. 9, б).
Если в переохлажденном расплаве (растворе) оказывается не плоская поверхность, а маленький кристалл, то выступы на нём развиваются в различных кристаллографических направлениях, отвечающих максимальной скорости роста, и образуют многолучевую звезду. Затем на этих главных отростках появляются боковые ветви, на них — ветви следующего порядка, — возникает дендритная форма кристаллов (рис. 10). Несмотря на причудливую древовидную форму, кристаллографическая ориентация дендритного кристалла одинакова для всех его ветвей. Необходимые условия для развития Дендритов у кристаллов, растущих послойно, — большое переохлаждение и плохое перемешивание.
При очень малых скоростях роста кристалла из расплава коэффициент распределения вещества перестаёт зависеть от направления и скорости роста и приближаются к равновесному значению, определяемому диаграммой состояния.
Посторонние газы, хорошо растворимые в маточной среде, но плохо захватываемые растущим кристаллом, образуют на фронте роста пузырьки, которые захватываются кристаллом, если скорость роста превосходит некоторую критическую. Так же захватываются и посторонние твёрдые частицы из маточной среды, становящиеся затем в кристалле источниками внутренних напряжений.
Массовая К. — одновременный рост множества кристаллов — широко используется в промышленности. Для получения кристаллов примерно одинаковой величины и формы используются мельчайшие (~0,1 мм) затравочные кристаллы; процесс ведётся в той области температур, где новые зародыши самопроизвольно не возникают.

Рис. 1. Зависимость работы А, требующейся для образования кристаллического агрегата, от размера r зародыша.

Рис. 2. Сплошная кривая — зависимость числа зародышей кристаллов глицерина, возникающих в 1 см 3 расплава в единицу времени, от температуры; пунктирная кривая — то же для 1,2 см 3 расплава пиперина.
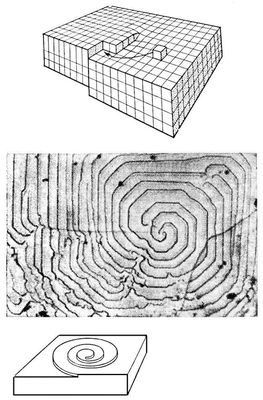
Рис. 4. а — схема роста кристалла на винтовой дислокации; б — спиральный рост на грани (100) синтетического алмаза; в — форма ступени при спиральном росте.

Рис. 5. Характерные положения атома на атомно гладкой поверхности кристалла со ступенями: 1 — в торце ступени; 2 — адсорбция на ступени; 3 — в изломе; 4 — адсорбция на поверхности; 5 — в поверхностном слое кристалла; 6 — двумерный зародыш на атомно гладкой грани.

Рис. 6. Атомно шероховатая поверхность.

Рис. 9. а — ячеистая структура; б — карандашная структура.

Рис. 7. Скелетный кристалл шпинели.
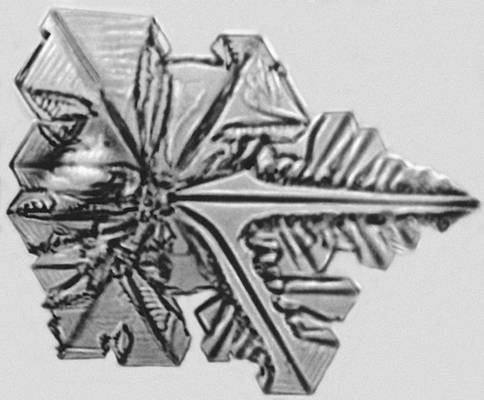
Рис. 10. Начальная стадия дендритного роста кристалла иодоформа.

Рис. 8. Зонарное и секториальное строение кристалла алюмокалиевых квасцов.

Рис. 3. Пластинчатый кристалл паратолуидина в поляризованном свете; каждая линия — ступень на поверхности кристалла. По разные стороны от ступени толщина кристалла, а следовательно, и интенсивность прошедшего света и окраска (в скрещенных николях) различны.
КРИСТАЛЛИЗА́ЦИЯ, образование кристаллов из расплавов, растворов, газовой фазы или плазмы, а также из аморфных веществ или кристаллов др. структуры. В процессе К. атомы, молекулы или ионы вещества выстраиваются в кристаллическую решётку . К. является неравновесным фазовым переходом 1-го рода. Условия равновесия кристалла со средой (расплавом, паром, раствором и др.) определяются как фазовое равновесие агрегатных состояний вещества при фазовых переходах 1-го рода: равенство темп-ры, давления и химич. потенциала. Необходимое условие роста кристалла – отклонение от равновесия, определяемое переохлаждением (отличием темп-ры от равновесной) и пересыщением (отличием давления или концентрации от равновесных значений). Термодинамич. движущая сила фазового перехода тем выше, чем больше отклонение от равновесия. Переход вещества в кристаллич. фазу сопровождается выделением скрытой теплоты К., и при неполном отводе этой теплоты возможно уменьшение отклонения от равновесия и замедление процесса. Как фазовый переход 1-го рода К. сопровождается скачком удельного объёма по отношению к исходной фазе, и это может приводить к изменению давления в кристаллизующейся системе. Таким образом, К. – это сложный процесс тепломассопереноса, который управляется термодинамич. и кинетич. факторами. Многие из них трудно контролировать. Уровень чистоты, темп-ра и концентрация компонентов в непосредственной близости к фазовой границе, перемешивание, теплообмен могут быть гл. факторами, определяющими размер, число и форму возникающих кристаллов.
Кристаллизация расплавов обладает рядом преимуществ по сравнению с рассмотренными выше методами разделения, например с ректификацией, экстракцией: низкие расходы энергии, возможность разделения азеотропных и близкокипящих смесей, проведения процесса при низких температурах и др. Этот процесс все шире применяется в химической технологии (в производстве удобрений, щелочей и др.) в основном для отверждения и разделения расплавов на фракции и для выращивания монокристаллов. Отметим, что между процессами кристаллизации расплавов и из растворов нет принципиального термодинамического различия. Процесс разделения кристаллизацией расплавов часто называют фракционным плавлением.
На рис. 23-14 представлена зависимость температуры t от времени τ процесса медленного нагревания твердого вещества. Из этого рисунка видно, что на кривой t = f(τ) имеется горизонтальный участок, соответствующий температуре tnл плавления. Этот участок наблюдается до тех пор, пока произойдет полное расплавление вещества и выделится теплота фазового превращения.
Отметим, что образование кристаллов в расплаве (их возникновение и рост) происходит так же, как и при кристаллизации из растворов. При этом для оценки скорости процесса вместо пересыщения используют переохлаждение.
При однократном фракционном плавлении исходную смесь вначале медленно охлаждают до полной кристаллизации. Затем образовавшуюся кристаллическую массу нагревают от температуры кристаллизации до температуры фракционирования. Полученную суспензию отфильтровывают, причем кристаллическая фаза оказывается более обогащенной высокоплавким компонентом.

Рис. 23-14. Зависимость температуры t от времени τ нагрева твердого вещества
Рис. 23-15. Схема затвердевания вещества (а) и распределения концентраций по длине образца (б) при направленной кристаллизации (а
Направленная кристаллизация. Этот метод кристаллизации (фракционирования), как и рассмотренные выше, возможен вследствие различия равновесных составов сосуществующих фаз при переходе вещества из одного агрегатного состояния в другое. Он основан на отводе теплоты от границы раздела фаз, что вызывает направленное передвижение фронта кристаллизации вдоль очищаемого образца. Это передвижение обеспечивают медленным перемещением зон нагрева и охлаждения (рис. 23-15, а). Процесс направленной кристаллизации наиболее рационально применять для глубокой очистки небольших количеств веществ, предварительно очищенных другими методами.
Поскольку состав образующейся в процессе кристаллизации твердой фазы отличается от состава расплава, то при движении фронта кристаллизации вдоль образца происходит перераспределение примеси между обеими фазами. Отметим, что при α 1 -выше.
Полагаем, что коэффициент диффузии в твердой фазе равен нулю, а на поверхности раздела фаз устанавливается равновесие (т.е. х = αу, где х и y-концентрации примеси соответственно в твердой фазе и расплаве). Примем также, что при перемещении в зоне расплава фронт кристаллизации вдоль образца остается плоским. Тогда уравнение материального баланса примесного компонента в процессе направленной кристаллизации в дифференциальной форме можно записать следующим образом:

где Vp и Vк - объемы соответственно расплава и твердой фазы.
Очевидно, что полный объем образца = Vp+Vк. Поскольку в уравнении (23.32) d = — dVK, то
= , (23.33)
где хн - начальная концентрация примеси в образце.
При известной зависимости х =f(y) уравнение (23.33) решается аналитически. Если эта зависимость линейна (т. е. а = const), решение уравнения (23.33) принимает следующий вид:

x = ). (23.34)
Обычно сечение образца постоянно по всей его длине. В этом случае уравнение (23.34) можно записать следующим образом (рис. 23-15, а):

(23.35)

, (23.36)

где - доля закристаллизовавшегося вещества.
Отметим, что уравнение (23.34) является аналогом уравнения (23.20), полученного для случая кристаллизации из растворов.
Распределение примеси по длине образца в зависимости от степени перемешивания расплава представлено на рис. 23 – 15,б.
Зонная плавка. Этот вид кристаллизационного процесса глубокой очистки веществ в отличие от направленной кристаллизации проводится (рис. 23 – 16) при медленном (со скоростью 0,5-20 см/ч) перемещении вдоль образца очищаемого вещества 1 нагревателя 4,

Рис. 23 – 16. Схема зонной плавки:
1 – исходный образец; 2– зона расплава; 3- зона кристаллизации после очистки, 4-нагреватель
создающею в образце зону 2 расплава длиной ɭ . По длине L образца образуются две подвижные межфазные границы. По одну из этих границ происходит плавление материала образца, по другую - его затвердевание (зона 3). При движении расплавленной зоны 2 вдоль образца вследствие различной растворимости примеси в расплаве и твердой фазе ее концентрация в образце перераспределяется.
Если а 1 -выше.
Полагаем, что коэффициент диффузии в твердой фазе равен нулю, а на поверхности раздела фаз устанавливается равновесие (т.е. х = αу, где х и y-концентрации примеси соответственно в твердой фазе и расплаве). Примем также, что при перемещении в зоне расплава фронт кристаллизации вдоль образца остается плоским. Тогда уравнение материального баланса примесного компонента в процессе направленной кристаллизации в дифференциальной форме можно записать следующим образом:
где Vp и Vк - объемы соответственно расплава и твердой фазы.
Очевидно, что полный объем образца = Vp+Vк. Поскольку в уравнении (23.32) d = — dVK, то
= , (23.33)
где хн - начальная концентрация примеси в образце.
При известной зависимости х =f(y) уравнение (23.33) решается аналитически. Если эта зависимость линейна (т. е. а = const), решение уравнения (23.33) принимает следующий вид:

x = ). (23.34)
Обычно сечение образца постоянно по всей его длине. В этом случае уравнение (23.34) можно записать следующим образом (рис. 23-15, а):

(23.35)

, (23.36)

где - доля закристаллизовавшегося вещества.
Отметим, что уравнение (23.34) является аналогом уравнения (23.20), полученного для случая кристаллизации из растворов.
Распределение примеси по длине образца в зависимости от степени перемешивания расплава представлено на рис. 23 – 15,б.
Зонная плавка. Этот вид кристаллизационного процесса глубокой очистки веществ в отличие от направленной кристаллизации проводится (рис. 23 – 16) при медленном (со скоростью 0,5-20 см/ч) перемещении вдоль образца очищаемого вещества 1 нагревателя 4,

Рис. 23 – 16. Схема зонной плавки:
1 – исходный образец; 2– зона расплава; 3- зона кристаллизации после очистки, 4-нагреватель
создающею в образце зону 2 расплава длиной ɭ . По длине L образца образуются две подвижные межфазные границы. По одну из этих границ происходит плавление материала образца, по другую - его затвердевание (зона 3). При движении расплавленной зоны 2 вдоль образца вследствие различной растворимости примеси в расплаве и твердой фазе ее концентрация в образце перераспределяется.
Теоретические основы кристаллизации. Измерение и анализ параметров кристаллизации и осаждения
Пожалуйста, расскажите о вашей задаче. Узнать больше Позвонить специалисту Запросить информацию Запросить цены

Что такое кристаллизация?
Кристаллизация — процесс выстраивания атомов и молекул в жесткую кристаллическую решетку с хорошо определенной энергетически устойчивой структурой. Мельчайший структурный элемент кристаллической решетки — ячейка. Она способна принимать атомы и молекулы, и благодаря этому свойству формируется макроскопический кристалл. В процессе кристаллизации атомы и молекулы соединяются между собой под определенными углами, образуя характерную форму кристалла с гладкими поверхностями и гранями. Хотя кристаллизация происходит в природе, у нее также есть широкое промышленное применение. Она используется на этапе разделения и очистки при производстве фармацевтических и химических продуктов.

Условия процесса кристаллизации напрямую влияют на размер и форму кристаллов и чистоту кристаллического продукта. Важно понимать сущность процесса кристаллизации и правильно подбирать его параметры. Это позволит получать однородные кристаллы нужного размера, формы и чистоты, а также предотвратить проблемы на последующих этапах, такие как слишком долгое время фильтрации или недостаточная сушка.

Почему кристаллизация так важна?
Кристаллизация широко применяется для производства различных необходимых нам продуктов — начиная от пищи и лекарств и заканчивая топливом. Большинство продуктов агрохимической и фармацевтической промышленности в ходе разработки и производства подвергается нескольким этапам кристаллизации. С помощью этого процесса получают такие ключевые пищевые ингредиенты, как лактоза и лизин. Однако нежелательная кристаллизация может быть опасна — например, кристаллизация газовых гидратов в глубоководных трубопроводах.
Основные понятия кристаллизации
Кристаллизация
— это процесс образования твердой фазы в виде кристаллов из растворов или расплавов.
Кристалл
— тело, частицы которого (атомы, ионы или молекулы) расположены в трехмерной периодической структуре, принимающей естественную форму многогранника.
Осаждение
— синоним кристаллизации, однако этот термин чаще всего употребляется в отношении кристаллизации, которая происходит очень быстро в результате химической реакции.
Растворимость
— свойство вещества, его количество, которое способно раствориться в данном растворителе при данной температуре.
Насыщенный раствор
— раствор, содержащий максимальное количество вещества, которое способно раствориться в данном растворителе при данной температуре. Кристаллизация происходит в насыщенном растворе. Количество растворенного на тот момент вещества определяется его растворимостью.
Пересыщение
— разница между реальной и равновесной концентрациями растворенного вещества при данной температуре.

Виды кристаллизации
Кристаллизация происходит, когда растворимость вещества в растворе понижается каким-либо способом. Стандартные методы снижения растворимости:
b) добавление антирастворителя;
d) реакция (осаждение).
Выбор метода кристаллизации зависит от имеющегося оборудования, целей процесса кристаллизации, растворимости и стабильности растворенного вещества в выбранном растворителе.

Типичные сложности при кристаллизации
Кристаллизация происходит за счет нескольких взаимосвязанных процессов, на протекание которых влияют выбранные параметры. Основные этапы:
- образование активных центров (нуклеация);
- рост;
- образование новой жидкой фазы;
- агломерация;
- распад агломератов;
Данные процессы, которые часто протекают в скрытом виде, оказывают ключевое влияние на результат кристаллизации.
Этапы кристаллизации
- Выберите подходящий растворитель. Ключевые моменты, на которые нужно обратить внимание, — количество вещества, которое можно в нем растворить (растворимость), и безопасность работы с растворителем.
- Повышая температуру, полностью растворите продукт в растворителе. Нерастворенные примеси можно удалить из горячего раствора с помощью фильтрования.
- Чтобы уменьшить растворимость, используйте охлаждение, добавление антирастворителя, испарение или реакцию осаждения. Раствор станет пересыщенным.
- Кристаллизируйте продукт. При уменьшении растворимости до определенной точки начинается нуклеация и рост кристаллов. В ходе этого процесса формируются кристаллы продукта высокой степени чистоты. Примеси останутся в растворе.
- Позвольте системе достигнуть равновесия после охлаждения (или применения другого метода кристаллизации).
- Проведите фильтрацию и сушку готового продукта.
Публикации по теме кристаллизации
Ознакомьтесь с подборкой статей по теме кристаллизации:
Классическая работа по нуклеации кристаллов из растворов
Jaroslav Nývlt, Kinetics of nucleation in solutions, Journal of Crystal Growth, Volumes 3–4, 1968.
Исследование механизмов выращивания кристаллов из раствора
Crystal Growth Kinetics, Material Science and Engineering, Volume 65, Issue 1, July 1984.
Подробное исследование причин агломерации кристаллов в процессе кристаллизации
Brunsteiner et al., Toward a Molecular Understanding of Crystal Agglomeration, Crystal Growth & Design, 2005, 5 (1), pp 3–16.
Исследование механизмов распада агломератов в процессе кристаллизации
Fasoli & Conti, Crystal breakage in a mixed suspension crystallizer, Volume 8, Issue 8, 1973, Pages 931–946.
Обзор алгоритмов разработки эффективных процессов кристаллизации в высокотехнологичных сегментах химической промышленности
Paul et al., Organic Crystallization Processes, Powder Technology, Volume 150, Issue 2, 2005.
Технологии, которые гарантируют получение нужной полиморфной формы в процессе кристаллизации
Kitamura, Strategies for Control of Crystallization of Polymorphs, CrystEngComm, 2009,11, 949–964.

Основные параметры и превращения в процессе кристаллизации
Кристаллы обладают множеством характеристик, но, пожалуй, важнейшая из них — это распределение кристаллов по размерам. От этого параметра в значительной степени зависят качество конечного продукта и эффективность процесса его получения. Размер и форма кристаллов непосредственно влияют на основные технологические этапы, следующие за кристаллизацией, — фильтрацию и сушку. Конечный размер кристаллов также определяет качество кристаллического продукта. Например, биологическая доступность и эффективность фармацевтических составов тем выше, чем мельче получаемые кристаллы, так как они лучше растворяются.
Оптимизировать дисперсность кристаллов можно путем тщательного подбора условий и параметров процесса кристаллизации. Чтобы кристаллический продукт приобрел нужные свойства, важно понимать, как параметры процесса влияют на основные превращения в ходе кристаллизации — образование зародышей (нуклеацию), рост и распад кристаллов.

Практический пример: значение скорости охлаждения для кристаллизации
В этом примере охлаждение в конце цикла вызывает вторичную нуклеацию, которая приводит к образованию множества мелких частиц. Исследование проведено с использованием анализаторов размера частиц.
Увеличение скорости охлаждения раствора ведет к более быстрому пересыщению, в результате скорость образования зародышей кристаллов будет выше скорости их роста. Следовательно, чтобы получить нужное распределение кристаллов по размеру, чрезвычайно важно контролировать скорость охлаждения.
Дисперсность кристаллов льда, например, влияет на вкус и консистенцию мороженого: так, кристаллы размером менее 50 мкм предпочтительнее кристаллов, которые больше 100 мкм. Она влияет и на технологические свойства распыляемых агрохимикатов: их частицы должны быть малы настолько, чтобы не засорять сопла при распылении, но при этом достаточно большими, чтобы их не уносило на соседние поля.
При масштабировании получить кристаллический продукт нужного размера и формы с наименьшими издержками возможно лишь в случае понимания всех нюансов кристаллизации.

Оборудование для кристаллизации
Процессно-аналитическая технология для разработки процессов кристаллизации
Рабочая станция кристаллизации позволяет ученым получать максимум информации из каждого эксперимента с помощью централизованного программного решения. Средства процессно-аналитической технологии (PAT):
-
Автоматизированные реакторы EasyMax, OptiMax и RX-10, а также реакционный калориметр RC1 обеспечивают непрерывное (24/7) и точное регулирование и регистрацию параметров процесса, включая значения энтальпии кристаллизации, благодаря чему ученые могут точно определять критические параметры процесса (CPP).
— это зондовый прибор для получения изображений с высоким разрешением и их анализа. EasyViewer рассчитывает характеристики дисперсий кристаллов, частиц и капель в том естественном виде, в каком они находятся в технологической среде.
— анализатор размера и количества частиц. Полученная с его помощью статистически достоверная характеристика свойств дисперсных систем способствует успешному масштабированию процесса от лаборатории до производства при полном соблюдении требований ATEX.
— рамановская спектроскопия in situ позволяет получать информацию химического и структурного характера, которая необходима для комплексного изучения полиморфных систем и выбора параметров процесса, обеспечивающих получение кристаллов требуемой формы.
— спектроскопия ИКФС в режиме реального времени предоставляет важные сведения о концентрации и уровне пересыщения, ширине зоны метастабильности, кинетике снятия пересыщения и конечной точке кристаллизации. Эти данные необходимы для обеспечения повторяемости процесса кристаллизации и гарантированного достижения заданной конечной точки.
Автоматизированные реакторы
Точное регулирование критических параметров процесса
В дисперсных системах такие параметры, как температура, интенсивность перемешивания или режим дозирования, непосредственно влияют на качество процесса и конечного продукта. Приборы EasyMax, OptiMax, RC1 и RX-10 обеспечивают точное регулирование и регистрацию условий процесса для гибкого конструирования дисперсных систем.
-
Регистрируются все данные: начиная от порядка добавления ингредиентов, программы дозирования и подъема температуры до регулирующих воздействий в ходе процесса.
Определение характеристик частиц
Изучение частиц в технологической среде
Размер, форма и концентрация — это важнейшие свойства частиц на каждой стадии процесса кристаллизации и на всех этапах масштабирования, поэтому они считаются критическими показателями качества (CQA). Анализаторы размера частиц оперативно отображают и количественно характеризуют частицы и важнейшие механизмы их формирования, что существенно облегчает разработку процессов кристаллизации.
-
Свойства частиц и механизмы их формирования регистрируются автоматически для последующего анализа.
Химический и структурный анализ
Достижение заданной конечной точки — в каждом эксперименте
Такие характеристики среды, как концентрация раствора, степень пересыщения и кристаллическая (полиморфная) модификация, часто связаны между собой и в совокупности определяют успех разработки технологического процесса кристаллизации. Системы ReactIR и ReactRaman анализируют состояние раствора и дисперсии для безошибочного достижения заданной конечной точки процесса.
-
Они непрерывно контролируют состав раствора и форму отдельных частиц, регистрируют и отображают результаты в режиме реального времени.

Как разработать процесс кристаллизации
Разработка процесса кристаллизации для получения чистого продукта с оптимальным выходом и размером частиц включает в себя ряд важных элементов:
Читайте также:
- Как мухаммад стал пророком кратко
- Каким прибором измеряется сила тока как он включается в электрическую цепь кратко
- Наличие и перечень внеклассной и досуговой деятельности логопеда в школе
- Гитлер что сделал плохого кратко
- Какой из методистов внес существенный вклад в проблему разработки школьного учебника истории

