Что лежит в основе работы любых катализаторов в том числе ферментов кратко
Обновлено: 05.07.2024
Основное различие между катализатором и ферментом заключается в том, что катализатор известен как химическое вещество, которое ускоряет скорость химической реакции, тогда как фермент — это глобулярный белок, который ускоряет скорость биохимической реакции.
Катализатор против фермента
Вещество, которое максимизирует скорость химической реакции без каких-либо изменений в его химической структуре, известно как катализатор; с другой стороны, биологическая молекула, образованная живыми организмами, которые катализируют определенные биологические реакции при температуре тела. Катализаторы могут быть либо ферментами, либо неорганическими солями, тогда как ферменты рассматриваются как тип катализатора.
Типы неорганических катализаторов представляют собой минеральные ионы или небольшие молекулы; напротив, ферменты представляют собой глобулярные белки. Присутствуют неорганические катализаторы, близкие по размеру к молекуле субстрата; С другой стороны, размер ферментов намного больше по сравнению с молекулой субстрата.
Молекулярная масса неорганического катализатора низкая, а молекулярная масса ферментов высокая. Неорганические катализаторы обычно действуют на физические реакции; с другой стороны, ферменты всегда действуют на биохимические реакции. Катализаторы обычно работают менее эффективно; напротив, ферменты работают очень эффективно.
Катализаторы могут максимизировать скорость различных наборов реакций, тогда как ферменты могут действовать и увеличивать скорость только конкретной реакции. Молекулы регулятора не могут контролировать функцию неорганических катализаторов; С другой стороны, регуляторные молекулы могут регулировать функцию ферментов путем связывания регуляторных молекул со специфическим ферментом.
Неорганические катализаторы нечувствительны к небольшим перепадам температуры, поэтому они работают при высоких температурах; с другой стороны, ферменты зависят от температуры, поэтому при низких температурах ферменты становятся неактивными, а при высоких температурах ферменты денатурируются.
Неорганические катализаторы обычно не чувствительны к небольшим изменениям pH; и наоборот, ферменты чувствительны к небольшим изменениям pH и работают только в определенном диапазоне pH. Неорганические катализаторы работают только при высоком давлении, в то время как ферменты работают только при стандартном давлении. На неорганические соли белковые яды не действуют; С другой стороны, ферменты могут быть отравлены белковыми ядами.
Коротковолновое излучение не влияет на неорганические катализаторы, в то время как коротковолновое излучение может денатурировать ферменты. Основными примерами катализаторов являются железо, платина и оксид ванадия. Напротив, некоторыми примерами фермента являются глюкозо-6-фосфат, алкогольдегидрогеназа, амилаза, липаза и аминотрансфераза.
Сравнительная таблица
| Катализатор | Фермент |
| Катализатор — это молекулы, которые ускоряют скорость реакции без изменения ее структуры. | Фермент известен как биологический катализатор и глобулярный белок, ускоряющий естественные реакции. |
| Корреляция | |
| Могут быть ферменты или неорганические соли. | Считается разновидностью катализатора |
| Тип | |
| Минеральные ионы или небольшие молекулы | Глобулярные белки |
| Разница в размерах | |
| По размеру похож на молекулу субстрата. | Очень крупный по сравнению с молекулой субстрата |
| Молекулярный вес | |
| Молекулярная масса низкая | Молекулярная масса ферментов высокая |
| Действие | |
| Обычно действуют на физические реакции | Всегда действуйте в соответствии с биохимическими реакциями |
| Эффективность | |
| Работайте менее эффективно | Работайте высокоэффективно |
| Специфичность | |
| Может максимизировать скорость различных реакций | Может только действовать и увеличивать скорость конкретной реакции |
| Молекулы регулятора | |
| Невозможно контролировать работу неорганических катализаторов. | Может регулировать функцию ферментов путем связывания регуляторных молекул со специфическим ферментом. |
| Температура | |
| Нечувствительны к небольшим перепадам температуры, поэтому работают при высоких температурах | Зависит от температуры, поэтому при низкой температуре ферменты становятся неактивными, а при высокой температуре ферменты денатурируются. |
| pH | |
| Обычно не чувствителен к небольшим изменениям pH. | Чувствителен к небольшим изменениям pH и работает только в определенном диапазоне pH |
| Давление | |
| Работайте только при высоком давлении | Работайте только при нормальном давлении |
| Белковые яды | |
| Белковые яды не действуют | Может быть поражен и отравлен белковыми ядами |
| Коротковолновое излучение | |
| Не влияет на неорганические катализаторы | Может денатурировать ферменты |
| Примеры | |
| Оксид железа, платины и ванадия | Глюкозо-6-фосфат, алкогольдегидрогеназа, амилаза, липаза и аминотрансфераза |
Что такое катализатор?
Конкретное вещество, которое позволяет химическим реакциям протекать с большей скоростью в различных условиях, известно как катализатор. Обычно для начала или катализа реакции требуется лишь небольшое количество катализатора. Обычно катализаторы уменьшают скорость энергии активации реакции, открывая другой путь к реакции. Временный промежуточный продукт образуется в низкоэнергетическом состоянии, когда катализаторы реагируют с субстратом.
Типы катализаторов
- Неорганический катализатор: это может быть переходный металл или оксид переходного металла. Переходные металлы обладают широким спектром специфичности. Переходные металлы обеспечивают удобную площадь поверхности для протекания химических реакций различными способами, что снижает скорость энергии активации химической реакции. Они используются в виде мелкодисперсных порошков с максимальной площадью поверхности. Неорганические катализаторы, кроме того, делятся на две категории в зависимости от природы вещества как гетерогенные катализаторы или гомогенные катализаторы.
- Фермент: это глобулярный белок, который катализирует многие биохимические реакции внутри клетки в присутствии определенной температуры тела.
Что такое фермент?
Биологическая макромолекула, которая образуется живыми организмами для катализа биохимических реакций внутри определенных клеток при средней температуре тела. Функции ферментов обширны, поскольку они имеют решающее значение для поддержания жизни.
Все биохимические реакции, которые происходят внутри тела живых организмов, зависят от ферментов, около 4000 хорошо известных до сих пор. Ферменты обычно действуют в обычных условиях, таких как нормальная температура тела и pH.
Функции ферментов очень специфичны, их основная функция — катализировать строительные реакции и разрушение многих материалов внутри живых организмов. Ферменты состоят из глобулярных белков с высокой молекулярной массой.
Ферменты нуждаются в кофакторах для их работы. Кофакторы считаются неорганическими ионами, такими как Zn 2+ , Mg 2+ , Fe 2+ и Mn 2+, или многие небольшие органические молекулы известны как коферменты. Активность ферментов может быть ускорена или подавлена связыванием кофакторов фермента.
Ключевые отличия
- Катализатор, рассматриваемый как вещество, ускоряющее скорость химических реакций, не имеющее постоянной структуры; с другой стороны, фермент считается биологическими молекулами, которые синтезируются живыми организмами, работающими при температуре тела.
- Неорганические катализаторы имеют низкую молекулярную массу; напротив, фермент имеет высокую молекулярную массу.
- Катализаторы обычно действуют на физические реакции, а ферменты — на биохимические реакции живых организмов.
- Неорганические катализаторы работают при высоких температурах, потому что они нечувствительны к небольшим изменениям температуры; наоборот, ферменты не действуют при высоких температурах; вместо этого они работают при нормальной температуре.
- Неорганические катализаторы обычно не чувствительны к небольшим изменениям pH, тогда как ферменты работают в определенных диапазонах pH.
- Белковые яды не действуют на неорганические катализаторы, а коротковолновое излучение денатурирует свойства ферментов.
Заключение
Катализатор и фермент — это вещества, которые ускоряют скорость химической реакции за счет минимизации энергии активации. Разница между ними в том, что катализаторы — это небольшие молекулы, которые катализируют химические реакции живых организмов, а ферменты считаются макромолекулами, которые катализируют определенные биохимические реакции.
Катализ — возбуждение химических реакций или изменение их скорости под влиянием веществ — катализаторов, многократно вступающих в химическое взаимодействие с участниками реакции и восстанавливающихся после каждого цикла взаимодействия свой химический состав.
Например, в некоторых химических реакциях применяются следующие катализаторы реакций Al2O3, TiO2, ThO2, MnO2, алюмосиликаты, цеолиты, CaO, BaO, MgO, Ti, Rh, Ni, квант света, повышение температуры и др.
Вопрос 2. Что такое экзо — и эндотермические реакции?
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты в окружающую среду. Экзотермическая реакция являются, например, горение, нейтрализация, большинство реакций образования химических соединений из простых веществ.
Эндотермическая реакция — реакция, сопровождающаяся поглощением теплоты. К эндотермическим реакциям относятся диссоциация (в частности, разложение молекул на свободные атомы), восстановление металлов из руд, фотосинтез в растениях, образование некоторых соединений из простых веществ.
Вопрос 3. Что такое прямая и обратная химические реакции?
Прямая, или необратимая, химическая реакция — реакция, идущая до конца и не изменяющая своего направления при изменении температуры и давления, а также если один из продуктов реакции выводится из сферы реакции в виде газа, осадка, малодиссоциированного соединения (воды, слабой кислоты или основания, комплексной соли) или выделяется большое количество тепла (реакция горения).
Обратная, или обратимая, химическая реакция, — это такая, в результате которой полученные вещества вновь реагируют между собой с образованием исходных веществ. При одних условиях (P, t, kat) они идут в одном направлении, при других — в обратном, а при некоторых промежуточных — протекают одновременно в двух взаимно противоположных направлениях. Примером обратимых реакций служат реакции термического разложения гидроксида кальция, синтез аммиака.
Вопрос 4. Какова роль катализаторов в протекании химических реакций?
Катализаторы в протекании химических реакций могут увеличивать концентрации активных частиц в реакционной смеси, образовывать промежуточные соединения с обоими из реагентов реакции, осуществлять химическую активацию, значительно ускорять протекание химических реакций.
Вопрос 5. Что лежит в основе работы (механизма действия) любых катализаторов, в том числе ферментов?
Они снижают необходимое количество энергии активации, и за счёт этого ускоряется протекание реакции.
Вопрос 6. Какое строение имеет молекула белка — фермента?
Простые ферменты состоят только из аминокислот — например, пепсин, трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
В составе белка — фермента выделяют области, выполняющие различную функцию:
1. Активный центр — комбинация аминокислотных остатков (обычно 12 — 16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ.
2. Аллостерический центр (allos — чужой) — центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов.
Вопрос 7. Какую роль в составе фермента играют коферменты? Какие вещества в организме являются их предшественниками? Приведите примеры.
Коферменты — органические природные соединения небелковой природы, необходимые для осуществления каталитического действия ферментов. Коферменты вместе с функциональными группами аминокислотных остатков фермента формируют активный центр фермента, на котором происходит связывание с субстратом и образование активированного фермент — субстратного комплекса.
Витамины, участвующие в биохимических процессах, являются предшественниками коферментов (например, витамин В1) или собственно коферментами (например, липоамид).
Вопрос 8. Как осуществляется регуляция активности фермента?
Так, активность ферментов может регулироваться при связывании низкомолекулярных соединений в специальных регуляторных центрах катализатора или же за счёт взаимодействия ферментов с активаторами или ингибиторами.
Активность многих ферментов зависит от присутствия в среде катионов и анионов. Например, активатором амилазы слюны (фермента, расщепляющего крахмал и гликоген в ротовой полости) являются анионы хлора, активаторами енолазы (фермента, катализирующего одну из реакций гликолиза) являются Mg2+, Мn2+ и К+, каталаза и пероксидаза активируются ионами Fe2+, карбоангидраза и лактатдегидрогеназа — ионами Zn2+, фосфоглюкомутаза и холинэстераза — ионами Мn2+, аскорбатоксидаза и фенолоксидаза — ионами Сu2+. Активатором многих ферментов, например, Са — кальмодулин — зависимой протеинкиназы и многих липаз, являются ионы Са2+.
В качестве активаторов или ингибиторов ферментов могут выступать и другие низкомолекулярные соединения. Так, АТФ и цитрат (лимонная кислота) ингибируют один из ключевых регуляторных ферментов гликолиза — фосфофруктокиназу, тогда как АДФ и АМФ, наоборот, активируют этот фермент.
В активации ещё одного фермента углеводного обмена — гликогенфосфорилазы, расщепляющей гликоген в клетках печени, участвуют как низкомолекулярные соединения, так и многочисленные белки.
Вопрос 9. Приведите примеры химических реакций с участием катализаторов, укажите условия их протекания.
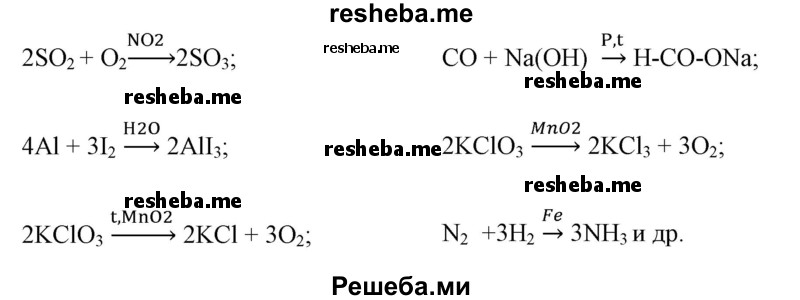
В некоторых случаях выбор катализатора влияет на путь химической реакции и, в конечном итоге, продукты реакции будут разные.
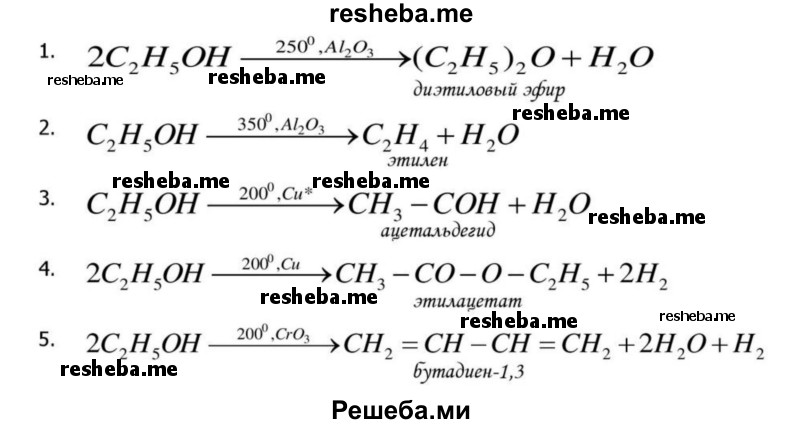
Вопрос 10. Из курса химии вам известно, что реакции, протекающие при участии катализаторов (никель, платина), требуют высоких температур и давления. Ферментативные процессы протекают в узких пределах изменения температуры и давления. Дайте объяснение этому факту.
Потому что биокатализаторы исключительно эффективны. При оптимальных условиях большинство ферментативных реакций протекает в 10 — 100 раз быстрее, чем те же реакции в отсутствие ферментов. Число оборотов (т. е. число молекул субстрата, превращаемых за одну минуту, на одну молекулу фермента) для большинства ферментов равно приблизительно 1000, а в некоторых случаях может превышать 104 . Следует при этом иметь в виду, что скорость отдельных стадий ферментативных реакций лимитируется диффузией реагирующих веществ или, во всяком случае, зависит от нее. Таким образом, многие химические реакции, которые обычно протекают только при высоких температурах или только в сильно кислой или сильно щелочной среде, в присутствии соответствующих ферментов могут идти быстро и количественно при комнатной температуре и при значениях pH, близких к нейтральному.
Вопрос 11. Почему белки редко используются организмами в качестве источника энергии для процессов жизнедеятельности?
Мономеры белков — аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками довольно редко.
Это невыгодно, выгоднее использовать липиды. Белки также выполняют много важных функций в организме.
Вопрос 12. Может ли один и тот же белок быть активатором одной, но при этом ингибитором другой реакции?
Может, например, протеинкиназа А одновременно способствует ингибированию синтеза гликогена и активации его распада.
Вопрос 13. Почему в качестве кофермента в активном центре присутствует низкомолекулярное вещество, а не пептидная цепь?
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Вопрос 14. Взрослые люди часто тяжело переносят повышение температуры тела на несколько градусов от нормы, что само по себе является важнейшей защитной реакцией организма против возбудителей целого ряда заболеваний. Как это может повлиять на работу ферментов и других физиологически важных веществ организма человека, имеющих белковую природу?
Активность ферментов зависит от температуры. Та температура, при которой активность фермента наибольшая, называется температурным оптимумом (opt — t°). Для организма человека opt — t° находится в пределах 36,6 — 40°С. Снижение t° приводит к уменьшению активности ферментов, а при очень низких температурах (0° — +4°С) ферментативная активность практически прекращается, т.к. резко изменяются кинетические свойства ферментов. Поэтому снижение активности ферментов имеет обратимый характер: при повышении температуры ферментативная активность полностью восстанавливается.
Так при увеличении температуры тела с 360С до 390С скорость биохимических процессов в организме увеличивается в 1,2 — 1,4 раза. При достижении определенной t для каждого фермента, это приводит к полной инактивации фермента, которая является необратимой. При повышении t, происходит денатурация белка — фермента, разрушение активного центра фермента, образование Е — S — комплекса становится невозможным, и ферментативная реакция прекращается.
Цель: доказать каталитическое действие белков — ферментов, показать их высокую специфичность, а также зависимость их действия от условий среды.
Ход работы:
1. Приготовление раствора слюны, содержащего фермент амилазу.
• Тщательно прополощите рот водой.
• Наберите 2—4 мл слюны в мерный цилиндр.
• Добавьте в цилиндр воды до объёма 10 мл.
2. В две пронумерованные пробирки налейте по 10 капель раствора крахмала.
3. В пробирку № 1 внесите 4 капли воды (контроль), а в пробирку № 2 — 4 капли раствора слюны.
В пробирке №2 под действием слюны (в которой содержится амилаза) произойдет расщепление крахмала на олигосахариды (сахарозу, а она до глюкозы и фруктозы).
4. Перемешайте и поставьте на водяную баню или в термостат на 15 мин при температуре 37°С.
5. Из пробирки № 2 возьмите 4 капли исследуемого вещества и внесите их в две разные пробирки (по две капли в каждую). В одну из них добавьте каплю раствора йода в иодиде калия. В другую — каплю раствора сульфата меди (II) и 4 капли раствора гидроксида натрия и осторожно нагрейте до кипения. Те же действия проделайте с содержимым контрольной пробирки (№ 1).
6. Оформите полученные результаты в виде таблицы.
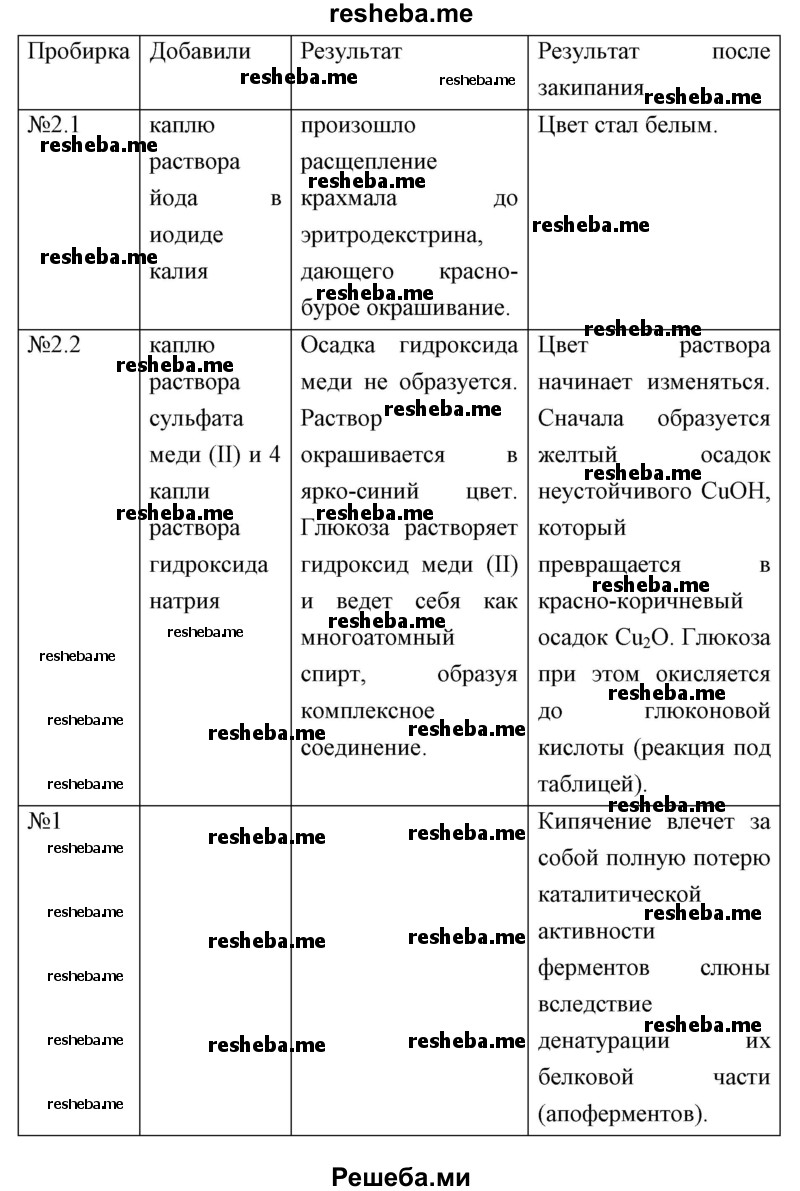
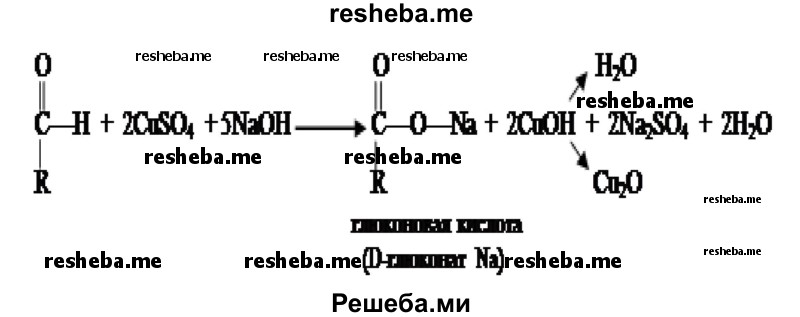
7. Сделайте вывод на основе проведённого исследования.
В качестве фермента, гидролизующего крахмал на его составные части (мальтозу, глюкозу), выступает амилаза слюны.
Каждый фермент действует только на одно вещество или группу сходных субстратов, что обусловлено соответствием структуры фермента, точнее его активного центра и структуры субстрата. Например, амилаза действует только на крахмал.
Мы также убедились в том, что фермент действует в зависимости от условий среды.
Что такое катализатор?
Если у вас много работы, которую нужно выполнить, выполнение ее в одиночку займет значительное время. Однако, если кто-то помогает вам выполнить работу, это ускоряет процесс, и работа выполняется быстрее. Катализатор делает то же самое, что и дополнительный человек; это заставляет процесс или химическую реакцию начинаться или заканчиваться быстрее. Фермент, который также является катализатором, облегчает работу человеческого организма, ускоряя мелкие процессы в организме.
Например, обычная реакция разрыва пептидной связи может занять около 400 лет при комнатной температуре, поэтому нам явно нужно что-то, чтобы ускорить процесс. Ферменты так резко ускоряют реакцию, что они могут быть и нашими биологическими супергероями.
Этот пример должен дать вам некоторое представление о том, в какой степени ферменты необходимы для телесных процессов и устойчивости. Учитывая, что ферменты так важны для нашего метаболизма, давайте рассмотрим детали их функционирования и назначения.
Как работают ферменты?

Во время использования пружина растягивается и меняет свою форму, но после завершения работы она возвращается к своей первоначальной форме. Ферменты работают аналогичным образом. Во время химической реакции фермент может изменить свой состав или форму, чтобы ускорить реакцию, и после выполнения задачи он возвращается в исходное состояние, не оставляя постоянных изменений в ферменте.
Ингибирование
В примере, когда вы работаете с кем-то еще (упомянуто выше), когда вы думаете, что работа сделана, вы можете попросить другого человека прекратить работу, но нельзя попросить ферменту прекратить работу. К счастью, существуют материалы, называемые ингибиторами, которые заставляют ферменты перестать работать. Этот процесс остановки называется торможением.
Два типа торможения:
Подумайте об этом таким образом. представьте, что вы пытаетесь зажечь огонь с помощью поленьев. Если будет сильный ветер, он потушит огонь, но если сила ветра уменьшится, вы сможете зажечь костер. С другой стороны, если вы плеснете воду на свой огонь, вы не только потушите костер, но и намочите поленья, а это означает, что вы не сможете снова зажечь огонь с помощью тех же самых материалов.
Это тот же принцип в обратимом торможении. В присутствии ингибитора фермент не может производить продукт, но в отсутствие ингибитора фермент мог бы производить продукт!

При необратимом ингибировании, когда ингибитор останавливает фермент на мгновение, даже в отсутствие ингибитора фермент не сможет продуцировать продукт.
Фермент по своей природе имеет разные положение - активный и неактивный.

Представьте себе две дороги, одна из которых шире и часто используется, а другая - гораздо более узкая, которая используется очень редко. Оба доставят вас в одно и то же место, но это разные дороги. Это касается активных и неактивных положении соответственно. Более широкая дорога - это активный положение, который в основном используется для связывания и реакций. Другой более узкой дорогой является неактивное положение, который в основном используется ингибиторами для связывания при слишком большом движение.
Три типа обратимого торможения
Прежде чем мы перейдем к трем видам торможения, нам нужно представить сценарий. Представьте, что вы хотите сделать какую-то работу; когда ваше тело и ваше намерение объединяются, происходит работа, которая приводит к завершению конечного продукта работы. Фермент здесь - это вы, намерение - это субстрат (химическое вещество, с которым реагирует фермент), вы и ваше намерение ведут к работе, а работа - это эквивалент комплекса, образованного реакцией фермента и субстрата (называемого ферментным субстратным комплексом). Конечный продукт - выполняемая работа - является эквивалентом конечного продукта реакции.
Конкурентное торможение
Принимая во внимание сценарий, упомянутый выше, представьте, что вы должны работать, но чувствуете себя ленивым, что конкурирует с вашим намерением работать. Это может сделать вас ленивым до такой степени, что вы не будете двигаться, и лень будет бороться с вашим намерением выполнять работу, но если бы вы могли избежать лени, вы бы сделали эту работу. Это называется конкурентным торможением. Ингибитор реагирует со свободным ферментом на первой стадии, и затем фермент должен конкурировать за связывание либо с субстратом, либо с ингибитором.
Неконкурентное торможение
Представьте себе другой сценарий, в котором вы здоровы и хотите работать, но ваш интернет работает медленно. Это может проявиться двумя способами: медленный интернет влияет на вашу работу, и вы не можете этого сделать, несмотря на свои намерения, или в конечном итоге вы разочарованы медленным интернетом и больше не хотите выполнять эту работу. Это называется неконкурентным ингибированием, при котором ингибитор может связываться либо со свободным ферментом, либо с комплексом ферментного субстрата.
Неконкурентное торможение
Наконец, представьте себе сценарий, в котором вы находитесь с намерением работать, но из-за того, что батарея вашего компьютера умирает, ваша работа не была сохранена. Это называется неконкурентным торможением, при котором ингибитор связывается только с комплексом ферментных субстратов и, таким образом, затрагивается только работа.
Во всех трех случаях, при отсутствии лени, медленного интернета или разряженной батареи, вы можете завершить работу гладко. Точно так же, в отсутствие ингибитора, фермент работал бы отлично, и реакция шла бы к завершению. Это всего лишь краткое понимание того, как крошечные ферменты помогают нашему организму функционировать!
Катализатором, или ферментом (в случае биохимической реакции), называется вещество, помогающее протеканию химической реакции, но не изменяющееся в ходе нее.
Скорость протекания химической реакции можно значительно увеличить, если добавить вещество, которое участвует в этой реакции, но при этом само не расходуется. Чтобы лучше это понять, представим себе работу брокера по операциям с недвижимостью. Брокер находит и собирает вместе людей, желающих продать какое-либо имущество, и людей, желающих его купить, таким образом способствуя его продаже и передаче другому владельцу. При этом сам брокер в ходе сделки ничего реально не покупает и не продает. Так же и катализатор, или фермент, способствует протеканию реакции между двумя веществами, но к концу реакции остается в первоначальном виде.
Подалуй, самый известный катализатор находится у нас в машине, в каталитическом нейтрализаторе отработавших газов. Он представляет собой мелкоячеистую металлическую сетку, сделанную из палладия и платины, через которую пропускаются выхлопы из автомобильного двигателя. Эти металлы катализируют ряд химических взаимодействий. Во-первых, они абсорбируют окись углерода (CO), окись азота (NO) и кислород, причем каждая молекула NO распадается на составляющие ее атомы. CO соединяется с атомом кислорода, образуя диоксид углерода, а атомы азота соединяются, и получаются молекулы азота. В то же время избыток кислорода дает возможность углеводородам, не до конца сгоревшим в автомобильных цилиндрах, полностью окислиться до диоксида углерода и воды. Вот так выхлопные газы, которые содержат окись углерода (смертельный яд) и вещества, приводящие к кислотным дождям, а также несгоревшие фрагменты исходных молекул бензина, превращаются в относительно безвредную смесь диоксида углерода, азота и воды.
Чтобы понять действие ферментов, необходимо знать, что для взаимодействия сложных органических молекул недостаточно их простого контакта. Чтобы реакция протекала, определенные атомы в сближающихся молекулах должны быть правильно сориентированы друг относительно друга (так же как ключ определенным образом должен быть вставлен в замок), только тогда смогут образоваться химические связи. То есть для химических процессов, протекающих в биологических системах (см. Биологические молекулы), чрезвычайно важную роль играет пространственная геометрия.
В биохимии крайне мала вероятность того, что две сложные молекулы, предоставленные сами себе, случайно окажутся друг относительно друга в правильной ориентации, необходимой для взаимодействия. Чтобы такая реакция протекала с ощутимой скоростью, нужна помощь молекул определенного типа — ферментов. Фермент притягивает к себе две другие молекулы и удерживает их в правильном положении, чтобы взаимодействие состоялось. Как только реакция произошла, фермент освобождается и повторяет те же действия с другим набором молекул. Все ферменты в биологических системах представляют собой белки, которые могут принимать разнообразные сложные формы. Как и все белки, они закодированы в ДНК и в качестве ферментов управляют скоростью протекания химических реакций.
Флогистон 02.12.2005 08:21 Ответить
Если это сайт для ученых, а не для школьников, то и определения должны
быть не списаны из школьных учебников!
Например, первая строчка "Катализатором, или ферментом (в случае биохимической реакции), называется вещество, помогающее протеканию химической реакции, но не изменяющееся в ходе нее."
Но почему же не так: "Катализатором называется вещество, способствующее увеличению скорости химической реакции путем снижения энергии активационного барьера, и тем самым обеспечивающее более быстрое достижение состояния термодинамического равновесия. Как правило, катализатор не претерпевает химических превращений в ходе химической реакции. Ферменты или биокатализаторы - это вещества белковой природы, катализирующие биохимические реакции. В отличи от небелковых катализаторов ферменты (энзимы) крайне реакционно-специфические катализаторы, т.е. фермент способен катализировать лишь очень небольшое число реакций, часто только одну.
algen Флогистон 02.12.2005 11:23 Ответить
Но все же не стоит путать научность с наукообразием. Вовсе не в том цель, чтобы каждое объяснение было фундаментальным. Обычно гораздо важнее, чтобы оно было понятным.
Флогистон algen 02.12.2005 12:14 Ответить
Спасибо за информацию! Полезу в соответствующий раздел.
Но по поводу "Обычно гораздо важнее, чтобы оно было понятным" позвольте не согласиться - гораздо важнее, что бы объяснение было правильным и не грешило двусмысленностью.
algen Флогистон 02.12.2005 13:01 Ответить
Какова ценность точного объяснения, если оно осталось непонятым? Человеческое понимание устроено так, что сразу воспринять предельно точные формулировки трудно. Поэтому сначала обычно дается некая неточная, но наводящая на правильные представления мысль. Потом, по мере того, как у человека накапливается опыт, а практика показывает недостаточность упрощенного объяснения, появляется нужда в уточнении. Главное, что читатель в этот момент готов к восприятию более точного понятия, он правильно поймет и оценит все тонкости формулировки. А если дать такое объяснение раньше времени, то возникнет ощущение сумбура и человек ничего не поймет и не запомнит.
Флогистон algen 02.12.2005 13:41 Ответить
Я преподаватель ВУЗа с немалым стажем, точная формулировка с последующим объяснением - это лучшее, что может дать учитель ученику. А Ваш подход - он повсеместно реализован в наших школах. И детишек потом приходится переучивать, предлагая забыть "..некая неточная, но наводящая на правильные представления мысль..", поскольку неподготовленый человек никогда не будет заниматься обдумыванием и додумыванием самостоятельно, и запоминать сразу точное и, главное, правильное определение. В итоге имеет место колоссальный разрыв между школой и ВУЗом, из-за которого вчерашние отличники превращаются в неуспевающих студентов. Специфика любого научного знания - это чистая, незамутненная мысль, и к этому нужно готовить сразу, а не потом.
И с чего это Вы взяли, что "Человеческое понимание устроено так, что сразу воспринять предельно точные формулировки трудно"? То что есть естественники и гуманитарии - это давно известно, но Ваш сайт не на школьников-гуманитариев ориентирован я надеюсь :)
alexsmail Флогистон 16.09.2006 18:51 Ответить
Как выпускник гимназии с углубленным изучением математики, физики и английского, а также как выпускнив ВУЗа (за рубежом) по математике и компьютерным наукам позвольте с вами не согласиться. Когда слышишь первый раз определение хочется услышать именно "..некая неточная, но наводящая на правильные представления мысль..". Затем можно привести несколько примеров, показывающие недостатки данного определния и дать правильное, точно определение. С лекции студент должен уйти именно с неточным определением и чётким предствалением, какие у него есть изъяны. Затем, дома или перед сессией, студент выучит точное определение.
В школе же нужно говорить правильные вещи. Например, говорить, что "квадратное уравнение с отрицательной дискриминантой не имеет решения" не верно. Нужно говорить "квадратное уравнение с отрицательной дискриминантой не имеет решения в действительных числах". И не важно, что дать вразумительный ответ школьнику, почему эта оговорка важна, сложно, я бы сказал не возможно, ведь он других чисел не знает, поэтому даже дача абсолютно точного определения действительного числа не поможет. Если этого не делать, то школьник, столкнувший с комплексными, числами испытает шок, он будет считать, что его обманывали.
Зачастую говоря о витаминах, минералах и других полезных для человеческого организма элементах упоминаются вещества, которые называются ферментами. Что такое ферментативный катализ и как он происходит в организме человека вы узнаете, дочитав эту статью до конца.
Строение атома и химические связи
Взаимодействие молекул
Чтобы молекулы вступили во взаимодействие и перераспределились внешние электроны составляющих их атомов, разорвались одни связи и замкнулись другие, этим им необходимо находиться в достаточно активном состоянии. Известно, что повышение температуры ускоряет химические реакции. Это объясняется тем, что тепловая энергия увеличивает число молекул, находящихся в активированном состоянии. Количество энергии, которое вещества должны получить дополнительно для того, чтобы между ними пошел процесс, называется энергией активизации. Это количество энергии, достаточное для того, чтобы большинство молекул преодолело так называемый энергетический барьер. Когда взаимодействие заканчивается, ее продукты находятся на более низком энергетическом уровне, чем исходные вещества, то есть в более устойчивом состоянии.
Как работают катализаторы?
Сущность действия катализаторов состоит в том, что они понижают энергетический барьер реакции, направляют ее как бы в обход этого барьера.
Представьте себе лыжника, стоящего перед лестницей к трамплину, с которого ему предстоит прыгнуть. Чтобы начать спуск, ему необходимо предварительно затратить некоторое количество энергии, для попадания на площадку перед трамплином. И тогда ему хватит небольшого толчка, для полета.
Теперь допустим, что перед нашим лыжником имеется ровная тропинка, ведущая на спуск с трамплина в обход лестницы. Чтобы начать спуск, пройдя этой тропинкой, ему требуется гораздо меньшая затрата энергии, чем для подъема на площадку по лестнице; стоящий перед ним энергетический барьер окажется менее высоким. Но при этом величина свободной энергии спуска будет такой же, как при спуске с площадки.
Для чего нужны ферменты и что такое ферментативный катализ
Ферментативный катализ отличается от катализа неферментативного тремя важными особенностями.
Первая — это большая специфичность ферментов (катализаторов). Если катализатор-нефермент, так сказать, облегчает осуществление множества различных хим. реакций, убыстряя их, то фермент катализирует химические превращения веществ, имеющих строго специфическое строение и не оказывает воздействие на остальные субстраты (вещества, химические превращения которых катализируются определенным ферментом).
Вторая – заключается в том, что ферменты действуют при мягких условиях внешней среды. Они не требуют высоких температур, резко кислой или очень щелочной реакции среды, повышенного во много раз давления — условий, при которых невозможна жизнь.
Третья – чрезвычайно высокая молекулярная активность ферментов; 1 молекула фермента катализирует за 1 минуту превращения множество молекул субстрата. Под действием биологических катализаторов — ферментов реакции идут в десятки тысяч, подчас в миллионы раз быстрей, чем под влиянием неорганических-катализаторов.
Ферментативный катализ по эффективности более высок по сравнению с неорганическими. Это объясняется тем, что он сильней уменьшает энергию активации. Также эффективней облегчается преодоление энергетического барьера реакции, увеличивает число активированных, способных к реакции молекул, и потому ее ускоряет.
Ферментативный катализ на первое его стадии заключается в том, что фермент соединяется с субстратом и образуется фермент-субстратный комплекс.
Формирование и последующее превращения фермент-субстратного комплекса разделяют на несколько стадий:
- соединение молекул фермента и субстрата;
- преобразование первичного фермент-субстратного комплекса в один или несколько последовательных комплексов, находящихся в активированном состоянии — химические связи легче могут разорваться;
- отделение конечных продуктов реакции от фермента.
Освободившаяся молекула фермента способна вновь вступать в оборот — соединяться с новой порцией субстрата.
Непосредственное участие в каталитическом действии принимает не вся молекула фермента, а лишь часть ее, которая называется активным центром фермента. Важнейшая составная часть активного центра — его каталитически активный участок, непосредственно взаимодействующий с субстратом. Наряду с этим принято выделять в составе активного центра так называемый контактный, или якорный участок (площадку), который обеспечивает связывание фермента с субстратом. Для многих ферментов уже выяснено, какие аминокислоты входят в состав их активных центров.
Как происходит ферментативный катализ на химическом уровне
Как протекает ферментативный катализ изучен еще не до конца, в частности не совсем ясно, каким образом активируется субстрат, какой вид приобретает его молекула в том активированном, переходном состоянии, при котором облегчен разрыв и замыкание связей в молекуле. Одни из объяснений дает так называемая теория деформации субстрата.
Возьмем соединение А—В. Связь между A и В разорвана с присоединением к А—В молекулы воды. При этом вода присоединяется таким образом, что за счет освободившейся валентности к А присоединяется одна часть молекулы воды — группа ОН (гидроксильная группа), а к молекуле В — второй атом водорода, входивший в молекулу воды. Такой тип химических реакций называется реакциями гидролиза — распад молекулы с присоединением к продуктам распада остатков молекулы воды. Ферменты, катализирующие такой тип реакции, называют гидролитическими ферментами. К такому типу реакций относятся реакции расщепления белков, углеводов и жиров в органах пищеварения. Например, молекула обычного сахара состоит из двух простых сахаров: глюкозы и фруктозы, соединенных между собой.
Если связь между ними с присоединением воды разорвется, молекула сахарозы расщепится на молекулу глюкозы и молекулу фруктозы. Таким образом, под соединением А—В мы можем подразумевать сахарозу, под А — глюкозу и под В — фруктозу. Реакция гидролиза сахарозы катализируется ферментом сахаразой, который является каталитически активным белком.
Как происходит ферментативный катализ в организме человека
По местам освободившихся связей к молекуле субстрата или ее остатку могут присоединяться другие атомы или группа атомов — синтезируются новые соединения. Такие реакции катализируются особым классом ферментов — синтетазами. Отщепившиеся от молекулы атомы и их группы за счет действия ферментов, именуемых трансферазами, могут быть перенесены на молекулы других соединений с образованием при этом новых молекул.
За счет действия ферментов, называемых оксидоредуктазами, продукты расщепления белков, углеводов, жиров подвергаются глубокому распаду путем их окисления. В результате такого процесса углерод пищевых веществ окисляется до углекислоты, водород — до воды, азот восстанавливается до аммиака. Те продукты обмена веществ (метаболиты), которые в организме подвергаются далее тем или иным превращениям, называются промежуточными продуктами, а те что дальнейшим превращениям не подвергаются, а удаляются из организма являются конечными.
Например: крахмал пищи под действием пищеварительных ферментов подвергается гидролизу, расщепляясь при этом на большое число молекул глюкозы. Глюкоза поступает в клетки тела. В них она подвергается многочисленным превращениям, в ходе которых она преобразуется в различные необходимые организму продукты: холестерин, гормоны и многие другие. Основная же масса продуктов распада глюкозы в итоге многоэтапных превращений, на разных стадиях катализируемых различными ферментами, вступает в конце концов в окислительно-восстановительные реакции и полностью окисляются до углекислоты и воды. В ходе этого окисления глюкозы освобождается необходимая для жизнедеятельности энергия.
Вообще процессы распада пищевых веществ идут с освобождением энергии. Такие реакции называются экзэргоническими. Процессы биологического синтеза протекают с потреблением энергии и называются эндэргоническими. Наиболее эффективный способ освобождения энергии пищевых веществ — глубокий их распад путем окисления. Энергия для этих процессов используется организмом как для производства различных видов работы (сокращение мышц и др.), так и для процессов биосинтеза.
Вывод
На это мы закончим. В этой статье по подробно разобрали что такое ферментативный катализ и как он происходит. Если вам статья понравилась и стала полезной, поделитесь ей со своими знакомыми и друзьями в соц сетях.
Читайте также:

