Анализ и методика изложения темы изменение агрегатного состояния вещества
Обновлено: 07.07.2024
- обучающие – сформулировать представление о свойствах твёрдых тел, газов, жидкостей.
- развивающие – развитие учащихся навыков речи, анализа, выводы по пройденному и изученному материалу.
- воспитательные – привитие умственного труда, создание всех условий,для повышения интереса к изученному предмету.
Основные термины:
Агрегатное состояние - это состояние вещества, которое характеризуется определёнными качественными свойствами: - способность или неспособность сохранять форму и объём; - наличие или отсутствие ближнего и дальнего порядка; - другими.
Плавление – это когда вещество из твёрдого состояния переходит в жидкое.
Парообразование - переход вещества из жидкости в газ.
Сублимация - переход сразу в газ из твёрдого тела, минуя жидкое.
Ход урока:
Проверка домашнего задания.
1. Из чего состоят все тела?
2. Как называется явление, при котором вещества перемещаются сами собой?
3. Приведите пример твёрдых тел.
4. Приведите пример газов.
5. Приведите пример вещества в жидком состоянии.
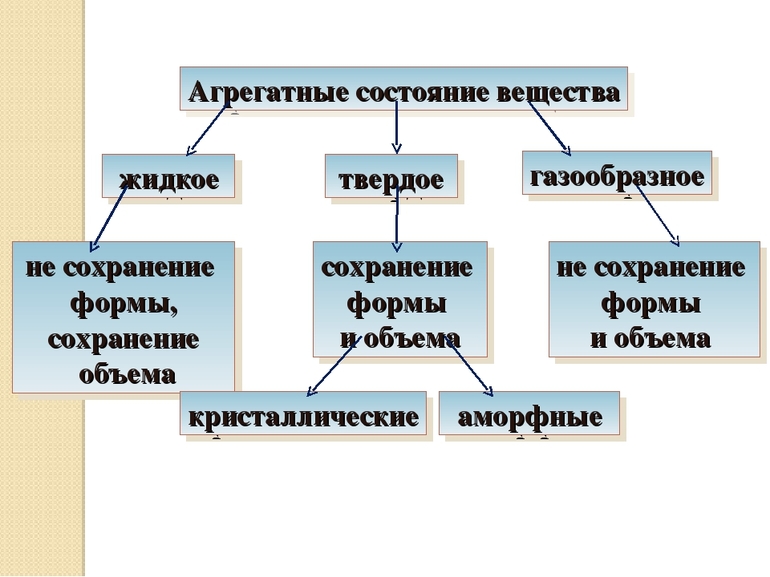
Агрегатные состояния.
Агрегатное состояние – это состояние вещества, которое характеризуется определёнными качественными свойствами: - способность или неспособность сохранять форму и объём; - наличие или отсутствие ближнего и дальнего порядка; - другими. Если агрегатное состояние изменяется, то это может сопровождаться скачкообразными переменами энтропии, свободной энергии, плотности и других физических свойств.
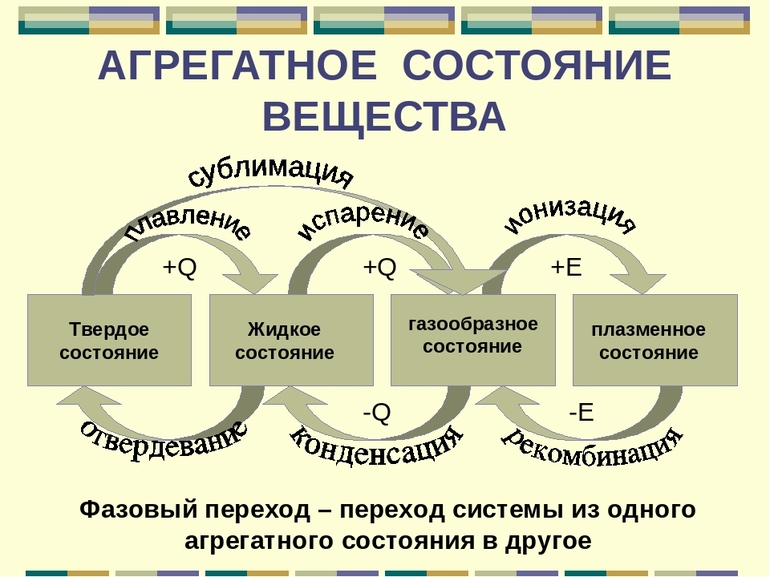
Все вещества существуют в трех агрегатных состояниях: жидком, твёрдом и газообразном. Четвертое агрегатное состояние вещества является плазма. (Рисунок 1)
Рис.1. Агрегатное состояние вещества.
Когда один переходит в другой, это сопровождается скачкообразным изменением ряда физических свойств (теплопроводности, плотности и др.). Наличие у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимосвязи при различных условиях.
В этом видео показаны три состояния вещества
Твёрдое тело.
Его состояние характеризуется свойством сохранять форму и объём. Атомы твёрдого тела исполняют всего лишь небольшие колебания вокруг состояния равновесия. В твёрдом теле присутствует как ближний порядок, так и дальний. (рисунок 2)

Рис.2. Твёрдое тело.
Жидкость.
Его состояние, при котором оно владеет маленькой сжимаемостью (хорошо сохраняет объём, но не способно сохранять форму). Жидкость легко может принимать форму любого сосуда, в который она будет помещена. Молекулы или атомы жидкости выполняют колебания вблизи состояния равновесия и часто перескакивают на свободные места. В жидком состоянии присутствует только ближний порядок. (рисунок 3)

Рис.3. Жидкость.
Состояние газа характеризуется хорошей сжимаемостью. Отсутствие способности сохранять как форму, так и объём. Газ занимает весь объём, который ему предоставлен. Молекулы и атомы газа ведут себя относительно свободно. Расстояния между атомами и молекулами гораздо больше их размеров. (Рисунок 4)

Плазма.
Плазму часто относят к агрегатным состояниям вещества. Она отличатся от газа большой степенью ионизации атомов. В состоянии плазмы находится большая часть барионного вещества (по массе около 99,9%). (Рисунок 5)

Рис.5. Плазменная декоративная лампа.
Вот ещё на одном видеоролике можем рассмотреть агрегатные состояния вещества.
Выводы.
В зависимости от различных условий одно и то же вещество имеет свойство находиться в различных агрегатных состояниях. Молекулы в веществе находятся в жидком, твёрдом или газообразном состоянии и не отличаются друг от друга.
Агрегатное состояние вещества можно определить расположением, взаимодействием и характером движения молекул. (рисунок 6)
Рис.6. Агрегатное состояние вещества при изменении температуры.
Когда вещество из твёрдого состояния переходит в жидкое, то это называется плавлением, обратный процесс – кристаллизацией. При переходе вещества из жидкости в газ, этот процесс называется парообразованием, в жидкость из газа – конденсацией. А переход сразу в газ из твёрдого тела, минуя жидкое – сублимацией, обратный процесс – десублимацией.
1. Кристаллизация; 2. Плавление; 3. Конденсация; 4. Парообразование;
5. Сублимация; 6. Десублимация.
Эти примеры переходов мы постоянно наблюдаем в повседневной жизни. Когда лед плавится, он превращается в воду, а вода в свою очередь испаряется, и образовывается пара. Если рассматривать в обратную сторону то, пар, конденсируясь, начинает переходить снова в воду, а вода в свою очередь, замерзая, становится льдом. Запах любого твёрдого тела – это сублимация. Часть молекул вырывается из тела, при этом образовывается газ, который и даёт запах. Пример обратного процесса – это в зимнее время узоры на стекле, когда пар в воздухе при замерзании оседает на стекле.
На видео показано изменение агрегатных состояний вещества.
Контролирующий блок.
1. После замерзания, вода превратилась в лёд. Изменились, ли при этом молекулы воды?
2. В помещении пользуются медицинским эфиром. И из-за этого обычно им сильно там пахнет. В каком состоянии находится эфир?
3. Что происходит с формой жидкости?
4. Лёд. Это какое состояние воды?
5. Что происходит когда замерзает вода?
Домашнее задание.
Ответить на вопросы:
1. Можно ли на половину объёма сосуда заполнить его газом? Почему?
2. Могут ли быть при комнатной температуре в жидком состоянии: азот и кислород?
3. Могут ли быть при комнатной температуре в газообразном состоянии: железо и ртуть?
4. В морозный зимний день над рекой образовался туман. Какое это состояние вещества?
Интересно знать, что.
Мы считаем, что у вещества существует три агрегатных состояния. На самом же деле их как минимум пятнадцать, при этом список этих состояний продолжает расти с каждым днём. Это: аморфное твёрдое, твёрдое, нейтрониум, кварк-глюонная плазма, сильно симметричное вещество, слабо симметричное вещество, фермионный конденсат, конденсат Бозе-Эйнштейна и странное вещество.
Список литературы:
Отредактировано и выслано Борисенко И.Н.
Над уроком работали:
Поставить вопрос о современном образовании, выразить идею или решить назревшую проблему Вы можете на Образовательном форуме, где на международном уровне собирается образовательный совет свежей мысли и действия. Создав блог, Вы не только повысите свой статус, как компетентного преподавателя, а и сделаете весомый вклад в развитие школы будущего. Гильдия Лидеров Образования открывает двери для специалистов высшего ранга и приглашает к сотрудничеству в направлении создания лучших в мире школ.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Анализ урока учителя физики Веретновой Анны Васильевны
Цель посещения : Определение обоснованности и правильности отбора методов, приемов и средств обучения, их соответствие содержанию учебного материала, поставленным целям урока, учебным возможностям данного класса и соответствие различных способов формирования у учащихся мотивации к учению.
Тема урока: Агрегатные состояния вещества.
Цель урока : способствовать формированию представления о некоторых механических свойствах твердых тел, жидкостей, газов; развитию речевых навыков, умений анализировать, делать выводы по изученному материалу; созданию условий повышения интереса к изучаемому предмету .
Планируемые образовательные результаты:
Предметные : знать о механических свойствах твердых тел, жидкостей и газов; уметь объяснить эти свойства на основе знаний о различиях в расположении, движении и притяжении молекул , выполнять опыты по обнаружению действия сил молекулярного притяжения.
Метапредметные : умение находить, преобразовывать и передавать информацию; выполнять различные социальные роли в группе и коллективе, овладение навыками самоконтроля и оценки результатов своей деятельности, умениями предвидеть возможные результаты своих действий; использовать современные телекоммуникационные технологии.
Личностные: формирование познавательных интересов, убежденность в возможности познания природы, в необходимости разумного использования достижений науки и технологий для дальнейшего развития человеческого общества, самостоятельность в приобретении новых знаний и практических умений.
Методы и формы обучения : эвристический метод; индивидуальная, групповая, фронтальная.
Оборудование : экран, компьютер, мультимедийный проектор, твердые тела различной формы, сосуды различной формы, мензурки, резиновый шарик, ножницы.
Наглядно-демонстрационный материал : мультимедийный ряд: презентация по теме урока, выполненная учителем.
Организационный момент - учитель проверяет настрой обучающихся на урок, готовность рабочего места, создаёт ситуацию успеха.
Мотивация на урок начинается с эмоционально-психологической подготовки к усвоению изучаемого материала. В классе установлена обстановка психологического комфорта и эмоциональной приподнятости, при этом продуктивность учащихся заметно повышается, что в итоге привело к более качественному усвоению знаний, к более высоким результатам урока.
На организационно-деятельностном этапе урока происходит проверка ранее изученного материала (учащиеся решают кроссворд). Далее идет эвристическая беседа, в ходе которой учитель организует и сопровождает деятельность обучающихся. Учащиеся обдумывают ответы на вопросы, выполняют практические задания. Учитель подводит их к формулировке вывода. Учащиеся заполняют таблицу.
Далее учитель проводит физминутку, где учащиеся выполняют упражнения совместно с учителем.
Затем учитель задает вопрос: вода, лед, водяной пар – это состояния одного и того же вещества, а значит, молекулы не отличаются друг от друга, почему же эти вещества обладают столь различными свойствами?
На этапе целеполагания и построения проекта выхода из затруднения раскрывается сущность новых понятий, усвоение новых способов учебной и умственной деятельности учащихся. Учащиеся разделены на 3 группы. Каждая группа работает со справочными материалами из сети Интернет. Учащиеся отбирают необходимую для ответа на проблемный вопрос информацию. Один человек из группы дает полный ответ с примерами.
Учитель целенаправленно работает над формированием учебно-организационных умений. Смена видов деятельности способствует подъему мотивации, познавательной активности учащихся. Урок построен методически грамотно с использованием здоровьесберегающих технологий. Учитель создает ситуацию успеха для каждого ученика, учит думать, делать выводы. Активность и работоспособность учащихся в течение всего урока высокая.
Технология системно-деятельностного подхода способствует самообразованию и самоконтролю, развитию умений анализировать, делать выводы.
Учитель использует в работе методические приёмы, формирующие прочность знаний учащихся. Для достижения результата учитель большое внимание уделяет практической и самостоятельной работе учащихся. Анна Васильевна умеет держать внимание учащихся на всех этапах урока, используя смену деятельности. Учитель наблюдает за каждым учащимся, выявляет затруднения и ошибки, акцентирует на них внимание, чтобы предупредить их повторение другими учениками. Учитель на протяжении всего урока создает условия для устранения перегрузки учащихся и овладения новым учебным материалом непосредственно на уроке.
На рефлексивно-оценочном этапе педагог использует тестовый контроль знаний с использованием мультимедиа - выбрать правильный ответ. Взаимопроверка учащихся и выставление оценок.
Урок построен в рамках технологии интерактивного обучения с элементами технологий: здоровьесберегающей, дифференцированного обучения, критического мышления, ИКТ.
Учитель использует различные формы обучения: индивидуальная, групповая, фронтальная. Такие формы обучения оказывают стимулирующее действие на учащихся, снижается чувство скованности. В ходе диалога у учащихся развивается логика рассуждений, самостоятельность мышления, формируется положительная мотивация к обучению.
Урок проведен в соответствии с современными требованиями ФГОС к структуре урока и типу. Структура урока хорошо продумана. Этапы урока соблюдены. Методы, приемы и средства обучения соответствуют содержанию учебного материала, поставленным целям урока, возрастным способностям учащихся. Применение на уроке ИКТ было целесообразно и обосновано. Использовались презентации ( Power Paint ). Компьютерная поддержка способствует реализации личностно-ориентированного подхода, который развивает интерактивную деятельность учащихся.
Таким образом, на данном уроке учителем подготовлена система заданий и вопросов, направленных на вовлечение учащихся в учебную деятельность, при которой формируются различные виды УУД. Дидактические материалы направлены на организацию познавательной деятельности, включающую значительную долю самостоятельной работы. Такое построение урока
является условием развития мотивации к учению.
Заместитель директора по УВР/_________________/ Л.А.Ишутина
должность подпись ФИО
Материал по 7-10 классам, акцентируется внимание на логичность изложения МКТ, полготовке к её изучению.
| Вложение | Размер |
|---|---|
| referat.doc | 79 КБ |
Предварительный просмотр:
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ОДИНЦОВСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №9 им.М.И.НЕДЕЛИНА
Реферат на тему:
ПОДГОТОВИЛА учитель физики МБОУ СОШ №9 им. М.И.Неделина
МУНТЯН ТАТЬЯНА ВЕНЕДИКТОВНА
- Введение __________________________________________3
- Основной раздел ______________________________________4
а) изучение темы в 7 классе; _______________________________4
б) изучение темы в 8 классе; _______________________________6
в) изучение темы в 10 классе; ______________________________10
3. Заключение ___________________________________________16
4. Список литературы _____________________________________18
В стандарте основного общего образования по физике сказано, что изучение физики в основной школе направлено на достижение следующих целей:
- освоение знаний о тепловых явлениях;
-овладение умениями проводить наблюдения, описывать и обобщать результаты;
-использование полученных знаний и умений для решения практических задач повседневной жизни, обеспечения безопасности своей жизни, рационального природопользования и охраны окружающей среды.
Изучение темы в 7-ом классе:
СТРОЕНИЕ ВЕЩЕСТВА МОЛЕКУЛЫ
Атом (atomos (греч.)- неделимый) – мельчайшая частица химического элемента, носитель его свойств.
Молекула (moles(лат.)- масса) – наименьшая частица вещества, обладающая его химическими свойствами, состоит из атомов.
Греческий ученый Демокрит (460-370 до н.э.) считал, что мир состоит из бесчисленного множества частиц (атомов) и пустоты. Атомы – плотные образования, различающиеся лишь по форме и размерам и не имеющие тех разнообразных свойств, которыми обладают тела – различные сочетания этих атомов.
ДВИЖЕНИЕ ЧАСТИЦ ВЕЩЕСТВА
Частицы любого вещества находятся в постоянном беспорядочном движении. Чем быстрее движутся частицы, тем выше температура вещества. Явление диффузии, когда вещества смешиваются сами собой, подтверждает движение частиц.
ВЗАИМНОЕ ПРИТЯЖЕНИЕ И ОТТАЛКИВАНИЕ МОЛЕКУЛ.
Частицы любого вещества находятся на вполне определенном расстоянии друг от друга, притягиваются друг к другу, но не могут сблизится, потому что при этом возрастает их отталкивание.
Три состояния вещества
Притяжение между молекулами больше, чем в жидкостях
Расстояние между молекулами меньше размеров молекулы, притяжение значительное
Молекулы почти не притягиваются друг к другу
Молекулы или атомы колеблются около определенной точки
Скачками могут менять свое положение
Движутся хаотично во всех направлениях
Сохраняют форму и объем
Принимают форму сосуда, они текучи, сохраняют объем, плохо сжимаемы
Занимают весь предоставленный объем, сжимаемы, не имеют своей формы
При изучении тепловых явлений обязательно проводятся примеры: нагревание воды, охлаждение камня. Вводится понятие теплового движения и температуры как меры степени нагретости тел. На первых уроках идет повторение строения вещества, нужно вспомнить о движении молекул в твердых телах, жидкостях и газах. Обратить внимание учащихся на связь между скоростью движения молекул и температурой тела. Необходимо объяснить зависимость внутренней энергии от температуры тела, агрегатного состояния вещества и степени деформации тела.
Внутренняя энергия тела не зависит от механического движения тела и от положения тела относительно других тел. Если говорить о расположении, характере движения и взаимодействии молекул в разных в агрегатных состояниях, обязательно следует опираться на понятие кинетической энергии.
Например, в твердых телах и жидкостях средняя кинетическая энергия молекул меньше работы по преодолению сил молекулярного притяжения, поэтому молекулы и не удаляются друг от друга.
В газах молекулы разлетаются, так как притяжение молекул газа мало вследствие большого значения средней кинетической энергии молекул газа, да и расстояние между молекулами много больше размера самих молекул.
При изучении плавления и отвердевания кристаллических тел важно обратить внимание учащихся на наличие горизонтальных участков графика плавления и отвердевания, на симметричность графика. Вещество плавится и отвердевает при одной и той же температуре – она называется температурой плавления ( t пл.). сначала вещество нагревается, а потом начинает плавиться. Сначала вещество отвердевает, потом охлаждается.
ГРАФИК 1 (рис 16, стр.33 учебник Пёрышкин А.В. Физика 8)
ГРАФИК 2 (рис 270, В.И.Лукашик , Сборник задач по физике)
ГРАФИК 3 (рис. 269, В.И. Лукашик, Сборник задач по физике)
Ряд веществ не имеет определенной температуры плавления, например: стекло, асфальт, воск, парафин. Это аморфные тела. Температуру плавления для кристаллических тел указывают в таблицах, для аморфных тел – нет.
Лабораторный опыт: отливка копии печати.
- На куске пластилина оставить вмятину от игрушечной печати (можно использовать рельефный выпуклый значок).
- Наполнить расплавленным парафином свечи заготовку. Прокомментировать изменение агрегатного состояния парафина.
- После застывания капель жидкости аккуратно вытащить полученную копию.
- Дать объяснение, как изменяется состояние вещества при застывании жидкости.
Испарение – переход вещества из жидкого состояния в газообразное.
Конденсация – переход вещества из газообразного состояния в жидкое.
Примеры конденсации: появление тумана, выпадение росы, образование осадков. Одна из причин – понижение температуры.
- Испарение капли воды и подсолнечного масла с листа бумаги. Зависимость скорости испарения от температуры, рода жидкости, площади поверхности.
- Охлаждение жидкости при испарении (охлаждение руки, если на нее подуть) ; наблюдения за показаниями сухого и влажного термометров психрометра.
Кипение – процесс парообразования по всему объему жидкости. Обратить внимание на постоянство температуры при кипении жидкости. Образование пузырьков с водяным паром интересно наблюдать в электрочайнике с подсветкой.
Если капнуть воды на горячий утюг, то, казалось бы, капля должна быстро испариться, но этого не наблюдается.
Образовав маленький шарик, шипя и подпрыгивая. Капля очень медленно превращается в пар. Почему?
Под капелькой образуется упругий слой пара. Он является плохим проводником теплоты, поэтому капля медленно испаряется.
Рекомендуется подготовить рисунки, подтверждающие основные положения пройденной темы.
Для закрепления материала можно выбрать пять важных явлений: плавление, кристаллизация, испарение, кипение, конденсация. Карточки-рисунки можно подготовить к упражнениям, предложенным в сборнике задач Лукашика В.И. для 7-9 классов.
Как потом использовать карточки-рисунки?
Когда учащиеся составляют рассказ по картинке, они развивают логическое мышление, тренируются в составлении связного научного рассказа. Можно использовать карточки, выполненные учащимися на занятиях с отстающими учениками.
Изучение темы в 10-ом классе.
Фазовый переход – переход системы из одного агрегатного состояния в другое.
При фазовом переходе скачкообразно изменяется какая-либо физическая величина (внутренняя энергия, плотность). Состояние вещества зависит от соотношения кинетической и потенциальной энергии молекул, входящих в его состав.
Электрически нейтральные молекулы, казалось бы, не должны взаимодействовать. Но на малых расстояниях взаимодействуют электроны одних молекул с ядрами других. Силы взаимодействия могут быть как силами притяжения, так и силами отталкивания. На малых расстояниях молекулы отталкиваются, поэтому жидкости мало сжимаемы.
Из-за непрерывного движения энергия меняется, поэтому время оседлой жизни молекулы (когда она не колеблется) с повышением температуры уменьшается.
В земных условиях многие тела находятся в твердом состоянии. Молекулы притягиваются друг к другу на расстоянии порядка нескольких молекулярных радиусов и отталкиваются на очень близких расстояниях. Это взаимодействие обеспечивает твердым телам прочность и упругость. Молекулы колеблются около положения равновесия. Вот почему они сохраняют форму и объем тела. Если соединить центры положения равновесия атомов (молекул) твердого тела, получим правильную пространственную решетку, которая называется кристаллической
ПЛАЗМА – частично или полностью ионизированный газ.
Плазма – квазинейтральная система заряженных частиц, т.е. частично или полностью ионизированный газ, в котором объемные плотности положительных ρ + и отрицательных ρ - зарядов практически одинаковы по абсолютному значению.
ρ + = |ρ - | или ρ + + ρ - = 0
В общем случае можно считать, что плазма представляет собой смесь трех компонент: свободные электроны, положительные и отрицательные ионы и нейтральные атомы (или молекулы).
Плазма соответствует такому состоянию, когда число электронов и ионов настолько велико, что даже небольшое изменение электронной компоненты по сравнению с ионной невозможно из-за сильных электрических полей, возникающих при нарушении равенства между ρ + и ρ -
Плазма – наиболее распространенное состояние вещества в природе. Внешняя часть земной атмосферы покрыта плазменной оболочкой – ионосферой. В околоземном пространстве находятся радиационные пояса – плазменные образования. Солнце и звезды – сгустки горячей плазмы. Плазма заполняет всю Вселенную в виде очень разреженного газа. В земных условиях в лаборатории и в технике с плазмой мы встречаемся при различных газовых разрядах: молния, искра, дуга.
Применение: лампа-вспышка для рубинового лазера. Рабочее тело для газовых лазеров, резец для плазменной резки, в двигателях для разгона космических кораблей.
Свойства: если поместить в электрическое поле, в нейтральной плазме будет электрический ток.
Будущее: овладение энергией управляемого термоядерного синтеза.
Замерзание кипящей воды.
Стакан с небольшим объемом воды поставить под колокол воздушного насоса. Если откачать воздух из-под колокола, вода закипит, а потом замерзнет. Почему?
Происходящий при пониженном давлении процесс кипения сопровождается поглощением теплоты, чем объясняется понижение температуры воды и её замерзание.
Еще с незапамятных времен древние мыслители считали, что мир состоит из четырех простых стихий: земли, воды, воздуха и огня. Можно сказать, что тем самым они как бы предвосхитили представления современной науки о четырех состояниях вещества: твердом, жидком, газообразном и плазменном.
Для каждого состояния любого вещества характерен определенный интервал температур. Например, при отрицательных (по Цельсию)температурах вода находится в твердом состоянии (лед). В интервале температур от 0°С до 100°С – жидкость. Если температура превышает 100°С, вода превращается в водяной пар (газ). А при значительно более высоких температурах атомы и молекулы нейтрального газа теряют часть своих электронов и становятся положительными ионами. Когда температура достигает 10 4 °С , то газ представляет собой плазму. При температурах выше 10 4 °С все вещества находятся в своем четвертом состоянии – состоянии плазмы. Масса плазмы составляет 99% массы Вселенной.
Я считаю, что выбранная мной тема реферата является актуальной для основного курса физики для средней школы. Я пыталась ступенчато, с усложнением, подойти к четырем агрегатным состояниям вещества. Показать специфику изучения этой темы в разных классах, выделить главное с моей точки зрения. Рассмотреть разные итоговые задания по этой теме: таблицы, карточки, вопросы.
В процессе обучения важно сформировать интерес к знаниям. Обучение нужно строить так, чтобы ученик понимал и принимал цели поставленные учителем и был активным участником их реализации.
В своем реферате мне хотелось показать как на, казалось бы, простой и понятной теме не приневолить, а приохотить к учению недругов физики. Как писал Я.И. Перельман.

Сформировать у студентов навыки самостоятельной исследовательской деятельности и работы с учебником, развивать умения выделять главное, сравнивать и анализировать; развитие речевых навыков студентов, умений анализировать, умений делать выводы по изученному материалу.
Государственное казённое профессиональное образовательное учреждение МО
Методическая разработка занятия:
Составила: преподаватель Тимонина Т.Е.
Сергиев Посад
Тема занятия: Агрегатные состояния вещества
Тип занятия: комбинированный, включающий в себя повторение пройденного материала, применение знаний и умений на практике, закрепление изученного.
Цели занятия:
Образовательные:
познакомить студентов со свойствами твердых тел, жидкостей и газов, и объяснить их с точки зрения молекулярного строения вещества. Систематизировать полученные знания, активизировать самоконтроль, взаимоконтроль.
развивать умения анализировать, осуществлять выбор соответствующей позиции с последующим анализом своей деятельности.
Воспитательные:
- познавательный интерес к предмету физика;
- информационную культуру и культуру общения;
- самостоятельность, способность работать в коллективе.
На занятии предусмотрено применение преподавателем:
для лиц с нарушением зрения материал предоставляется в печатной форме увеличенным шрифтом;
для лиц с нарушением слуха материал предоставлен в печатной форме;
для лиц с нарушением опорно-двигательного аппарата материал предоставлен в печатной форме.
Задачи. Сформировать у студентов навыки самостоятельной исследовательской деятельности и работы с учебником, развивать умения выделять главное, сравнивать и анализировать; развитие речевых навыков студентов, умений анализировать, умений делать выводы по изученному материалу.
Планируемые образовательные результаты. Сформировать представления о некоторых механических свойствах твердых тел, жидкостей, газов, объяснить эти свойства на основе знаний о различиях в расположении, движении и притяжении молекул; формировать умения применять полученные знания о молекулярном строении вещества для объяснения свойств твердых тел, жидкостей и газов
Метод: объяснение с демонстрацией видеоматериала, беседа и проблемно-поисковые методы.
Организационный этап
2. Актуализация знаний
3. Этап постановки целей и задач урока
4. Этап получения новых знаний
5. Этап обобщения и закрепления нового материала
6. Заключительный этап
1. Организационный этап
Приветствие. Отмечание отсутствующих. Проверка наличия учебных принадлежностей. Проверка присутствующих.
Мобилизация учебной деятельности обучающихся: доброжелательный настрой преподавателя и обучающихся, быстрое включение группы в деловой ритм, организация внимания всех обучающихся.
Актуализация знаний (метод опроса блиц-опрос)
( для лиц с нарушением зрения материал предоставляется в печатной форме увеличенным шрифтом, для лиц с нарушением слуха и с нарушением опорно-двигательного аппарата материал предоставлен в печатной форме )
Из чего состоят все тела?
Что называют молекулами?
Из чего состоят молекулы?
Отличаются ли между собой молекулы одного и того же вещества?
Почему при нагревании все тела расширяются, а при охлаждении сжимаются?
Что вы можете сказать о величине промежутков между молекулами твердых тел, жидкостей и газов?
Какое явление называют диффузией?
Почему диффузия в разных телах происходит с разной скоростью?
Почему твердые тела и жидкости не распадаются на отдельные молекулы?
Что вы можете сказать о силах взаимодействия между молекулами твердых тел, жидкостей и газов?
Теперь подведем итог: что мы знаем о строении вещества? Выводы делают обучающиеся, преподаватель направляет ответы и корректирует.
Этап постановки целей и задач урока
Проблемная ситуация.
На какие три группы можно разделить следующие вещества: вода, камень, воздух, олово, спирт, сахар, природный газ, лед, кислород, растительное масло, алюминий, молоко, азот (данные вещества даны при комнатной температуре).
На доске выписаны вещества и их необходимо разделить на колонки.
Вы разделили вещества по их агрегатным состояниям: твердое, жидкое и газообразное. Многие из них мы привыкли видеть в каком-либо одном состоянии. Например, железо – в твердом, растительное масло – в жидком, водород – в газообразном. Однако есть и такие, которые в нашей жизни встречаются сразу в трех состояниях, например, вода: твердое состояние воды – лед, жидкое – вода, газообразное – водяной пар. Давайте попробуем разобраться, почему в различных состояниях вещества обладают разными свойствами.
Как вы думаете, какая цель будет стоять перед нами на этом уроке?
Цель, которую мы ставим сегодня перед собой: получить представление о свойствах твёрдых тел, жидкостей, газов, объяснить эти свойства на основе знаний о различиях в расположении, движении и притяжении молекул.
Этап получения новых знаний
(для лиц с нарушением зрения материал предоставляется в печатной форме увеличенным шрифтом, для лиц с нарушением слуха и с нарушением опорно-двигательного аппарата материал предоставлен в печатной форме ).
Чтобы систематизировать знания о строении вещества, свойствах тел в разных агрегатных состояниях, заполним таблицу:
Критерии сравнения
Жидкость
Твердое тело
Основные свойства
Не имеет формы
Не сохраняет объем
Не имеет формы
Сохраняет объём
Не сжимаема
Сохраняет форму
Сохраняет объем
Не сжимаемо
Расположение молекул




































На большом расстоянии друг от друга, хаотично
Плотно упакованы, т.е. на небольшом расстоянии друг от друга
Упорядоченно, образуя кристаллическую решётку
Характер движения молекул
Движутся свободно по всему объему
Колеблются на месте, перескакивая с места на место
Колеблются на месте, около одного положения равновесия
Взаимодействие молекул
Очень сильное
Какие свойства твёрдых тел вам известны? Сохраняют форму и объём (продемонстрировать на опытах: сжать или растянуть любое твёрдое тело).
Какие свойства жидкостей вы знаете? Сохраняют объём, но легко меняют свою форму (опыты: перелить воду в сосуды разной формы).
Какие свойства газов вам известны? Не сохраняют форму и объём (продемонстрировать на опытах: сжать воздух в воздушном шарике).
Свойства твердых тел.
В каком состоянии находятся окружающие нас тела – парты, книги, тетради? (твердом)
Рассмотрим несколько твердых тел.
Какую форму они имеют? (правильную, параллелепипеда, цилиндра)
Попробуем изменить их форму: сжать или растянуть. Легко это сделать? (Нет.)
Можем мы определить объем твердых тел? Определим объем параллелепипеда.
Вывод: Твердые тела сохраняют форму и имеют объем. (Запись вывода на доске и в таблице).
Свойства жидкостей.
Теперь определим свойства жидкостей. Мы можем перелить её в различные сосуды. (Учитель переливает воду в сосуды различной формы, первый и последний раз в мензурки, для определения объема)
Что происходит с формой жидкости? (она меняется)
Какую форму принимает каждый раз жидкость? (форму сосуда)
Изменился ли при этом объем жидкости? (нет)
Вывод: жидкость легко меняет форму, но сохраняет объем. (Запись вывода на доске и в таблице). Эти свойства жидкости применяют при изготовлении изделий из стекла.
Свойства газов.
Выясним, какими свойствами обладают газы. Опыт с резиновым шариком: перевязывают шарик посредине ниткой, надувают одну половину воздухом, затем разрезают нить. Воздух занимает весь шарик.
Итак, газы занимают весь предоставленный объем. Теперь пробуем сжать шарик. Это нам легко удалось.
Что можем сказать о свойствах газов?
Вывод: Газ занимает весь предоставленный ему объем и легко сжимаем. (Запись вывода в таблице)
Как же можно объяснить эти свойства? Ведь вода, лед, водяной пар – это состояния одного и того же вещества, а значит, молекулы не отличаются друг от друга. Следовательно, нам надо выяснить, как эти молекулы расположены и как они движутся.
Газы. Так как газы заполняют весь предоставленный объём, не имеют формы и легко сжимаются, то следует предположить, что расстояние между молекулами во много раз больше самих молекул, они почти не притягиваются и свободно движутся. Это доказывает и диффузия, которая в газах происходит быстрее, чем в жидкостях и твёрдых телах. Но если газы сильно сжать или охладить они переходят в жидкое состояние. (Запись вывода на доске и в таблице).
Жидкости. Жидкости не сохраняют форму, они могут течь, их легко перелить. Но сжать их трудно. Это можно объяснить только тем, что при любом сближении молекул между ними возникает отталкивание, т.к. молекулы расположены близко друг к другу, расстояние между ними сравнимо с размером молекул. Они скачками меняют свое место – “прыгают”. (Запись вывода на доске и в таблице).
Твердые тела. Твердые тела сохраняют форму и объем. Это значит, что молекулы расположены на расстояниях, сравнимых с размером молекул. Молекулы расположены упорядоченно, образуя кристаллическую решётку, при этом они совершают колебания около определенной точки. (Запись вывода на доске и в таблице).
Для обобщения всего сказанного просматривается видеоматериал и обучающиеся отвечают на письменно на вопросы (для лиц с нарушением зрения материал предоставляется в печатной форме увеличенным шрифтом, для лиц с нарушением слуха и с нарушением опорно-двигательного аппарата материал предоставлен в печатной форме ).
5. Этап обобщения и закрепления нового материала
Можно ли заполнить газом сосуд на половину его объема? Почему?
Могут ли быть в жидком состоянии при комнатной температуре: кислород, азот?
Могут ли быть в газообразном состоянии при комнатной температуре: ртуть, железо?
В зимний морозный день над полыньей в реке образовался туман. Какое это состояние вещества?
В комнате, где находится нафталин, всегда чувствуется его запах. Объясните, в каком состоянии пребывает нафталин?
Заключительный этап
Что мы узнали о свойствах тел в различных агрегатных состояниях?
Как можно объяснить эти свойства, учитывая молекулярное строение вещества?
Задание ученикам по рефлексии их деятельности.
Что вам понравилось на сегодняшнем занятии?
Что не понравилось?
А теперь давайте выставим оценки.
Информация о домашнем задании. Задания распечатываются и раздаются обучающимся.
Задания для исследовательской работы
Оборудование: воздушный шарик, медицинский шприц
Проведите эксперимент и ответьте на вопросы:
Надуйте шарик. Какую часть шарика заполняет воздух? Какова форма газа?
Сожмите шарик рукой (измените его форму). Сохранился ли объём воздуха? Сохранилась ли его форма?
Заполните шприц воздухом, вытягивая поршень. Закройте отверстие пальцем и попробуйте его сжать. Легко ли сжать газ?
Оборудование: сосуд с водой, мензурка, 2-3 сосуда разной формы, медицинский шприц
Проведите эксперимент и ответьте на вопросы:
Измерьте объём жидкости с помощью мензурки?
Переливайте воду в сосуды разной формы? Какую часть сосуда заполняет жидкость? Сохраняет ли жидкость свою форму?
Вновь измерьте объём жидкости. Изменился ли её объём?
Заполните шприц водой. Закройте отверстие пальцем и попробуйте её сжать. Легко ли сжать жидкость?
Оборудование: набор твердых тел из разного вещества (металла, дерева, пластмассы и т.д.)
Проведите эксперимент и ответьте на вопросы:
Имеют ли твердые тела свою форму?
Сохраняют ли они свой объём?
Попробуйте сдавить тело рукой. Легко ли его сжать?
Список использованной литературы материалы учебника, видеоуроки.
Дмитриева В. Ф. Физика для профессий и специальностей технического профиля. Сборник задач: учеб. пособие для образовательных учреждений сред. проф. образования. — М., 2014.
Любой химический элемент или соединение в зависимости от внешних условий может принимать разные формы, которые называются агрегатным состоянием вещества. Поскольку при переходе из одного состояния в другое изменяются структурные связи между молекулами, атомами или ионами, то этот процесс изучается в физической химии.
- Общие понятия
- Твердые тела
- Изменение жидкостей
- Газообразное состояние
- Сравнительная таблица
- Область применения
Общие понятия
При нормальных внешних условия все вещества находятся в своем привычном состоянии: кислород — в газообразном, вода — в жидком, кристаллы — в твердом. Их изменение вызывает переход одного и того же вещества в разные состояния, которые называются агрегатными. Повышение или понижение температуры и/или давления окружающей среды влияет на характер взаимодействия между частицами, составляющими вещество (молекулами, атомами, ионами), и расстояние между ними.
Бывает три вида агрегатных состояний (АС):
- твердое;
- жидкое;
- газообразное.
Переход вещества из одного АС в другое называется фазовым и сопровождается скачкообразным изменением его физических и химических свойств — плотности, растворимости, кинетической и потенциальной энергии частиц и др. Всего существует шесть процессов, вызывающих изменение агрегатного состояния вещества:
- Плавление — преобразование твердого тела в жидкое (таяние льда).
- Обратный процесс — кристаллизация или затвердение (морозные узоры на стекле).
- Парообразование — переход вещества из жидкого АС в газообразное. Частные случаи — испарение происходит только с поверхности жидкости; кипение, при котором жидкость превращается в пар по всему объему.
- Обратный процесс — конденсация.
- Сублимация или возгонка — переход из твердого АС сразу в газообразное без жидкой стадии.
- Десублимация — обратное преобразование.
Сублимированию в той или иной мере подвержены все твердые тела, но в основном количество частиц, покинувших тело, настолько мало, что процесс практически незаметен. Примеры явной сублимации — графит и сухой лед (оксид углерода). Даже сильное нагревание не приводит их в жидкое состояние, а постепенно превращает в газ. Запахи твердых тел тоже обусловлены возгонкой — отрываясь от поверхности, молекулы скапливаются в пары, обладающие ароматом (камфара, нафталин). Молекулы некоторых органических веществ, например, белков, настолько большие, что не позволяют им принять газообразную форму.
Твердые тела
При нормальных условиях находятся в стабильной форме и сохраняют свой объем. По внутреннему строению и свойствам разделяются на кристаллические и аморфные. Первые отличаются строго упорядоченным положением частиц, между которыми установлены сильные взаимосвязи — ковалентные полярные и неполярные, ионные, металлические. Тип взаимодействия определяет физические свойства твердого тела. Это, как правило, металлы и их оксиды, обладающие хорошей тепло- и электропроводностью, прочные и упругие.
Свойства аморфных тел близки к жидкостным, так как их молекулы передвигаются между хаотично расположенными условными центрами. К ним относятся разнообразные смолы, пластмассы, стекло и другие неметаллы. Нагревание кристаллических веществ приводит к нарушению упорядоченного расположения частиц, увеличению расстояний между ними и рекристаллизации. При определенной температуре, которая называется температурой плавления, перестройка молекул приводит к превращению твердого тела в жидкость. Количество теплоты, которое нужно, чтобы расплавить некоторую массу вещества, вычисляют по формуле: Q = km, где k — удельная теплота плавления этого вещества, m — его масса.
Молекулярная кинетическая энергия остается неизменной, поэтому дальнейшее нагревание вещества не приводит к повышению его температуры до тех пор, пока все оно не превратится в жидкость. Если продолжать нагрев, то с поверхности расплавленного металла начнется испарение — беспорядочный отрыв отдельных молекул, который является началом перехода в газообразное состояние. При кристаллизации, начинающейся при снижении температуры, остывающее тело само отдает тепло в атмосферу.

Опытным путем установлено, что температуры плавления и кристаллизации у каждого металла равны друг другу, а их точно известное значение отличает кристаллические тела от аморфных. В отличие от металлов, аморфные вещества не плавятся, а размягчаются. Например, стекло при нагревании сначала становится мягким, его легко согнуть или растянуть.
Дальнейшее повышение температуры приводит к тому, что оно под действием силы тяжести растекается по сосуду, который занимает. Эта масса, поначалу очень густая, постепенно приобретает консистенцию воды. Таким образом процесс перехода аморфного тела в жидкое происходит не при фиксированной температуре, как у кристаллических тел, а растягивается на все время нагревания.
Изменение жидкостей

Жидкости — это тела, занимающие весь объем, в котором находятся, образующие поверхность, но не способные удерживать упругую форму. Для них свойственно сильное межмолекулярное взаимодействие и низкая сжимаемость, что определяет их положение между газообразным и твердым АС. Жидкости изотропны, текучи и обладают удельным весом, сравнимым с тем же показателем у твердых тел.
Правильное расположение внутренних частиц распространяется на небольшие области — они не только колеблются вокруг узлов так называемой квазикристаллической решетки, но и могут перескакивать между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве. Этим объясняется текучесть тел в жидком АС. Если понизить температуру до границ кристаллизации, то различные тепловые свойства жидкостей приблизятся к показателям твердых тел.
Процесс парообразования
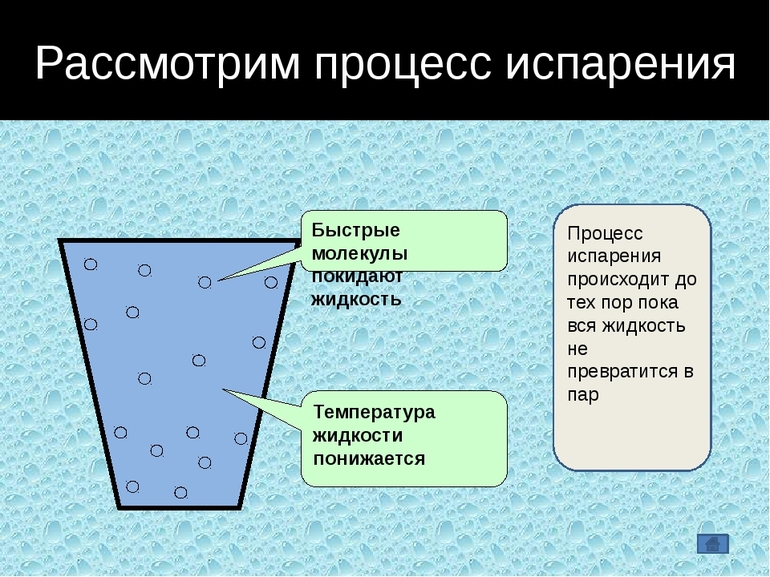
Некоторые молекулы жидкости могут преодолеть силы поверхностного натяжения и перейти в парообразную форму, чем объясняется явление испарения, происходящее при любой температуре. Когда она повышается, процесс становится интенсивней и распространяется на весь объем. Появляется все больше пузырьков насыщенного пара, прорывающихся из глубины на поверхность.
При температуре кипения, имеющей определенное значение для каждого жидкого тела, давление пара внутри пузырьков превышает атмосферное, и начинается интенсивный переход жидкости в газообразное АС. При пониженном атмосферном давлении температура кипения той же жидкости становится ниже.
Динамическое равновесие

Когда жидкость находится в открытой емкости, то ее количество обязательно уменьшится вследствие испарения. Но если сосуд закрыть, то этого не произойдет. Сначала начнется процесс испарения и продолжится до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров.
Можно сказать, что замкнутая система придет в динамическое (подвижное) равновесие, так как процесс обмена молекул будет продолжаться и дальше, т. е. испарение и конденсация в замкнутой системе происходят одновременно и компенсируют друг друга. Пар, который находится в таком равновесии с соответствующей жидкостью, называется насыщенным. Изменение внутренней энергии вещества определяется по формуле: ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Динамическое равновесие у разных жидкостей наступает при разной плотности пара. Это зависит от силы межмолекулярного взаимодействия. Если они велики как, например, у ртути, то только незначительное число самых быстрых молекул может покидать поверхность жидкости, а равновесие наступает при малой плотности пара. У летучих жидкостей молекулы разлетаются очень быстро, поэтому нужна высокая плотность для наступления равновесия.
Газообразное состояние
При этом АС частицы химических элементов и их соединений связаны друг с другом слабо или не связаны вообще и заполняют весь предоставленный объем. Такое состояние вещества широко распространено в природе: воздушные массы атмосферы; скопления газов под землей; газообразная материя, растворенная в водах Мирового океана.
Все газы отличаются следующими свойствами:
- равномерно заполняют весь предоставленный объем, при этом не создавая поверхность;
- имеют малую плотность при высокой скорости диффузии;
- сравнительно легко сжимаются.

Эти характеристики определяются большими расстояниями между молекулами и их притяжением друг к другу. Газообразное АС веществ можно рассматривать, как перегретый или ненасыщенный пар. При сверхвысоких температурах газ частично или полностью ионизируется, при этом сохраняя общую электрическую нейтральность, потому что плотности отрицательных и положительных зарядов находятся примерно на одном уровне.
Так образуется плазма, которую некоторые ученые рассматривают, как четвертый вид АС вещества. В ней взаимодействие происходит между ионами и свободными электронами с помощью электрических сил, действующих на большом расстоянии. Вещества, которые при нормальных условиях являются газами, самопроизвольно переходить в жидкое состояние не могут.
Увеличение давления и понижение температуры приводит к уменьшению расстояний между молекулами и увеличению силы взаимодействия до такой степени, что вещество из газообразного состояния переходит в жидкое, т. е. изменяет свое АС. Этот процесс называется сжижением и характеризуется критической температурой. Она определяется в точке, после которой превращение газа в жидкость невозможно ни при каком давлении.
Для каждого газообразного вещества значение этой температуры свое. Оно бывает примерно равно комнатной, как у аммиака, хлора и углекислого газа, тогда для сжижения достаточно воздействовать на газ только давлением. У водорода и гелия, например, критическая температура намного ниже комнатной. Перед сжижением их сначала охлаждают до температуры чуть ниже критической, а затем доводят до жидкого АС повышенным давлением.
Сравнительная таблица
Различие между твердыми материалами, жидкостями и газами объясняется внутренними процессами, зависящими от агрегатного состояния вещества. В таблице приведены характерные для каждого класса особенности.
| Состояние вещества | Расположение и характер движения частиц | Энергия взаимодействия | Физические свойства |
| Твердое | Расстояния между частицами, колеблющимися около положения равновесия, сопоставимы с их размерами. | Потенциальная энергия превышает кинетическую. Взаимодействие между частицами сильное. | Сохраняют собственную форму и объем. Имеют точную температуру кристаллизации и плавления. Обладают твердостью, прочностью и упругостью. |
| Жидкое | Частицы расположены вплотную и сохраняют близкий порядок упорядоченности. Могут перескакивать из одного положения равновесия в другой. | Модуль кинетической энергии почти равен потенциальной. | Сохраняют объем, но не форму. Закипают при определенной температуре. Текучи, почти не поддаются сжатию. |
| Газообразное | Частицы расположены хаотично на расстояниях, сильно превышающих их собственные размеры. Хаотичное движение частиц с довольно большими скоростями приводит к постоянным столкновениям между ними. | Кинетическая энергия по модулю намного превышает потенциальную. Легко заполняют весь предоставленный объем и сжимаются. | Принимают форму тех предметов, в которых находятся. |
Можно отметить, что переход вещества из одного АС в другое зависит от соотношения потенциальной и кинетической энергии его частиц.
Область применения

Способность металлов плавиться и поддаваться обработке в жидком состоянии широко применяется в черной и цветной металлургии. В технологиях получения соли и других химических соединений используется процесс выпаривания, при котором нужное вещество получается после испарения жидкости. В разных областях промышленности и техники распространено применение жидких газов.
Инертные газы используются в осветительных приборах, жидкий кислород — в медицине в качестве средства анестезии, при сварке металлов в смеси с ацетиленом.
Жидкий водород — это ракетное топливо, а оксид серы уничтожает плесень. В рефрижераторах и промышленных холодильниках применяют жидкий аммиак, кроме того, сжиженные газы удобней транспортировать.
Читайте также:
- Анализ внеурочного занятия в начальной школе 4 класс
- Какие формы работы практикует учитель начальной школы когда организует познавательную деятельность
- Объясните в чем сущность процесса растворения кратко
- Какое изображение называют разрезом кратко
- Какое главное доказательство законности своей власти он привел борис годунов кратко

