Таблица менделеева без названия элементов в карточках для школы
Обновлено: 08.07.2024
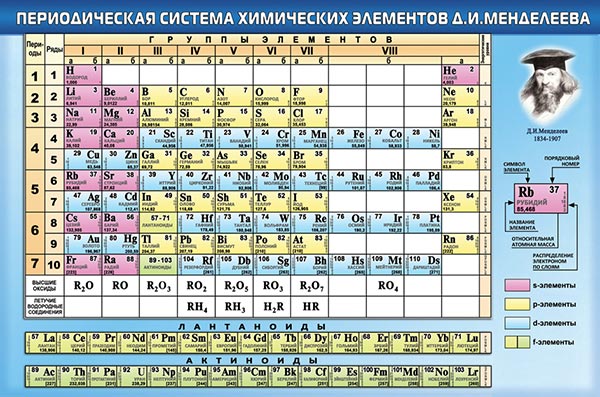
Периодическая система элементов Д. И. Менделеева
Таблица Менделеева - это, вероятно, одна из наиболее часто используемых таблиц. Вряд ли найдется хотя бы один человек старше 14 лет, который ни разу не слышал о ней. Это неудивительно, ибо эта таблица - кладезь полезной информации для любого химика. Напомню основное.
- В каждой ячейке данной таблицы указаны название химического элемента, его символ, порядковый номер и приближенное значение атомной массы.
- Порядковый номер элемента совпадает с количеством протонов в ядре атома данного элемента и с количеством электронов в атоме.
- Элементы, расположенные в таблице Менделеева в одной группе (в одном вертикальном ряду) и в одной подгруппе, имеют похожие свойства.
- Свойства элементов в периодах (горизонтальных рядах) изменяются похожим образом. Например, 2-й и 3-й периоды включают 8 элементов, начинаются со щелочного металла, заканчиваются благородным газом.
Последние два пункта - следствия периодического закона , который в современной формулировке звучит так:
Свойства элементов и образуемых ими соединений находятся в периодической зависимости от заряда ядра атома.
Периодический закон Менделеева - один из основных законов химии, а таблица, которую мы обсуждаем, является лишь средством, позволяющим наглядно выразить этот закон.
Я предлагаю вам несколько вариантов таблицы Менделеева:
Классический вариант таблицы Менделеева
Вероятно, именно такой вариант периодической таблицы является для вас наиболее привычным. Нечто подобное мы видим в любом школьном учебнике химии. К сожалению, данный вариант (т. н. короткопериодный) не очень наглядно отражает периодический закон. Возьмите, например, элементы седьмой группы: ярко выраженные неметаллы (F, Cl, Br, I) соседствуют здесь с типичными металлами (Mn, Tc, Re). А ведь мы ожидаем видеть в одной группе элементы с похожими свойствами.
Приходится выделять т. н. главные и побочные подгруппы, прибегать к другим ухищрениям (например, "вырезать" из таблицы лантаноиды и актиноиды). В действительности, правильный вариант таблицы Менделеева выглядит так, а короткопериодная форма - это некоторый компромиссный вариант, который используется в целях экономии места.
| *Лантаноиды |
Длиннопериодная форма таблицы МенделееваИменно нечто подобное и было создано Дмитрием Ивановичем Менделеевым. Именно такой вариант таблицы наиболее наглядно иллюстрирует периодический закон. К сожалению, у длиннопериодной формы есть один недостаток: таблица занимает слишком много места. Именно поэтому многие отдают предпочтение короткопериодной форме.
Таблица Менделеева с выделением s-, p-, d-, f- элементовРазными цветами в данном варианте таблицы Менделеева отмечены s-, p-, d- и f- элементы. Напоминаю, что элемент относится к одному из этих типов, если внешние электроны в атоме данного элемента находятся соответственно на s-, p-, d- или f- подуровне. Например, электронная формула натрия имеет вид: 1s 2 s2s 2 2p 6 3s 1 . Внешний электронный уровень - 3s, следовательно, натрий относится к s-элементам. Электронная формула кислорода: 1s 2 s2s 2 2p 4 . Внешний электронный подуровень - 2p, значит кислород - это р-элемент. Свойства элементов из этих 4 групп отличаются достаточно сильно. Например, среди d-элементов присутствуют только металлы, а большинство неметаллов относятся к p-элементам. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периоды | Группы элементов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Высшие оксиды | R 2 O | RO | R 2 O 3 | RO 2 | R 2 O 5 | RO 3 | R 2 O 7 | RO 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Водородные соед. | RH 4 | RH 3 | H 2 R | HR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| *Лантаноиды |
Таблица Менделеева, в которой отмечены металлы и неметаллыНеметаллы отмечены в этой таблице красным цветом. Обратите внимание: неметаллы сосредоточены в правой верхней части таблицы Менделеева. Все они, кроме водорода и гелия, относятся к p-элементам. Вы не найдете ни одного неметалла среди d-элементов и f-элементов. Именно по этой причине я счел возможным не приводить в данном варианте список лантаноидов и актиноидов - все они относятся к металлам. Иногда особым образом выделяют группу элементов, сочетающих в себе свойства металлов и неметаллов (например, к ним можно отнести германий). Данные элементы называют полуметаллами или металлоидами. | |||||||||
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 | ||||||||||
| Высшие оксиды | R 2 O | RO | R 2 O 3 | RO 2 | R 2 O 5 | RO 3 | R 2 O 7 | RO 4 | ||
| Водородные соед. | RH 4 | RH 3 | H 2 R | HR | ||||||

Таблица Менделеева с выделением главных и побочных подгрупп
Элементы главных подгрупп обозначены фиолетовым цветом, побочных - серым. Я напоминаю, что свойства элементов, находящихся в одной группе, но в разных подгруппах, отличаются достаточно сильно.
Например, натрий, калий, медь и серебро находятся в I группе: Na и K - в главной подгруппе, Cu и Ag - в побочной. Свойства натрия и калия весьма похожи - активные металлы, бурно реагирующие с водой, легко окисляющиеся на воздухе, имеют низкие температуры плавления и кипения. Все это сильно отличается от свойств меди и серебра: инертные металлы, которые не реагируют не только с водой, но и с большинством кислот, на воздухе устойчивы, температуры плавления и кипения достаточно высоки.
Еще ярче отличия заметны, например, в VI группе. Кислород, сера, селен (главная подгруппа) - типичные неметаллы, а хром, молибден и вольфрам, находящиеся в побочной подгруппе, относятся к металлам.
Все проблемы исчезают, если вы используете длиннопериодную форму таблицы Менделеева: "мешанина" из элементов главных и побочных подгрупп исчезает, и мы начинаем отчетливо видеть логику периодического закона.

Периодическая таблица Менделеева явилась величайшим открытием в химии потому, что она доказала единство всех химических элементов и установила периодическую зависимость между ними. Дмитрий Иванович Менделеев на основе своей таблицы смог предсказать существование новых химических элементов, которые и были открыты впоследствии.
Периодическая система элементов Д. И. Менделеева представляет собой классификацию химических элементов, в которой устанавливается зависимость между зарядом атомного ядра и свойствами элементов. Этот периодический закон имеет графическое изображение – ту самую таблицу, названную именем своего создателя, великого ученого Менделеева.

Распечатанную таблицу Менделеева можно использовать как шпаргалку при подготовке к контрольным работам и ЕГЭ.
Активные попытки создания системы химических элементов предпринимались в середине ХIХ века. В это время уже были открыты 63 элемента, поэтому многих ученых интересовал поиск закономерности в их строении и свойствах. Периодическую систему пытались создать такие западные ученые, как И. Деберейнер, А. Э. Шанкуртуа, Д. А. Ньюлендс. Ближе всех к решению этой проблемы подошел Ю. Л. Мейер, который в дальнейшем претендовал на независимое от Менделеева открытие периодической таблицы. Однако его таблица не основывалась на периодическом законе и не позволяла предсказывать неизвестные еще химические элементы и их свойства. Поэтому честь открытия периодической таблицы по праву принадлежит Дмитрию Ивановичу Менделееву.
Периодическая система химических элементов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Классический вид таблицы Менделеева
История открытия Периодического закона.
Бесплатное участие. Свидетельство СМИ сразу.
До 500 000 руб. ежемесячно и 10 документов.
Предлагаемый дидактический материал может быть использован пи изучении базовых понятий в курсе химии 8 класса. Используется в качестве демонстрационного или раздаточного материала для отработки знаний по свойствам атомов элементов и их изменениям в ПСХЭ. Может использоваться как при изучении нового материала, так и при его закреплении. Применим для уроков химии в 8 класса в любом УМК.
элементы все без названий без разделения цвета.docx
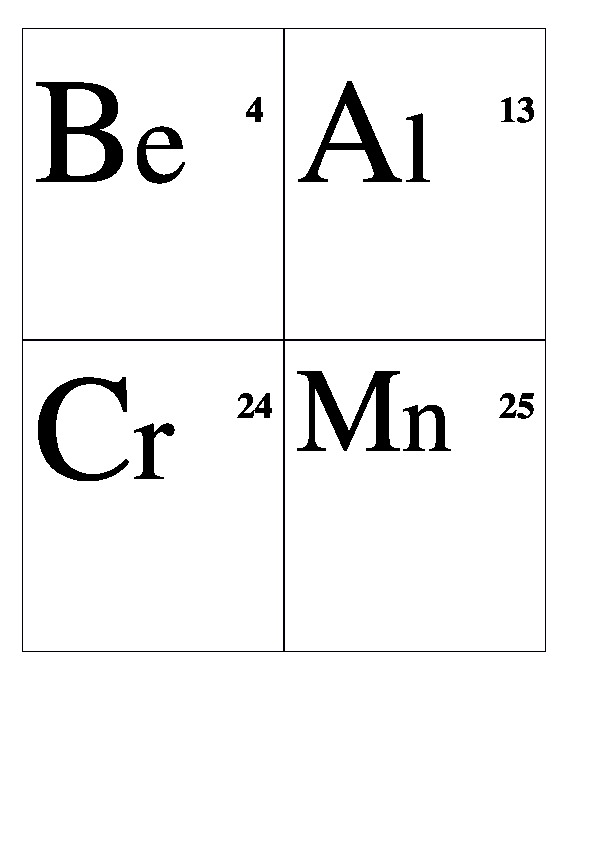
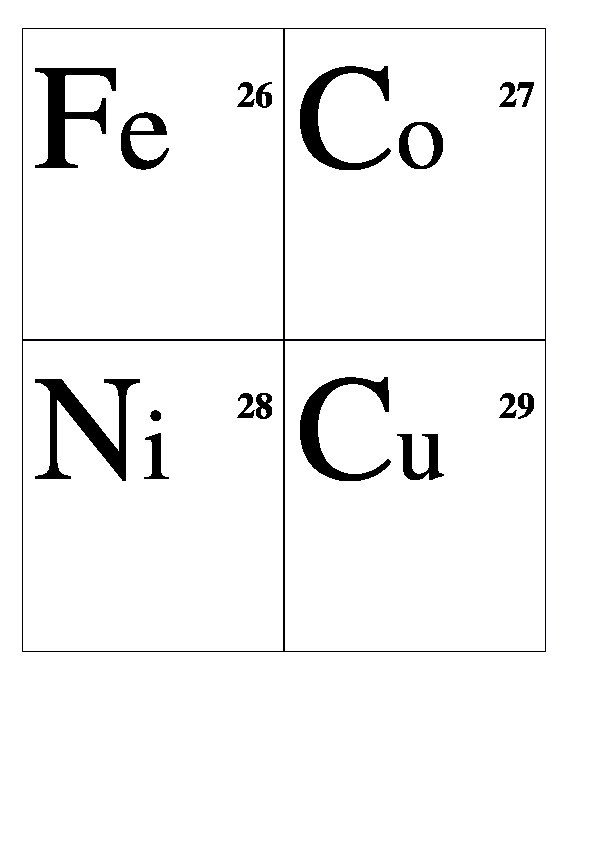
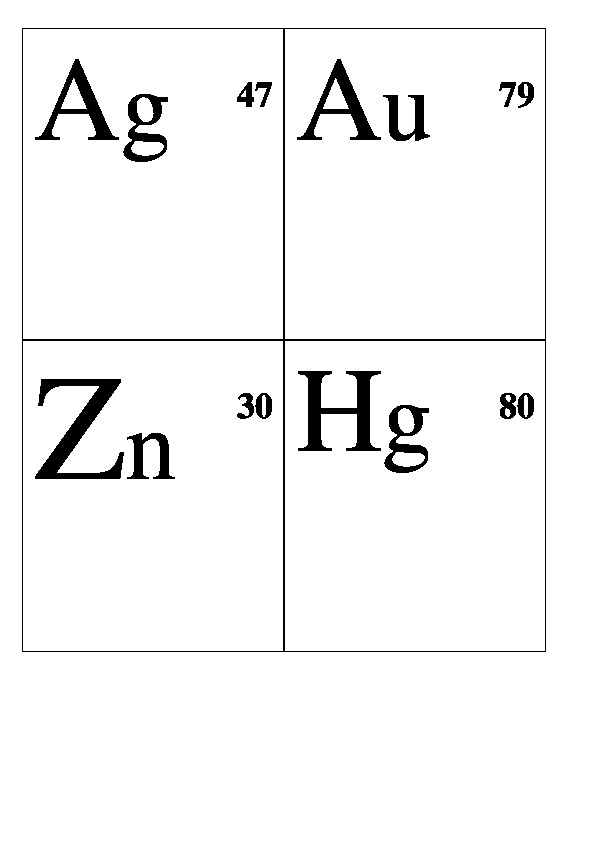
Be 4 Al 13 Cr 24 Mn 25 Fe 26 Co 27 Ni 28 Cu 29 Ag 47 Au 79 Zn 30 Hg 80 Sn 50 Pb 82 Pt 78 W 74 Li 3 Na 11 K 19 Rb 37 Сs 55 Fr 87 Mg 12 Ca 20 Sr 38 Ba 56 Ra 88 Н 1 В 5 С 6 N 7 О 8 F 9 Si 10Р 11 S 16 Cl 17 Аs 33 Se 34 Br 35 Te 52 J 53 At 85 He 2 Ne 10 Ar 18 Kr 36 Xe 54 Rn 86
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.

Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
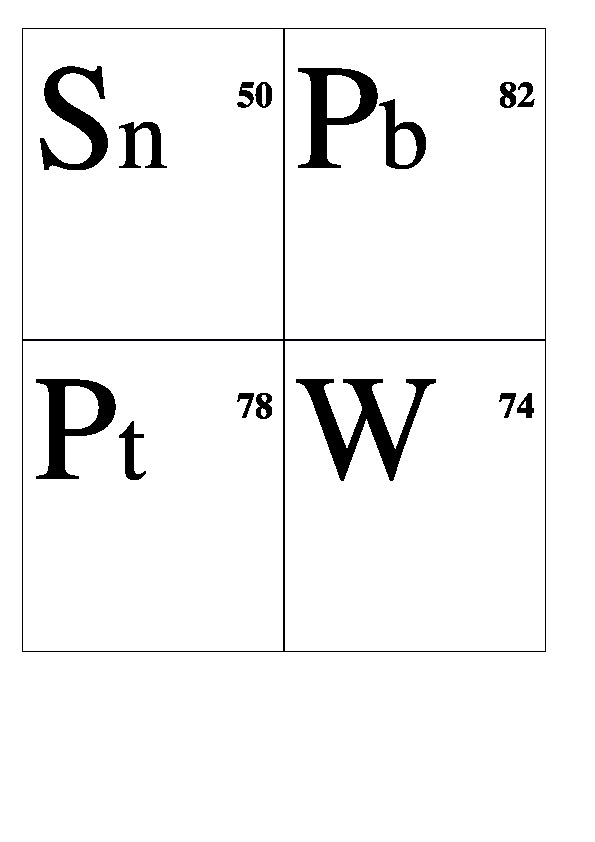
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
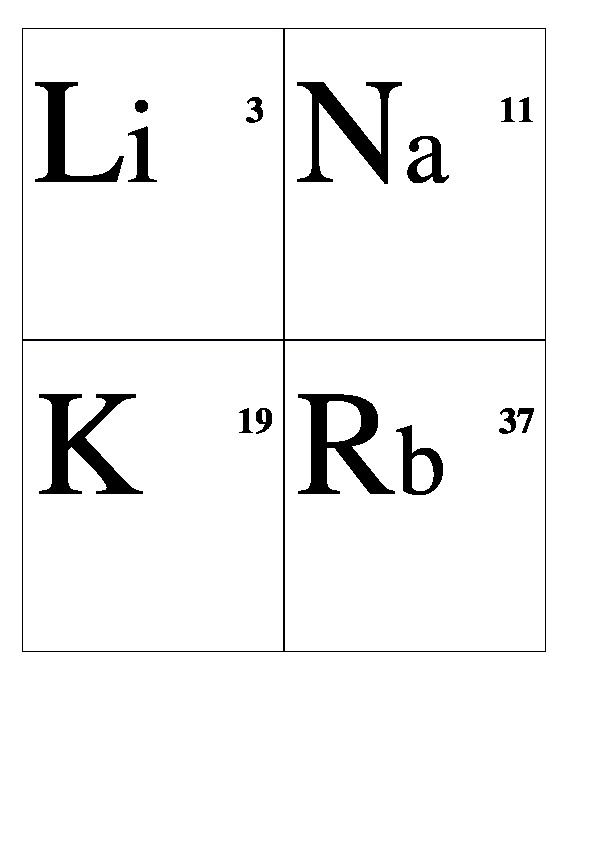
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
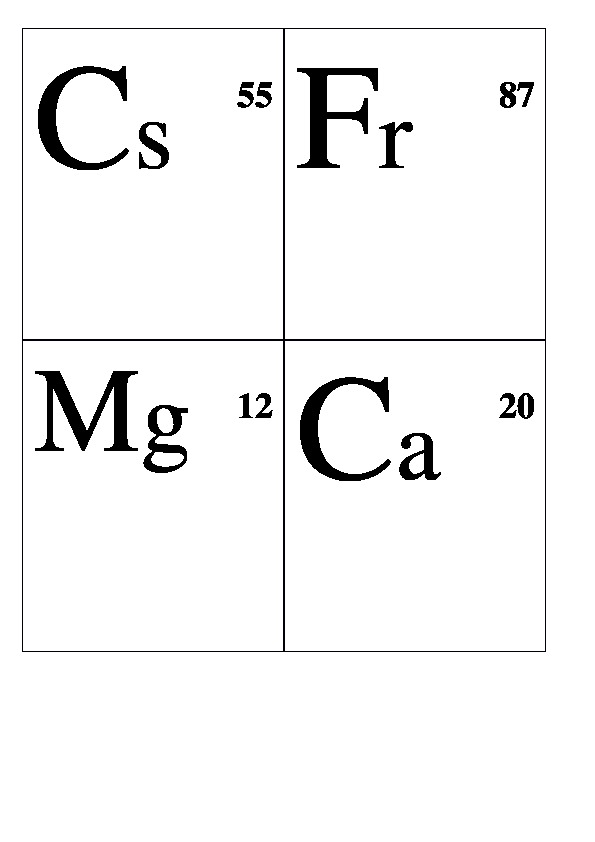
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
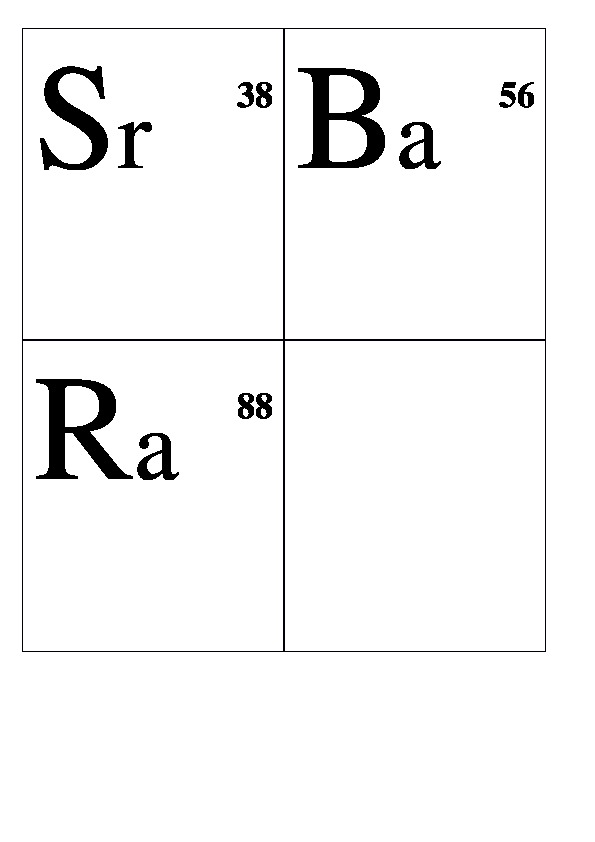
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
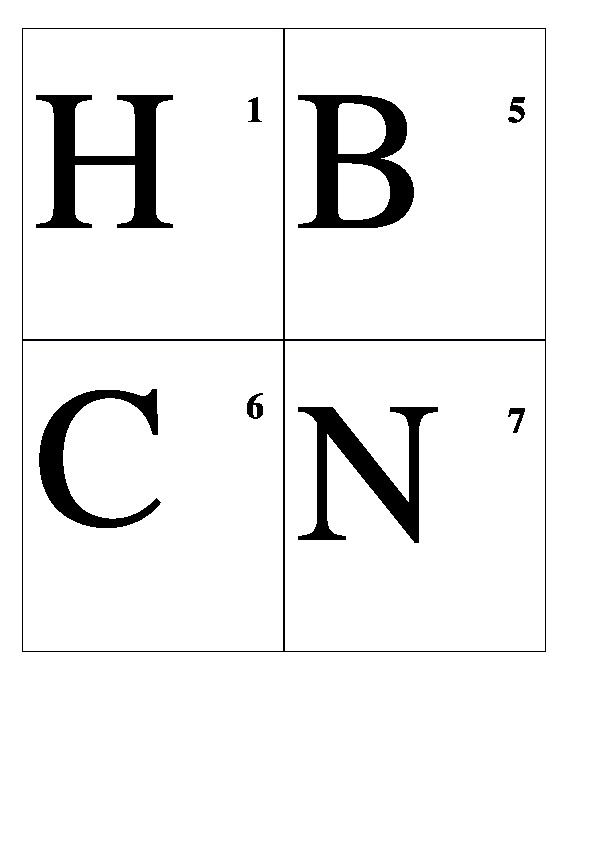
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
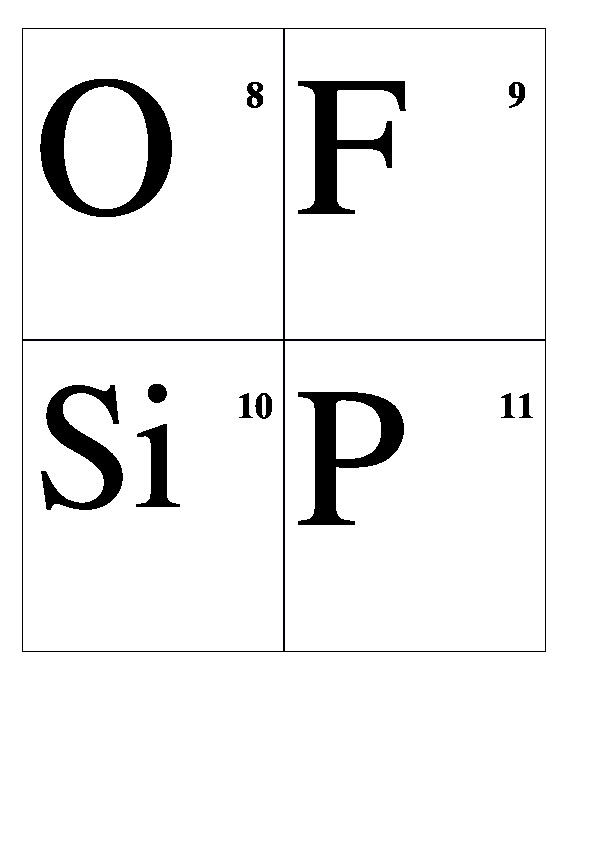
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
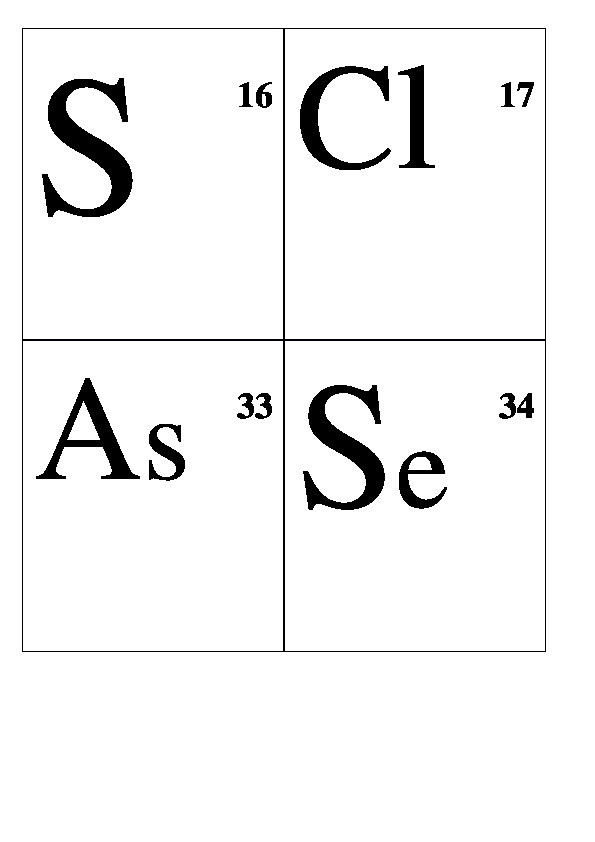
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
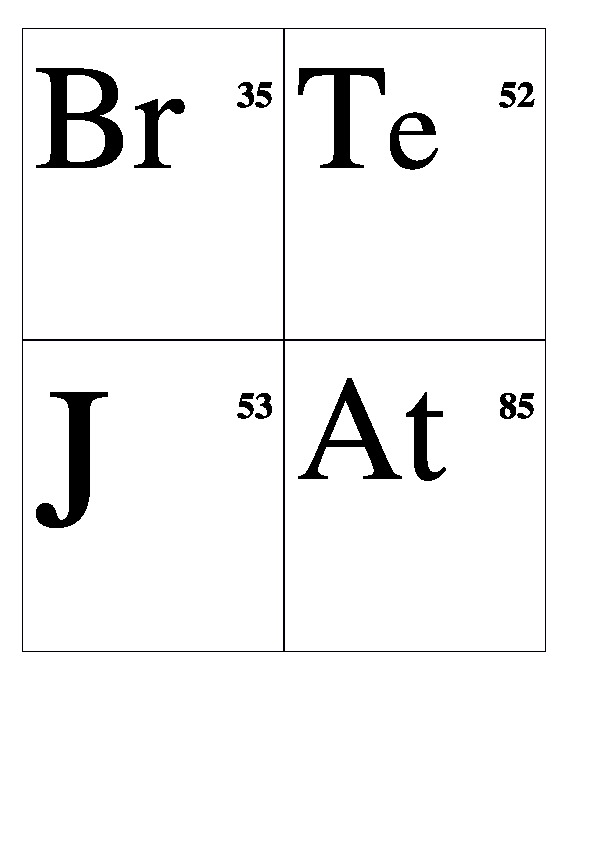
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.
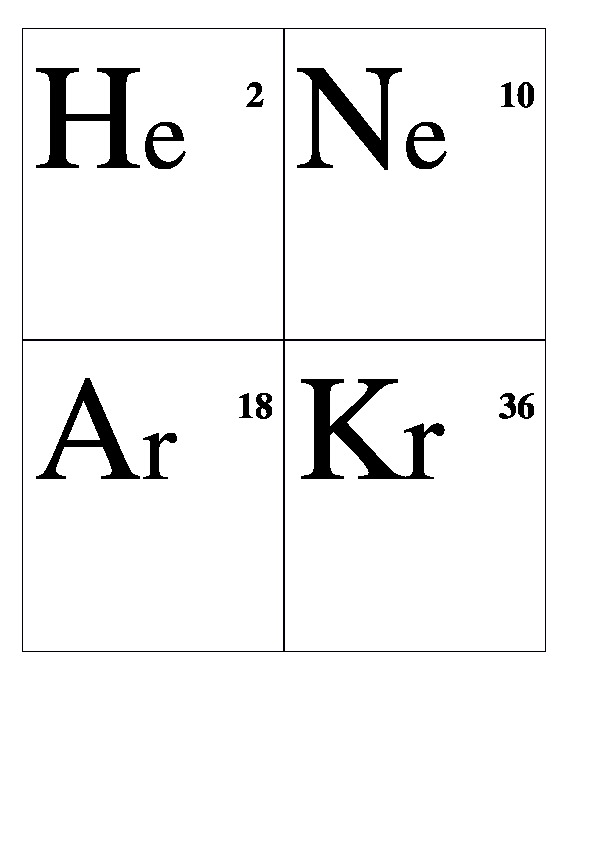
Демонстрационные карточки "Неметаллы" (без названий). 8 класс.


Бесплатный просмотр. Свидетельства участникам
для аттестации за минуту.
Читайте также:




