Современное представление о строении вещества сообщение
Обновлено: 05.07.2024

Современные представления о строении атома
Элемент ЕГЭ: 1.1 Современные представления о строении атома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов.
Современные представления о строении атома

Атом – химически неделимая электронейтральная частица, которая состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Атомы не имеют заряда (нейтральны). Если атом присоединяет один или несколько электронов, он приобретает отрицательный заряд и превращается в анион. Если атом теряет один или несколько электронов, он приобретает положительный заряд и превращается в катион. Заряд иона указывают арабской цифрой и знаком после символа атома.
Состав ядра: А = Z + N, где А — массовое число; Z — протонное число (число протонов); N — число нейтронов.
Элементарные частицы
Порядковый номер элемента в периодической системе:
- Заряд ядра атома
- Число протонов в ядре атома
- Число электронов в атоме

Нуклиды – разновидности атомов с фиксированным массовым числом А, числом протонов Z и нейтронов N в ядре.

Основные положения квантовой теории строения атома:
- Дискретность энергии электрона
- Двойственная (корпускулярно-волновая) природа электрона
- Невозможность определения траектории электрона (принцип неопределенности)
Относительная атомная масса элемента (Ar)
Физическая величина, показывающая, во сколько раз средняя масса атомов данного элемента больше 1/12 части массы изотопа углерода 12 С.

Атомные орбитали
Орбиталь — пространство вокруг ядра, в котором нахождение электрона наиболее вероятно (вероятность более 90%)

Порядок заполнения орбиталей в основном состоянии
1) Принцип наименьшей энергии. Электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.


2) Принцип Паули. На каждой орбитали могут находиться не более двух электронов, причём спины их противоположны.
Спин электрона — свойство электрона, характеризующее его способность взаимодействовать с магнитным полем. Может принимать два значения (положительное и отрицательное).

Последовательность заполнения орбиталей электронами в основном состоянии:
Энергетические уровни и подуровни

Элементы, у которых идет заполнение s-подуровня, называют s-элементами.
Элементы, у которых заполняется р-подуровень, называют р-элементами.
Элементы, у которых заполняется d-подуровень, называют d-элементами.
Элементы, у которых заполняется f-подуровень, называют f-элементами.
Распределение электронов в атоме по энергетическим уровням (электронным слоям) и подуровням
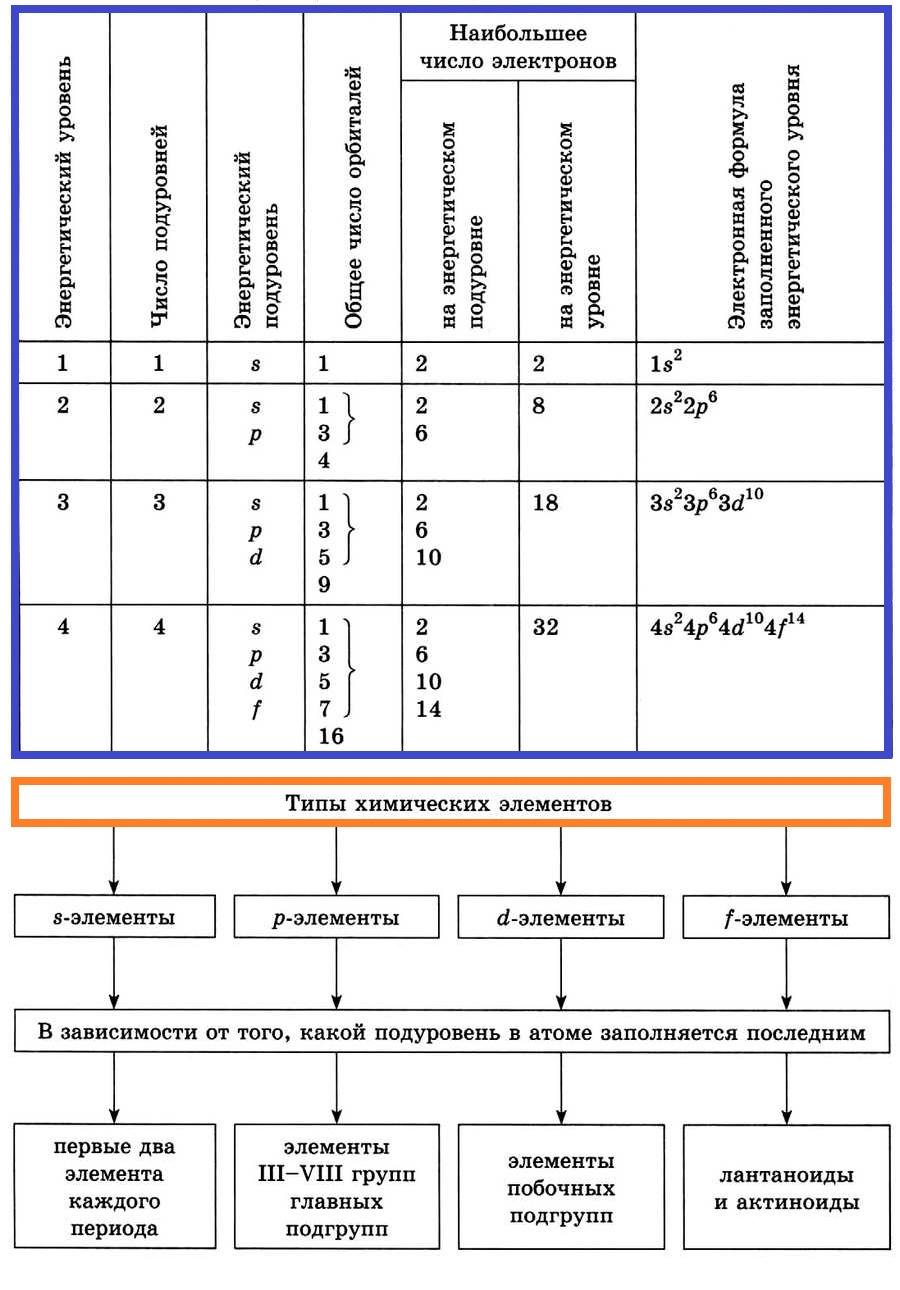
Электроны, относящиеся к последнему энергетическому уровню, называют внешними (валентными) электронами.
Строение электронных оболочек атомов первых четырёх периодов
Распределение электронов по орбиталям атома называют электронной конфигурацией атома, или электронной формулой.
Строение элементов первого периода

Строение элементов второго периода

Строение элементов третьего периода

Строение элементов четвёртого периода

Основное и возбуждённое состояние атомов
Наиболее устойчивое состояние атома, в котором энергия его электронной оболочки минимальна, называется основным состоянием атома. Любые другие состояния атома называют возбужденными состояниями.

Для возможности перехода атома в возбуждённое состояние необходимо выполнение одновременно двух условий:
- наличие спаренных электронов;
- наличие вакантных орбиталей.

Читайте также:

