Сообщение про любой металл из таблицы менделеева
Обновлено: 27.06.2024
В квартире под номером один живёт удивительный элемент — водород H. Он рекордсмен сразу в нескольких номинациях. Это и самый простой, и самый распространённый в природе элемент. На него приходится более 90% всех атомов видимой Вселенной. В обычных условиях он существует в виде самого лёгкого газа: один литр его весит меньше 0,09 г. При охлаждении до −253°С водород переходит в жидкое состояние, превращаясь в самую лёгкую жидкость: десятилитровое ведро такой жидкости весило бы всего 708 г. Водород — единственный химический элемент, все семь братьев-изотопов которого имеют собственные имена. Наиболее известные из них — протий ( 1 H), дейтерий ( 2 H или D) и тритий ( 3 H или T). Имена других тяжёлых изотопов водорода сегодня редко используются. В недрах звёзд водород превращается в гелий. В результате этой реакции выделяется огромное количество энергии, ничтожная часть которой (одна двухмиллиардная!) попадает на Землю. Благодаря этой энергии и существует жизнь на нашей планете, существуем мы.
Самый лёгкий металл расположился этажом ниже под водородом. Это литий Li. Его плотность составляет всего 0,534 г/см 3 , он почти в два раза легче воды. Самый тяжёлый металл — осмий Os — занимает квартиру номер 76. Изготовленный из него куб с ребром 1 м весил бы 22,59 т. Он на сотые доли процента опережает своего соседа из квартиры 77 (иридий Ir) в борьбе за звание элемента с самой высокой плотностью.
Удивительно красивая молекула фуллерена — одной из аллотропных форм углерода, открытой в 1985 году
Две соседние с углеродом квартиры занимают рекордсмены по распространённости. Азот N (элемент номер семь) — самый распространённый элемент в атмосфере (чуть более 78% по объёму). Появившийся в атмосфере нашей планеты около двух миллиардов лет назад кислород (элемент номер восемь) держит пальму первенства по распространённости в литосфере (почти 49% по массе) и гидросфере Земли (86% веса всех океанов), а также в теле человека (около двух третей по массе). Так, в 70-килограммовом представителе вида Homo Sapiens на долю кислорода O приходится почти 45 кг. Согласно данным журнала New Scientist, опубликованным в декабре 2005 года, эмпирическая формула человеческого тела имеет вид:
В ней кислород уступает водороду по количеству атомов, но значительно превосходит его по массе.
Химический состав человеческого тела, масс. %
Антиподы азота и кислорода занимают квартиры под номерами 85 и 86. Имя первого — астат At (от греческого αστατος — ‘неустойчивый’) — говорит само за себя: все его изотопы — короткоживущие (период полураспада самого устойчивого 210 At составляет чуть более восьми часов). Именно поэтому астат самый редкий природный элемент Периодической таблицы. По разным данным, его содержание в земной коре в любой конкретный момент времени не превышает одного грамма. Радон Rn, занимающий 86-ю квартиру, самый редко встречающийся в атмосфере элемент — его содержание в ней всего около 0,0000000000000000001%. При стандартных температуре и давлении радон — самый тяжёлый из газообразных простых веществ: 1 литр его весит 9,73 г.
Несмотря на то что квартиры двух других элементов расположены на одной площадке (во втором периоде), их хозяева являют собой полную противоположность друг другу. В девятой квартире проживает самый электроотрицательный и самый активный из всех элементов-неметаллов — фтор F. Даже благородные газы — ксенон Xe и криптон Kr — пасуют перед этим химическим монстром. В его атмосфере горит, казалось бы, самое несгораемое вещество — вода. Сила фтора как окислителя настолько велика, что кислород окисляется в его атмосфере, образуя фториды OF2, O2F2 и O3F2! Напротив, сосед фтора, проживающий в десятой квартире, — неон Ne славится своим олимпийским спокойствием и с недавних пор носит титул самого инертного химического элемента. Это звание закрепилось за ним после того, как в марте 2018 года журнал American Scientist опубликовал ошеломляющую статью о способности гелия образовывать соединения с некоторыми элементами. Причём это происходит без образования классической химической связи, то есть без участия валентных электронов. Напротив, ни одного устойчивого соединения неона до сих пор идентифицировать не удалось.
Квартиру номер 26 занимает один из семи металлов древности. Вероятно, железо Fe — самый первый металл, с которым познакомился человек. Это единственный химический элемент, имя которого по праву запечатлено в названии целой исторической эпохи — железного века. Да и сегодня, в период широкого использования полимеров и искусственных материалов, железо по-прежнему верно служит человеку. По данным Королевского химического общества, его доля среди всех получаемых металлов достигает 90%. Большая часть железа идёт на производство стали.
Ртуть — единственный металл, который находится в жидком состоянии при нормальных условиях — температуре 25°С и давлении 1 атм. Фото Александра Понамова / Wikimedia Commons / CC BY-SA 3.0
Чемпион по тугоплавкости при нормальных условиях — вольфрам W — проживает в квартире номер 74. Он начинает плавиться при 3422°С. Вольфрам — обладатель и самой высокой температуры кипения (5555°С), сравнимой с температурой поверхности Солнца. Неподалёку от самого тугоплавкого расположился самый легкоплавкий металл ртуть Hg, находящийся в жидком состоянии при температуре выше −39°С. Это самый загадочный и необыкновенный металл, известный человеку с незапамятных времён. Алхимики рассматривали ртуть как главное действующее начало философского камня. На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
А настоящее серебро Ag расположилось в квартире номер 47. Благодаря наивысшей электропроводности и отражательной способности серебро давно с успехом используется в электронике, электротехнике и при изготовлении зеркал. По данным Института серебра (The Silver Institute, USA), мировой спрос на серебро в 2018 году вырос на 4%, а его добыча достигла почти 30 тысяч тонн.
На земле весь род людской
Чтит один кумир священный,
Он царит над всей Вселенной,
Тот кумир — телец златой!
Несмотря на то что серебро, золото и платина — мерила богатства, по стоимости они не идут ни в какое сравнение с некоторыми искусственно полученными металлами. Самым дорогим химическим элементом считается один из изотопов калифорния 252 Cf, за один грамм которого придётся выложить 27 миллионов долларов США! Его ежегодное производство составляет около 40 мкг, а общий мировой запас, вероятно, не превышает 8 г. Уникальность калифорния ещё и в том, что он является очень мощным источником нейтронов, что позволяет использовать его в медицине и ядерной физике.
Завершающий на сегодняшний день седьмой период таблицы элемент, имеющий порядковый номер 118, не только самый тяжёлый (по массе), но, вероятно, и самый скандальный. Дело в том, что его рождение связано с крупным научным скандалом. В мае 1999 года физики всё той же лаборатории в Беркли опубликовали в журнале Physical Review Letters статью, в которой сообщили о получении желанного элемента. Когда их коллегам из Германии и Японии (а затем и в самом Беркли) не удалось воспроизвести результаты, возникли подозрения в достоверности полученных данных. Два года спустя результаты были признаны сфальсифицированными, статья отозвана, а фальсификатор уволен.
Сегодня физики и химики спорят, есть ли граница у периодической системы и сколько химических элементов может она содержать. Мнения разделились: кто-то полагает, что таблица близка к завершению, кто-то надеется, что могут существовать элементы, имеющие порядковые номера 170 и более. Сейчас начинается строительство восьмого этажа. Как знать, скольким новосёлам ещё предстоит обживать новые квартиры!
Какой самый интересный и сумасшедший элемент в периодической таблице химических элементов?

Почти любой элемент в периодической таблице Менделеева удивителен и имеет долю сумасшествия. Сера, похоже, не принадлежит к сумасшедшему клубу. Но тем не менее факты о ней удивительно интересны.
Учтите, что вода – это H20. Это необходимо для жизни. Она не пахнет. Это жидкость.
Цезий как эталон самого точного времени в мире

Цезий – прекрасный пример управляемого хаоса. Этот элемент известен как радиоактивный отход от ядерных взрывов. Цезий является одним из пяти элементов, которые находятся в жидком состоянии при комнатной температуре.
Но самое удивительное изменение состояния цезия происходит, когда вы помещаете его в воду. Вот что при этом происходит:

Также у цезия электронные переходы настолько точны, что он стал использоваться в качестве основного стандарта для определения самого точного в мире времени.
Так, секунда – это время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133.
Цезий применяется в атомных часах. Вот как они выглядят:

Эти атомные часы настолько точны, что не потеряют ни секунды за 20 миллионов лет. Это безумие, как такой нестабильный элемент может быть использован, чтобы стать нашим точным определением времени.
Олово – элемент, который совершает самоубийство!
Олово (Sn) – это 50-й элемент периодической таблицы Менделеева.

Олово издавна известно человечеству. Так, есть доказательства, что человек знал об олове уже в IV тысячелетии до нашей эры. Этот металл был очень дорог и мало кому доступен. Именно поэтому изделия из него редко встречаются среди римских и греческих древних находок. Примечательно, что об олове даже есть информация в Библии (Четвертой Книге Моисея).


Примечательно, что вокруг олова в нашем мире есть множество интересных легенд. Одна из самых интересных – это легенда о том, как свойства олова сыграли с Наполеоном Бонапартом злую шутку.
Легенда гласит, что это необычное химическое поведение олова способствовало падению императора Наполеона Бонапарта. В те времена олово использовалось для изготовления пуговиц и других застежек солдатской формы. Пока армия французов шла в сторону России, с пуговицами солдат было все порядке. Но все изменилось, когда солдаты ступили на российскую землю, где свирепствовали морозы.

Вот тут-то и началась метаморфоза с оловянными пуговицами, которые начали разрушаться, в результате чего форма не могла согреть солдат. В действительности же олову требуется несколько месяцев, чтобы буквально уничтожить себя, преобразовавшись в другую форму. Но, с другой стороны, когда французы вторглись в Россию, температура была ниже минус 30 ° C.
Так что, как полагают некоторые историки и химики, это и послужило сильным толчком для перехода оловянных пуговиц в порошкообразную форму. Правда, все это исторически не подтверждено. А согласитесь, легенда хорошая. Ведь один факт, что легендарный Наполеон потерпел крах своей армии на территории России из-за проблем с форменным обмундированием и виной всему химические свойства олова… Звучит красиво!
Если вам интересно, вот видео, которое показывает переход олова из его бета-формы в альфа-форму:
Висмут
Обычно это выглядит так:

Но при правильных условиях это может выглядеть так:

Некоторые другие интересные факты о висмуте:
- Висмут (висмут-209, самый распространенный изотоп) радиоактивен, но имеет один из самых длинных периодов полураспада из когда-либо измеренных. Его период полураспада составляет 1,9×10 ^ 19 лет, или примерно в миллиард раз дольше, чем существует Вселенная.
- Висмут — самый сильный природный диамагнитный металл из известных. Диамагнитные материалы при воздействии магнитного поля создают в ответ отталкивающее поле. Итак, с некоторыми сильными магнитами вы можете заставить висмут подниматься.
- Висмут обладает необычайно низкой токсичностью для тяжелых металлов. Его соседи по периодической диаграмме – полоний, сурьма и свинец – довольно токсичны, но висмут относительно безвреден. Из-за этого висмут исследуется как альтернатива свинцу для некоторых применений.
- Большинство людей употребляют висмут в своей жизни. Активным ингредиентом пепто-висмола является субсалицилат висмута.
Франций
Франций ОЧЕНЬ реактивный и имеет атомный номер 87.
Франций очень реакционноспособный и радиоактивный элемент. Поскольку период его полураспада составляет 22 минуты, он очень реактивный.
Фактически это никогда не проверялось из-за рисков, которые это несет. Тем не менее ученые сделали копию того, на что это было бы похоже, если бы вы уронили его в воду.
Посмотрите, к чему это привело бы:
Вот некоторые фотографии, на которых тестировался франций (но только с небольшим количеством)
Наконец, вот так выглядит франций.
Московий
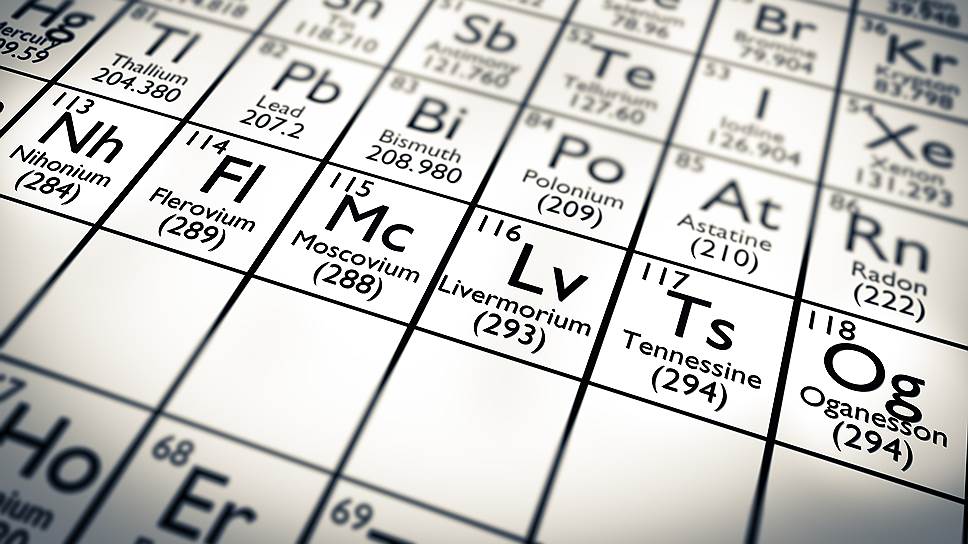
Предполагается, что московий – непереходный металл, похожий на висмут. Плотность его ожидается на уровне 13,5 г/см 3 , что выше плотности свинца и несколько меньше плотности ртути. Расчетная температура плавления московия ожидается около 400 °C, то есть он должен быть несколько менее легкоплавким, чем висмут.
Галлий

Галлий был предсказан Дмитрием Менделеевым до его открытия. При создании периодической таблицы химических элементов Менделеев на основе ранеее открытого периодического закона оставил в таблице вакантные места для третьей группы неизвестных элементов.
Галлий же был открыт, выделен и изучен в виде простого вещества французским химиком Полем Эмилем Лекоком де Буабодраном. Это произошло 20 сентября 1875 года.
Этот элемент является постпереходным металлом, перекрывающим промежуток между переходными металлами и металлоидами, и поэтому имеет тенденцию быть мягче с низкой электропроводностью, чем переходные металлы.
Галлий имеет температуру плавления в 29,7 ° С, в то время как его температура кипения находится на уровне около 2204 ° С, что делает этот металл элементом с самым высоким соотношением температуры кипения и температуры плавления.
Он менее токсичен, чем ртуть, поэтому является более экологически чистым выбором для высокотемпературного термометра.
Жидкий галлий расширяется на 3,1 процента при затвердевании.
Жидкий галлий очень легко охлаждается.
Водород

Многие химические элементы каждый по-своему удивителен и уникален. Например, уран способен к массовому разрушению, цезий (читайте о нем выше) имеет крутой эффект взрыва при контакте с водой, а галлий обладает очень низкой температурой плавления и не такой вредный, как ртуть.
Но это всего лишь цветочки по сравнению с настоящим безумным элементом периодической таблицы Менделеева. Один элемент намного, намного более удивительный, чем любой в этой таблице, – речь идет о невероятном водороде. Вот лишь некоторые из уникальных свойств водорода.
Это основной компонент звезд во Вселенной – солнечных гигантских огненных шаров с невероятным количеством энергии. Вы только вдумайтесь: 0,0000066% энергии нашего Солнца питает всю Землю.

Водород стоит за созданием всех других элементов. Этот элемент самый распространенный во Вселенной. От всей барионной массы водород во Вселенной составляет 75 процентов. Звезды чаще всего состоят из водородной плазмы. По сути, без водорода не было бы ничего.
Вы наверняка еще со школы помните, что водород является компонентом воды. А вода именно та вещь, из чего состоят практически большинство всех живых существ на нашей планете.
Также некоторые спирты в значительной степени зависят от водорода. Да-да, речь идет о знакомом нам этаноле (алкоголе), который может затуманить нам мозг на какой-нибудь вечеринке.
На самом деле есть безумное количество вещей, за которыми стоит водород. Включая каждого из нас. То есть без водорода не было бы и нас.
Хотите узнать, на что способен чистый водород? Тогда посмотрите на аварию дирижабля Гинденбург. Это была настоящая трагедия, виной которой был безумный водород.
Водород особняком стоит в периодической таблице химических элементов. Он изолирован от любого другого элемента и является единственным элементом, который не имеет ни одного нейтрона.
Если вы хотите игрушку, тогда используйте галлий. Это очень весело. Но если вы хотите почувствовать вкус настоящего безумия, ни один элемент не может быть более безумным, чем всем знакомый водород. Да, для всех нас водород – знакомый всем элемент, но это не меняет его свойства.
Миллионы лет назад наши далекие предки изготавливали себе инструменты из дерева и камней, но спустя тысячелетия они научились пользоваться металлами. С этого момента человечество начало развиваться с немыслимыми темпами и все дошло до того, что большинство окружающих нас объектов сделано из железа, алюминия и других разновидностей этого материала. Практически все металлы хорошо проводят электричество и тепло, при определенных условиях они пластичны и отлично подходят для изготовления различных деталей для электроники, а также обладают характерным металлическим блеском. Но в периодической таблице Менделеева есть металлы, которые обладают уникальными свойствами, которыми не могут похвастаться все остальные. Они по-своему удивительны, и когда-то давно этим металлам присваивали чуть ли не волшебные качества. Итак, давайте перечислим их, а также узнаем о свойствах и других интересных особенностях?

Оглянитесь вокруг — мы окружены металлами
Самый жидкий металл
Ртуть считается самым жидким металлом и, в то же время, одним из самых опасных для человеческого организма. Он практически всегда пребывает в жидком состоянии, потому что температура его плавления равна -38 градусам Цельсия. Именно поэтому этот металл используется в градусниках — при увеличении температуры, жидкость расширяется. Поскольку градусник сделан в виде стеклянной трубочки, расширяться она может только в одном направлении. Чтобы на показатели градусника не влияли другие условия вроде атмосферного давления, из трубочки выкачан воздух.

Несмотря на свою опасность, ртуть используется даже в повседневных вещах
Третья особенность ртути заключается в том, что при вдыхании его паров человек получает сильное отравление — опасные вещества оседают в легких. Симптомы отравления включают в себя слабость, понижение аппетита, боль при глотании, набухание десен и сильная боль в животе. Из-за своей ядовитости, ртуть входит в десятку химических веществ, представляющих опасность для общественного здоровья.
Самый тугоплавкий металл
А теперь давайте поговорим о полной противоположности ртути — металле, именуемом как вольфрам. В то время как ртуть может расплавиться на человеческой ладони, для расплавления вольфрама необходима температура на уровне 3422 градусов Цельсия.

Сам по себе вольфрам не опасен, но изделия, в котором он используется, могут убить. Этот металл часто используется как наконечник патронов, которые могут пробить даже бронежилет. Только его добавляют совсем чуть-чуть, потому что вольфрам — очень тяжелый металл.
В 2018 году мой коллега Илья Хель написал интересный материал про Секретное оружие США, где поразмышлял о том, что могут скрывать от нас американские военные. Советую почитать.
Из-за своей тугоплавкости, вольфрам трудно поддается деформации, поэтому в чистом виде его используют очень редко. Как правило, изделия из вольфрама имеют и другие примеси — они делают его более податливым и значительно уменьшают вес.
Самый твердый металл
Самым твердым и при этом легким металлом на нашей планете считается титан. Благодаря своим свойствам, он активно используется в авиации и кораблестроении — материал отлично подходит для изготовления корпусов самолетов и кораблей. К тому же, благодаря прочности и легкости, из титана изготавливают бронежилеты. Этот металл безопасен для человеческого организма, поэтому часто применяется в медицине для изготовления инструментов и даже протезов — искусственных частей тела.

При нагревании, титан начинает поглощать кислород, хлор, азот и другие газы. Благодаря этому удивительному свойству, металл используется в различных фильтрах — пропуская различные газы через нагретые до 600 градусов Цельсия титановые трубки, можно очистить их от примесей. Таким же образом можно очистить воду от кислорода, что особенно полезно в пищевой промышленности. Считается, что содержащийся в воде кислород ухудшает качество некоторых продуктов — как минимум, он может сократить срок годности пива.
Самый радиоактивный металл
Единственным металлом, который может использоваться в качестве топлива в ядерных реакторах, является уран. Многие люди считают его очень опасным из-за высокой радиоактивности. Однако, природный уран безопасен для здоровья человека, а опасность представляет его разновидность под названием U-235 — именно она используется в ядерных реакторах.

Когда-то давно из природного урана даже изготавливали посуду. Например, осколки желтого стекла с содержанием урана были найдены на территории итальянского города Неаполь — по расчетам ученых, стекло было изготовлено в 79 году нашей эры. Он был безопасен для людей и никаких намеков на радиацию вроде свечения не наблюдалось.
Природного урана U-235, пригодного для использования в ядерных реакторах, сегодня в природе очень мало — на протяжении долгих лет он просто улетучился. Зато, миллиарды лет назад его было очень много, и ядерные реакции могли запускаться прямо на природе,без участия человека. Так, на территории африканской страны Габон, около 1,8 миллиарда лет назад происходила естественная реакция деления ядер урана. Уран горел на протяжении сотен лет, но в итоге реакция прекратилась из-за истощения запасов металла.
Самый тяжелый металл

Осмий, кстати, очень красив
Благодаря своей твердости, осмий часто используется в механизмах, а именно в местах, где происходит сильное трение. Также он используется в изготовлении нитей для ламп накаливания. Ядовитые свойства возникают только на открытом воздухе — металл превращается в токсичное вещество тетраоксид осмия, которое вызывает раздражение глаз, поражение верхних дыхательных путей и даже воспаление почек.
Самый стойкий металл
Самым стойким металлом считается иридий — его невозможно растворить ни в одной кислоте. Из-за стойкости, этот металл используется в Международном бюро мер и весов — из него создан эталон килограмма. Этот цилиндр из иридия необходим для того, чтобы у всех стран было единое представление о том, сколько именно должен весить килограмм. Это важно, потому что любое отклонение может стать причиной неисправности в самолётах и кораблях и, впоследствии, серьезной катастрофы.

Иридий — показатель того, сколько должен весить килограмм
Также иридий используется при изготовлении денег. Например, в африканской стране Руанде была выпущена иридиевая монета номиналом 10 руандийских франков. Можно сказать, что это самая устойчивая к химическому воздействию монета. Повредить ее можно разве что кину в сосуд со фтором — сильнейшим окислителем. Но разрушительная реакция начнется только при нагревании до 450 градусов Цельсия.
Самый дорогой металл
Многие люди инвестируют в металлы и одним из самых дорогих сегодня является золото. По курсу за июнь 2020 года, грамм золота стоит около 4000 рублей, тогда как цена той же массы платины еле достигает 2000 рублей. Чуть выше мы уже выяснили, что добывать золото из ртути — это очень дорогой процесс. Поэтому, получением золота занимаются работники аффинажных заводов — грубо говоря, они извлекают золота из смесей других металлов.

Золото уже тысячелетиями сводит людей с ума
Так как персонал работает с очень дорогим металлом, в заводах действует строгий контроль. Если у человека, например, есть золотой зуб — охрана всегда проверяет, находится ли он на месте. А то вдруг человек избавится от золотого зуба и решит пронести кусочек драгоценного металла, поместив его в освободившемся пространстве между зубами? В некоторых аффинажных заводах работники проходят внутрь голыми и облачаются в рабочую одежду внутри.
Самый редкий металл
Франций — самый редкий металл. По расчетам ученых, в земной коре его концентрация равна всего лишь 340 граммам. Получить больше урана можно искусственным путем, но для этого необходимо запускать ядерные реакции.

Франций очень редкий и мало где используется
Франций очень радиоактивен, поэтому на данный момент он практически нигде не используется. Однако, иногда ученые все же используют разновидности франция в ходе научных исследований. Также предпринимались попытки диагностики рака с использованием технологий, где франций тоже был задействован.
Самый легкий металл
Звание самого легкого металла, по праву достается литию. Он окрашен в серебристо-белый цвет и настолько мягок, что легко режется ножом. Так как он является самым легким металлом в таблице Менделеева, при попадании в воду он всплывает на поверхность.

А вот и он — литий
Для многих это может стать открытием, но устройство с литием вы прямо сейчас можете держать в руке — это ваш смартфон. В мобильных устройствах используются литиевые аккумуляторы, которые компактны, но обеспечивают работу устройств от одного заряда только на протяжении нескольких дней. Ученые пытаются улучшить показатели литий-ионных батарей, но пока это им никак не удается.
Возможно, в будущем вместо литий-ионных батарей будут использоваться совершенно другие аккумуляторы. Какие? Читайте в этом материале.
Самый дорогой промышленный металл

Калифорний — радиоактивный красавец
Этот металл очень радиоактивен, поэтому никаких поделок из него не сделаешь. Зато он нужен ученым во время проведения серьезных испытаний. Хотя, в теории, его можно использовать при создании атомной бомбы. Но вышеупомянутый уран стоит гораздо дешевле, поэтому все используют именно его.
В периодической таблице Менделеева еще много интересных элементов, но эти — по моему мнению, самые интересные металлы. Примечательно, что ученые до сих пор занимаются разработкой металлов с интересными свойствами. В 2019 году мой коллега Владимир Кузнецов рассказал о материале, который не тонет в воде — рекомендую почитать!

Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:

оксид лития

пероксид натрия

надпероксид калия




- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:



- С серой реагируют все металлы, кроме золота и платины:

- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:


- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.


Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода














Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Читайте также:

