Сообщение применение биоматериалов в медицине
Обновлено: 07.07.2024
Наука о биоматериалах - это область материаловедения .
Резюме
Определение
Понятие биоматериалов многозначно, есть разные определения. В области биологии и медицины часто принимается следующее определение:
« Любой материал, природный или нет, составляющий всю или часть живой структуры или биомедицинского устройства, который выполняет или заменяет естественную функцию. "
В 1987 году Уильямс определил биоматериал как:
Биоматериал - это в основном материал, который используется и адаптирован для медицинских целей. Это может быть биоинерция, основная роль которой заключается в замене одной или нескольких функций органа - например, замена клапанов сердца - но они также могут быть биоактивными, способными иметь сильное взаимодействие с окружающей средой, в которой они находятся. имплантированный - подобно покрытию протезов бедра слоем гидроксиапатита (минеральная часть кости), который улучшает биосовместимость и интеграцию имплантата в костную ткань. Кроме того, биоматериалы также используются в стоматологии , хирургии и доставке лекарств (благодаря инструментам, введенным в организм и позволяющим доставлять медицинские вещества в течение длительного времени).
Определение биоматериала включает не только искусственные биоматериалы, изготовленные из металлов или керамики . Биоматериал также может быть аутотрансплантатом , аллотрансплантатом или ксенотрансплантатом, используемым в качестве трансплантата материалов.
Приложения
Биоматериалы имеют несколько медицинских или парамедицинских применений, в том числе:
- Офтальмология
- Контактные линзы (их часто исключают из прицела из-за их короткого времени контакта с органическими тканями тела)
- Имплантаты
- Подушечки для восстановления
- Вязкие продукты задней камеры
- Реставрационные материалы и пломбирование зубов и костей
- Профилактическое лечение
- Ортодонтия
- Лечение парондонта и пульпы
- Имплантаты
- Челюстно-лицевая реконструкция
![]()
- Сердечные клапаны
- Оборудование для экстракорпорального кровообращения (оксигенаторы, трубки, насосы и др.)
- Сосудистые протезы
- Материал и стенты для коронарной ангиопластики просвета
- Эндовенозные катетеры
- Диализаторы
- Пакеты для перитонеального диализа, катетеры и трубки
- Переносная искусственная почка
- Протезы полового члена
- Материалы для лечения недержания мочи
![]()
- Искусственная поджелудочная железа
- Переносные и имплантируемые насосы
- Системы контролируемой доставки лекарств
- Биосенсоры
- Материалы и имплантаты
- Хирургические дренажи
- Тканевые клеи
- Искусственная кожа
- Контрастные СМИ
- Продукты для эмболизации
- Продукция для интервенционной радиологии
Несмотря на успехи в исследованиях, часто возникают проблемы с биосовместимостью, которые необходимо решить, прежде чем эти продукты можно будет продавать и использовать в клинических условиях. Вот почему к биоматериалам часто предъявляются те же требования, что и к новым лекарственным препаратам. Все компании, работающие в этой области, также должны соблюдать требования по отслеживанию всей своей продукции. Если будет обнаружено неисправное оборудование, будут проверены и другие устройства в том же диапазоне.
Выбор материалов для биоматериалов
Необходимо учитывать множество параметров, чтобы эти материалы были максимально биологически совместимы с телом и его функциями. Перед вводом в эксплуатацию они проходят испытания in vitro и in vivo , наиболее важным из которых является испытание in vitro, которое является важным условием валидации конкретного биоматериала.
Металлы и металлические сплавы
Наиболее широко используются нержавеющая сталь и титан , сочетающие хорошую коррозионную стойкость и хорошие механические свойства. Однако из-за этих материалов возникают некоторые проблемы, которые до сих пор не решены. Среди них мы можем насчитать:
- Коррозии электрохимические и устойчивость, действительно коррозионностойкости материала не является абсолютными, материал устойчивы к коррозии , но конспективно
- механизмы неэлектрохимической деградации, включая взаимодействия между белками и металлом,
- иммунные реакции и реакции гиперчувствительности,
- адаптация механических свойств,
- проблемы с трением и мусором.
Керамика
Что касается биоматериалов, наиболее распространенными материалами являются оксид алюминия и диоксид циркония . В основном они используются для изготовления головок бедра и зубных имплантатов. Основные проблемы, с которыми сталкиваются керамические изделия:
- Поверхностная активность,
- адгезия белков или клеток к поверхности,
- долговечность,
- механизмы деградации,
- устойчивость к разрушению.
Полимеры
В биоматериалах используется много полимерных материалов. Два основных направления использования этих материалов касаются:
- Поиск функциональных полимеров , вероятно, имеет химическую функцию на границе раздела тканей материала живущих. Это, например, достигается путем фиксации ионизированных частиц на полимере, что позволяет улучшить реконструкцию костей или связок. Эта функциональность также может быть результатом модификации состояния поверхности полимера.
- Поиск рассасывающихся полимеров , таких как сополимеры молочной и гликолевой кислоты , которые могут быть использованы в ортопедии и травматологии хирургии , или полиангидриды или полиаминокислоты , которые используются в депо форм лекарственных средств.
Существует несколько проблем, связанных с применением полимеров в биомедицинском секторе, и не только из-за совместимости с организмом:
- Неустойчивость к гамма-излучению,
- Реактивность к некоторым видам лекарств,
- Кальцификация (отложение и фиксация известковых отложений в органических тканях),
- Риски, связанные с добавками, низкомолекулярными компонентами, продуктами разложения in vivo , остаточными продуктами стерилизации,
- Отсутствие баз данных для оценки свойств поверхности, реакций биосовместимости , мутагенности / канцерогенности и т. Д.
Полимеры, по природе своей молекулярной конструкции на основе повторов, являются кандидатами для разработки сложных постоянных или временных протезов или для замены существующих в настоящее время материалов в природе.
Материалы натурального происхождения
Исследователи также используют материалы природного происхождения для изготовления биоматериалов. Среди всех этих материалов наиболее распространены:
- биологические ткани: клапаны свиньи, сонная артерия говядины .
- что хитин : экстракт краб оболочка для реконструктивной хирургии и искусственной кожи;
- фуканы: экстракты морских водорослей, используемые, в частности, в антикоагулянтах;
- целлюлозы : используется для диализных мембран или в качестве протеза тазобедренного сустава цемента;
- коралл : используется в ортопедическом и челюстно;
- коллаген: извлекается из кожи животных или плаценты человека и используется для
- косметология и косметическая хирургия
- кровоостанавливающие повязки и губки
- восстановление мягких и твердых тканей
- искусственная кожа.
Заключение
Биоматериал является альтернативой, наиболее серьезно рассматриваемой врачами с целью продления жизни человеческого тела. Эта область материаловедения постоянно развивается, она требует непрерывного обучения специалистов, обладающих как большим знанием человеческого тела и его требований, так и очень хорошими знаниями материалов. Таким образом, область биомедицинской науки - это область, требования к которой будут становиться все более важными в гонке за увеличение продолжительности жизни людей.
В настоящее время на территории Франции работают несколько лабораторий, среди которых можно выделить:
БИОМАТЕРИА́ЛЫ (материалы медико-биологического назначения), природные и синтетич. материалы, предназначенные для создания изделий, устройств и препаратов, применяемых в медицине, биотехнологии, с. х-ве, косметологии и пр., и используемые для обеспечения и оптимизации жизнедеятельности человека, животных, растений, микроорганизмов. Б. функционируют в непосредств. контакте с живыми тканями и клеточными объектами.
![]()
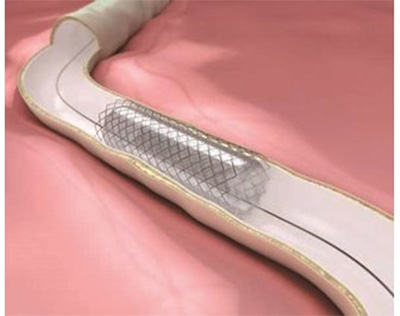
Биоразлагаемые стенты изготавливаются из биоразлагающихся или абсорбируемых материалов, которые характеризуются совместимостью с тканями организма и легко подвергаются биоразложению. При введении (имплантации) разлагающихся стентов на участке суженного кровеносного сосуда на первых этапах этот компонент эффективно расширяет этот сосуд, однако с течением времени стенд постепенно разлагается. Продукты разложения компонента выводятся из организма как продукты метаболизма или поглощаются организмом и впоследствии используются в других процессах. Таким образом, стенты не оказывают длительного воздействия на функционирование сосудов.
Большая часть стентов из разлагающихся полимеров получается из поли-l-молочной кислоты (PLLA). Полимолочная кислота — это термопластичный алифатический полимер, который может разлагаться с образованием молочной кислоты в результате самокатализируемой реакции гидролиза. Это вещество в конечном итоге участвует в метаболизме организма, превращаясь в трикарбоновую кислоту (TCA) и разлагаясь до воды и диоксида углерода.
Полимолочная кислота обеспечивает дополнительную радиальную прочность, сочетая в себе частично кристаллические полимеры. За счет сочетания аморфных полимеров в течение определенного периода времени обеспечивается равномерное выделение нанесенных на стенты лекарств. На этом фоне стенты также подвергаются равномерному разложению. Такое разложение происходит в течение 2–4 лет.
В принципе, стенты из полимолочной кислоты должны иметь в 2,4 раза большую толщину стенки по сравнению с аналогичными металлическими стентами — в этом случае компоненты обеспечивают аналогичную радиальную прочность. Стенты Abbott обеспечивают недостаточную радиальную прочность, поскольку они способны сжиматься на 16,6%.
Стент Игаки-Тамаи (Igaki-Tamai Stent)
Стент Игаки-Тамаи является первым биоразлагающимся стентом, который не обеспечивает выделение лекарственных препаратов. Размер основания стента составляет 170 мкм. Стент изготавливается из полимолочной кислоты. Для этого компонента были проведены клинические испытания путем вживления в организм человека. В результате клинических исследований было определено, что стент способен полностью разлагаться в течение 36 месяцев. Стент Игаки-Тамаи получается из термопластичного материала. Для его размещения в определенное положение необходимо воспользоваться зондом 8F. Стент адаптируется под расширение зонда и нагревается контактной средой до 80 °C, после чего подвергается саморасширению под действием температуры тела в течение 30 минут. Нишио и его сотрудники заявили о том, что они ввели стент Игаки-Тамаи 50 пациентам (в общей сложности для коррекции 63 повреждений было введено 83 стента). После 10 лет исследований было определено, что стент из полимолочной кислоты полностью поглощается организмом в течение трех лет. После 10 лет наблюдения за пациентами было выявлено, что доля рецидивов целевых повреждений (TLR) составила 28%.![]()
Стент Abbott
Биоразлагаемый сосудистый стент Abbott Absorb GT1 с течением времени подвергается разложению. Это наиболее комплексно изученный разлагающийся стент, который обеспечивает выделение лекарственных препаратов. Первое поколение стентов Abbott (BVS 1.0) получается из полимолочной кислоты. Размер основания стента составляет примерно 150 мкм, а на поверхность компонента наносится покрытие эверолимуса. Многоцелевые испытания в организме человека проводились на 30 пациентах. В результате этих исследований было оценено влияние BVS 1.0 (отдельный стент размером 3,0 ×12,0 мм или 3,0 ×18,0 мм) на состояние коронарной артерии при симптомах стенокардии или бесшумной ишемии. После шести месяцев исследований было выявлено, что уменьшение просвета (LLL) стента, находящегося в сегменте сосуда, достигло 0,44 мм (11,8%). Радиальная прочность этого стента оказалась недостаточной, поскольку после имплантации многие стенты были подвергнуты сжатию. При пятилетнем наблюдении за пациентами общая доля различных кардиологических осножнений (MACE) составила 3,4%. В течение первых шести месяцев был даже зафиксирован летальный случай, связанный с инфарктом миокарда.Второе поколение стентов Abbott (BVS 1.1) было скорректировано с учетом недостатков BVS 1.0. За счет особой конструкции удалось повысить радиальную прочность компонентов и увеличить площадь рабочей поверхности стента, упростить обращение со стентом и обеспечить возможность хранения его при комнатной температуре.
Стент Reva
Стент Reva — это стент из полииодированного карбоната алкил-тирозина, который был разработан фирмой REVA Medical, Inc., США. Этот компонент может разлагаться в живом организме под действием воды, диоксида углерода, этанола и иодированного алкил-тирозина. Продукты разложения почти не оказывают побочного токсического действия на организм человека и могут поглощаться или удаляться из организма.![]()
Этот расширяющий стент при полном расширении способен покрывать 55% стенки артерии. Поллман и его сотрудники провели первые клинические испытания этого стента в организме человека. В результате исследований ученые выявили большую долю негативных клинических эпизодов (TLR = 67%), которые объяснялись недостаточным расширением стентов в кровеносных сосудах.
По этой причине стент Reva был перепроектирован с применением более прочного полимера, на поверхность которого было нанесено покрытие сиролимуса. Кроме того, в конструкцию стента были введены новые скользящие и замыкающие элементы. Таким образом, был получен стент ReZolve нового поколения. Его клинические исследования были начаты в декабре 2011 года. Все 100% клинических хирургических операций оказались успешными, и в течение трех месяцев у пациентов не наблюдалось никаких осложнений (MACE). Однако механизм размещения стента с помощью зонда ограничивает его использование — он может применяться только в мелких кровеносных сосудах и кровеносных сосудах с большими изгибами. При этом был разработан новый стент ReZolve 2 (6F), который вводится в сосуды без применения зондов. За счет упрочнения используемого полимера радиальную прочность стента удалось увеличить на 30%. Стент ReZolve 2 был подвергнут комплексным испытаниям RESTORE II. Набор кандидатов на проведение испытаний нового стента был начат в 2013 году.
![]()
Стент IDEAL
В стенте IDEAL обеспечивается высокая механическая прочность вдоль всей полимерной цепи на основе тримера ангидрида полимолочной кислоты, салициловой и себациновой кислоты. В этом стенте тример на основе салициловой кислоты и адипата салициловой кислоты используется в качестве основания для нанесения сиролимусового покрытия. Было выявлено, что дополнительное покрытие салициловой кислоты обеспечивает снижение вероятности воспалительных процессов в живых организмах. За счет этого стент превосходит аналоги из других полимеров. Джабара и его сотрудники продемонстрировали безопасность стентов IDEAL первого поколения за счет проведения теста Уиспера (Whisper) (n = 11). При проведении таких тестов на первых стадиях наблюдения не было зафиксировано ни одного осложнения. Однако, возможно, из-за недостаточной дозировки сиролимуса и непродолжительного выделения лекарственных препаратов при использовании этого стента наблюдалось значительное увеличение сегментов кровеносных сосудов, контактирующих со стентом.В стенте IDEAL второго поколения увеличена дозировка нанесенного лекарственного препарата, что позволило сократить скорость выделения лекарственных препаратов и повысить совместимость компонента с тканями организма. Проводятся также специальные клинические тесты других показателей этого стента.
Существуют и другие разлагаемые стенты на основе полимолочной кислоты, такие как стент Amaranth (Amaranth Medical, США), стент Acute (OrbusNeich, США), стент MeRes (Meril, Индия) и стент FADES (Zorion Medical, США). Многие из них проходят стадию доклинических испытаний, поэтому они пока еще не очень широко представлены специалистам.
Перспективы
Использование биоразлагаемых материалов при получении стентов стало революционным открытием.Однако проблема состоит в отсутствии четкого стандарта, определяющего время разложения разлагающихся стентов. Если время разложения будет слишком малым, то может произойти сжатие сосуда, что существенно повысит вероятность развития стеноза. Если же время разложения окажется слишком длительным, то стенд может обрастать тканью, что повышает вероятность формирования тромбоза. Разлагающийся стент, выделяющий лекарственный препарат, характеризуется гиперплазией — может покрываться тканью. Однако скорость выделения лекарственного препарата и скорость разложения стенки должны быть оптимально сбалансированы. В ином случае использование этих компонентов продолжит оставаться ограниченным.
При полном поглощении разлагающегося стента устраняется его воздействие на стенку сосуда (в отличие от постоянного металлического стента). В будущих работах исследователи планируют определить, действительно ли за счет использования разлагающихся стентов можно восстановить целостность сосудов и сосудодвигательную функцию, а также возможно ли одновременно имплантировать пациенту несколько стентов.
Кроме того, проблемным может быть также точное размещение стента после его имплантации. Это объясняется отсутствием четкого представления о расположении стентов из-за того, что на них не наносятся четкие радиоактивные маркеры. Дополнительные проверки должны быть проведены в отношении того, могут ли влиять маркеры на стабильность стентов.
Благодаря развитию науки и техники такие проблемы могут успешно решаться, что расширяет сферы применения разлагающихся стентов в сосудистой интервенционистской терапии.
![]()
Обзор
В перспективе тканевая инженерия, если и не приведет к бессмертию, то уж точно сделает решение многих современных проблем медицины более чем реальным.
Автор
Редакторы
![]()
В последние десятилетия стали отчетливо проявляться тревожные тенденции старения населения, роста количества заболеваний и инвалидизации людей трудоспособного возраста, что настоятельно требует освоения и внедрения в клиническую практику новых, более эффективных и доступных методов восстановительного лечения больных. На рисунке 1 показано, как изменяется структура заболеваний в настоящее время.
![]()
Рисунок 1. Мировая динамика частоты заболеваний.
На сегодняшний день наука и техника предлагает несколько альтернативных путей восстановления или замены поврежденных или пораженных патологией тканей и органов:
- трансплантацию;
- имплантацию;
- тканевую инженерию.
В рамках данной статьи мы подробнее остановимся на возможностях и перспективах тканевой инженерии.
Тканевая инженерия — современная инновационная технология
Принципиально новый подход — клеточная и тканевая инженерия — является последним достижением в области молекулярной и клеточной биологии. Этот подход открыл широкие перспективы для создания эффективных биомедицинских технологий, с помощью которых становится возможным восстановление поврежденных тканей и органов и лечение ряда тяжелых метаболических заболеваний человека.
Цель тканевой инженерии — конструирование и выращивание вне организма человека живых, функциональных тканей или органов для последующей трансплантации пациенту с целью замены или стимуляции регенерации поврежденных органа или ткани. Иными словами, на месте дефекта должна быть восстановлена трехмерная структура ткани.
Важно отметить, что обычные имплантаты из инертных материалов могут устранить только физические и механические недостатки поврежденных тканей, — в отличие от тканей, полученных методом инженерии, которые восстанавливают, в том числе, и биологические (метаболические) функции. То есть, происходит регенерация ткани, а не простое замещение ее синтетическим материалом.
Однако для развития и совершенствования методов реконструктивной медицины на базе тканевой инженерии необходимо освоение новых высокофункциональных материалов. Эти материалы, применяемые для создания биоимплантатов, должны придавать тканеинженерным конструкциям характеристики, присущие живым тканям:
- способность к самовосстановлению;
- способность поддерживать кровоснабжение;
- способность изменять строение и свойства в ответ на факторы окружающей среды, включая механическую нагрузку.
Клетки и матриксы — основа основ для тканевой инженерии
Наиболее важным элементом успеха является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Источником клеток могут быть ткани организма и внутренние органы. Возможно использование соответствующих клеток от пациента, нуждающегося в реконструктивной терапии, или от близкого родственника (аутогенных клеток). Могут быть использованы клетки различного происхождения, в том числе первичные (рис. 2) и стволовые клетки (рис. 3).
![]()
Рисунок 2. Первичная клетка человека.
библиотека Федерации Киокушинкай г. Южноуральска
![]()
Рисунок 3. Стволовая клетка человека.
Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора (ex vivo) хирургическим путем. Если первичные клетки взяты у определенного организма-донора, и впоследствии необходимо имплантировать эти клетки ему же в качестве реципиента, то вероятность отторжения имплантированной ткани исключается, поскольку присутствует максимально возможная иммунологическая совместимость первичных клеток и реципиента. Однако первичные клетки, как правило, не способны делиться — их потенциал к размножению и росту низок. При культивировании таких клеток in vitro (посредством тканевой инженерии) для некоторых типов клеток возможна дедифференцировка, то есть потеря специфических, индивидуальных свойств. Так, например, хондроциты, вводимые в культуру вне организма, часто продуцируют фиброзный, а не прозрачный хрящ.
Поскольку первичные клетки не способны делиться и могут потерять свои специфичные свойства, возникла необходимость альтернативных источников клеток для развития технологий клеточной инженерии. Таковой альтернативой стали стволовые клетки.
![]()
Рисунок 4. Биокерамические изделия из ортофосфатов кальция.
Для направления организации, поддержания роста и дифференцировки клеток в процессе реконструкции поврежденной ткани необходим специальный носитель клеток — матрикс, представляющий из себя трехмерную сеть, похожую на губку или пемзу (рис. 4). Для их создания применяют биологически инертные синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген) и биокомпозиты. Так, например, эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани в остеобласты, которые затем наносят на различные материалы, поддерживающие их деление (например, донорскую кость, коллагеновые матрицы и др.).
На сегодняшний день одна из стратегий тканевой инженерии такова:
- Отбор и культивирование собственных или донорских стволовых клеток.
- Разработка специального носителя для клеток (матрицы) на основе биосовместимых материалов.
- Нанесение культуры клеток на матрицу и размножение клеток в биореакторе со специальными условиями культивирования.
- Непосредственное внедрение тканеинженерной конструкции в область пораженного органа или предварительное размещение в области, хорошо снабжаемой кровью, для дозревания и формирования микроциркуляции внутри конструкции (префабрикация).
Кровеносные сосуды из принтера
![]()
Однако прежде чем действительно можно будет имплантировать выращенные в лаборатории органы с собственными кровеносными сосудами, пройдет еще какое-то время.
Давай, Россия, давай вперед!
![]()
Рисунок 6. Лауреат премии Президента РФ Екатерина Игоревна Шишацкая.
Первый опыт трансплантации тканеинженерной конструкции в клинике
![]()
Осенью 2008 года руководитель клиники Университета Барселоны (Испания) и Медицинской школы Ганновера (Германия) профессор Паоло Маккиарини (Paolo Macchiarini; рис. 7) провел первую успешную операцию по трансплантации биоинженерного эквивалента трахеи пациентке со стенозом главного левого бронха на протяжении 3 см (рис. 8) [11].
В качестве матрикса будущего трансплантата был взят сегмент трупной трахеи длиной 7 см. Чтобы получить природную матрицу, по свойствам превосходящую все то, что можно сделать из полимерных трубок, трахею очистили от окружающей соединительной ткани, клеток донора и антигенов гистосовместимости. Очищение заключалось в 25 циклах девитализации с применением 4%-деоксихолата натрия и дезоксирибонуклеазы I (процесс занял 6 недель). После каждого цикла девитализации проводили гистологическое исследование ткани для выявления количества оставшихся ядросодержащих клеток, а также иммуногистохимическое исследование на наличие в ткани антигенов гистосовместимости HLA-ABC, HLA-DR, HLA-DP и HLA-DQ. Благодаря биореактору собственной разработки (рис. 9) ученые на поверхность медленно вращающегося отрезка трахеи равномерно нанесли шприцем суспензию клеток. Затем трансплантат, наполовину погруженный в среду для культивирования, вращался вокруг своей оси с целью попеременного контакта клеток со средой и воздухом.
![]()
Рисунок 8. Операция по пересадке пациентке трахеи.
![]()
Рисунок 9. Биореактор для создания тканеинженерного эквивалента трахеи. А — схема биореактора, вид с боку. Б — герметизация биореактора. В — биореактор с тканеинженерным эквивалентом трахеи in situ. Г — биореактор после удаления эквивалента трахеи. Д — вид эквивалента трахеи непосредственно перед операцией.
Эквивалент трахеи находился в биореакторе 96 часов; затем его трансплантировали пациентке. При операции был полностью удален главный левый бронх и участок трахеи, к которому он примыкал. В образовавшийся промежуток вшили трансплантат, а некоторое несоответствие диаметров просветов тканеинженерного эквивалента и бронха реципиента было преодолено благодаря эластичности донорской ткани.
По истечении десяти суток после операции пациентка была выписана из клиники без признаков дыхательной недостаточности и иммунной реакции отторжения трансплантата. По данным компьютерной томографии, с помощью которых была сделана виртуальная 3D реконструкция дыхательных путей, тканеинженерный эквивалент был практически неотличим от собственных бронхов пациентки (рис. 10).
![]()
Рисунок 10. Виртуальная 3D-реконструкция дыхательных путей по данным компьютерной томографии и бронхоскопии перед операцией (А, Б) и через 1 месяц и после замены стенозного участка левого главного бронха тканеинженерным эквивалентом (В, Г). Стрелкой указан стеноз.
Читайте также: