Сообщение по теме биологическое значение и применение неметаллов
Обновлено: 18.05.2024
На грани химии, биологии и медицины возникла новая научная область бионеорганическая химия. Бионеорганическая химия рассматривает роль металлов в возникновении и развитие различных процессов в здоровом и больном организме, создает новые эффективные препараты на основе металлорганических соединений, активно участвует в борьбе за сохранение здоровья людей и продление человеческой жизни. Особенно чутко организм реагирует на изменение концентрации микроэлементов, т.е. элементов, участвующих в организме в количестве меньше одного грамма на 70 килограмм массы человеческого тела. К таким элементам относятся медь, цинк, марганец, кобальт, железо, никель, молибден и другие.
Файлы: 1 файл
МЕТАЛЛЫ И НЕМЕТАЛЛЫ В ЖИЗНИ ЧЕЛОВЕКА.doc
МЕТАЛЛЫ И НЕМЕТАЛЛЫ В ЖИЗНИ ЧЕЛОВЕКА
На грани химии, биологии и медицины возникла новая научная область бионеорганическая химия. Бионеорганическая химия рассматривает роль металлов в возникновении и развитие различных процессов в здоровом и больном организме, создает новые эффективные препараты на основе металлорганических соединений, активно участвует в борьбе за сохранение здоровья людей и продление человеческой жизни. Особенно чутко организм реагирует на изменение концентрации микроэлементов, т.е. элементов, участвующих в организме в количестве меньше одного грамма на 70 килограмм массы человеческого тела. К таким элементам относятся медь, цинк, марганец, кобальт, железо, никель, молибден и другие.
Вода – универсальный растворитель. Она носит в себе следы всего, с чем соприкасается. Известно около 70 000 веществ, которые встречаются в воде в качестве примесей. Некоторые из этих примесей оказывают вредное влияние на человеческий организм, превышения их предельно допустимой концентрации (ПДК) нужно всячески избегать.
В старых зданиях иногда встречаются свинцовые водопроводные трубы. Некоторые американские токсикологи считают, что свинцовый водопровод Римской империи послужил причиной ее падения. Свинцовый водопровод был в Московском Кремле во времена правления Ивана Грозного. Вода, текущая из таких труб, становится опасной для жизни, поскольку свинец – токсичный металл. Он откладывается в костях скелета и влияет на центральную и периферическую нервную систему. Это особенно опасно для детей младше 6 лет, включая период внутриутробного развития. Есть данные о том, что свинец способствует развитию новообразований в почках. Помимо этого, свинец угнетает иммунитет. Использование этилированного бензина в качестве топлива приводит к загрязнению окружающей среды свинцом.
Ртуть – уникальный металл. Это единственный металл-жидкость, который может испаряться. Существуют микроорганизмы, способные включать ртуть в органические соединения. В природе ртуть бывает в самородном, жидком виде, а также входит в состав минералов. Некоторая часть ртути свободно испаряется из трещин в земной коре. Около половины всей используемой ртути приходится на батарейки, люминесцентные лампы, выключатели и измерительные приборы.
Ртуть и ее соединения нарушают белковый обмен, поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании – дыхательные пути. Особенно опасны выбросы в воду с образованием метилртути – соединения более опасного, чем сама ртуть. Оно способно накапливаться в организме и вызывать болезнь Минамата. Болезнь так названа по названию озера Минамата в Японии, куда промышленная компания долгое время сливала ртуть. Болезнь была обнаружена в 1956 году. Ее симптомы – нарушение моторики, парестезия в конечностях, ослабление зрения и слуха. В тяжелых случаях – паралич.
В норме кадмий в небольших количествах присутствует в здоровом человеческом организме. Однако он токсичен, и потому его избыток легко становится губительным. Кадмий обладает способностью накапливаться, хроническое отравление приводит к анемии и болезни костей. Растворимые соединения кадмия поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Кадмий изменяет на многие гормоны и ферменты, необходимые для нормальной работы организма. Источником кадмиевого загрязнения являются выбросы цветной и черной металлургии, ТЭЦ и угледобычи.
В природе цинк существует только в составе полиметаллических руд. В древней Греции был известен сплав цинка с медью – латунь. Цинк – необходимый для нормальной жизнедеятельности элемент. Однако его переизбыток вызывает поражение почек. Есть экспериментальные данные о его токсическом воздействии на кровь и сердце.
Никель участвует в регуляции обмена ДНК и является необходимым для человека микроэлементом. Недостаток его ведет к нарушению обмена веществ и снижению иммунитета. Но избыток никеля может быть вреден для здоровья. При повышении концентрации никеля в организме могут появиться аллергические реакции в виде кожной сыпи или аллергического насморка. В Германии 15% людей имеет аллергию на никель. При избытке никеля также возможна анемия, повышенная возбудимость. Поскольку никель влияет на ДНК, а также РНК, при хронической интоксикации появляется риск развития новообразований в легких, в почках, на коже. Никель могут выделять в воду электрические чайники с открытым нагревательным элементом.
Хром — это металл. Он твердый и ломкий и очень устойчив к коррозии. Он серебристо-белый, а после полировки приобретает блеск. Он плохо проводит электричество и тепло.
Ученые Национальных институтов здравоохранения США получили данные о том, что содержащийся в питьевой воде хром может вызвать рак. Были проведены лабораторные опыты над животными. Выяснилось, что, хром, который содержится в питьевой воде, может вызвать рак. Такие данные были получены в ходе лабораторных наблюдений за животными, получавшими воду с высоким содержанием хрома. У крыс появлялись злокачественные опухоли полости рта, у мышей – рак тонкой кишки. Ученые считают, что хром 6 (шестивалентный) может вызвать у людей рак легких.
Железо – важный микроэлемент, участвующий в кроветворении и внутриклеточном обмене. Железо почти всегда встречается в природной воде, как на поверхности, так и во взятой из скважины. Больше всего железа в болотных водах. В систему водоснабжения железо попадает из-за коррозии труб. Норма содержания железа в воде – не больше 0,3 мг/л. Высокое содержание железа в воде неблагоприятно для кожи. Избыток железа может изменять состав крови, вызывать аллергические реакции, железо накапливается в поджелудочной железе, почках, миокарде, иногда в щитовидной железе, мышцах и эпителии языка.
Медь – это пластичный металл с невысокой плотностью. Обладает высокой теплопроводностью.
Медь необходима для высших растений, для животных и для человека, поэтому недостаток меди нежелателен, однако в питьевой воде не должно содержаться больше меди, чем 1-1,5 мг/л. Повышение концентрации меди в питьевой воде вызывает поражение слизистых оболочек почек и печени.
Молибден входит в состав человеческого организма. Но избыток его в питьевой воде может стать причиной ослабления иммунитета, изменений функций костного мозга, тимуса и селезенки. А при наличии сопутствующего недостатка в организме кальция избыток молибдена ведет к подагре (ревматическое заболевание суставов, связанное с отложением солей, может сопровождаться опуханием и деформацией суставов).
Марганец хорошо знаком нам всем в виде марганцовки, как называют в быту перманганат калия, обладающей антисептическими свойствами. Марганец – необходимый микроэлемент, участвует в образовании костей, в кроветворении и тканевом дыхании, в жировом и углеводном обмене, поддерживает репродуктивные функции. При недостатке марганца наблюдается рвота, изменение цвета волос, замедляется сращивание костей при переломах.
Допустимое содержание марганца в водопроводной питьевой воде – 0,1 мг/л. Это больше, чем в Европе, но в пять раз меньше, чем в Америке. При повышении содержания марганца возможно развитие анемии, нарушение функционального состояния центральной нервной системы.
Но избыток фтора тоже опасен. Если в воде его слишком много (более 1,0 мг/л), это приводит к флюорозу. Флюороз проявляется в виде крапинок или пятен на зубной эмали, изменяется костная ткань (остеосклероз), кости деформируются, связочный аппарат обызвествляется. Это происходит из-за того, что при избытке фтора, поступающего в организм, соли фтора начинают откладываться в костях и зубах и замещают растворимые соединения кальция нерастворимыми соединениями кальция и фтора. Особенно опасен избыток фтора для детей, у которых коренные зубы еще находятся в стадии формирования. При небольшом превышении нормы фтора поражаются только резцы, при большом – все зубы. Поражение костей происходит при сильном переизбытке фтора – свыше 6 мг/л. Хорошая же новость заключается в том, что если уменьшить поступление фтора в организм, симптомы флюороза уменьшаются.
Если ртуть – единственный жидкий металл, то бром – единственный жидкий неметалл. В простом виде это – ядовитая красно-бурая жидкость с неприятным запахом. Бром широко распространен в природе в виде соединений. В организме человека бром содержится в количестве примерно 0,2 г. Он обнаруживается в жидкостях организма: крови, слюне и моче, а также в печени и в мозге.
Препараты брома оказывают снотворное и успокаивающее действие.
Избыточное содержание микроэлемента бром в организме может привести к кожному заболеванию – бромодерме (высыпания на коже в виде бляшек или пузырей), а также нарушить работу нервной системы. Недостаток брома способствует возникновению бессонницы, к снижению уровня роста эритроцитов в крови.
Источником поступления бромидов могут быть грунтовые или подземные воды либо сточные воды предприятий химической промышленности.
Йод – необходимый микроэлемент, он присутствует во всех живых организмах. У животных и человека йод входит в состав вырабатываемых щитовидной железой гормонов, которые регулируют развитие организма и обмен веществ. Дефицит йода опасен, в результате могут развиться такие заболевания, как эндемический зоб, кретинизм и гипотиреоз. В организме человека содержится 12-20 мг йода, суточная потребность в йоде составляет около 0,2 мг.
Йод токсичен. Смертельная доза – 2-3 г. Избыток йода вызывает поражение почек и сердечнососудистой системы, появляется общая слабость, головная боль, рвота, понос, бурый налет на языке, боли в сердце и учащение пульса.
Ветер со стороны моря и испарения приносят в атмосферу некоторое количество йода, которое затем захватывается дождем и вместе с ним попадает в поверхностные воды. Также йод выщелачивается природными водами из магматических пород. Третий источник йода – воды нефтяных месторождений и сточные воды химической и фармацевтической промышленности.
В природные воды бор поступает из подземных вод, обогащенных бором за счет содержащих бор осадочно-метаморфических пород (борацит, бура, колеманит и др.). Также насыщены бором сточные воды некоторых производств (например, кожевенного, керамического) и бытовые сточные воды со стиральными порошками. Бор содержится в некоторых удобрениях и может попадать в воду из почв.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

Биологическая роль неметаллов

введение Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов. Химический элемент – вид атомов с одинаковым положительным зарядом ядра. Заряд ядра равен порядковому номеру элемента в системе таблицы Менделеева. В настоящее время достоверно известно 116 элементов, 90 из которых существуют в природе, а остальные получены с помощью искусственных ядерных реакций.

Место Неметаллов В Периодической Системе Д.И. Менделеева Все элементы условно делятся на металлы и неметаллы. К неметаллам относятся 22 элемента. В периодической системе Менделеева неметаллы расположены по диагонали B- At и над ней в главных подгруппах.


неметаллы Свойства простых веществ, образуемых неметаллами, отличаются большим разнообразием, имеют большое биологическое значение.

Водород Это простое вещество, самый легкий газ без цвета, вкуса и запаха, в смеси с воздухом – взрывоопасен. Водород открыт в 1766 году английским ученым Г. Кавендишем . Молекула водорода состоит из 2 атомов и образована ковалентной неполярной связью. +Н водород

водород В космосе водород является самым распространенным элементом – из 10 атомов Вселенной на долю водорода приходится 8. Солнце более, чем наполовину состоит из водорода. На Солнце из атомов водорода образуются атомы гелия. Процесс сопровождается выделением огромного количества энергии, за счет которой существует жизнь на нашей планете. На земле водород содержится в виде соединений. Самым важным является вода, образующая гидросферу. Водород образует органические вещества и жизненно важные белки,жиры и углеводы

кислород Самый распространенный элемент нашей планеты, газ без цвета и запаха, мало растворим в воде, тяжелее воздуха, поддерживает горение. Он входит в состав воды (88,9%) , образует гидросферу. Кислород участвует в процессах дыхания, медленно окисляет углеводы, жиры, белки, является источником энергии для живых организмов. Кислород доставляется гемоглобином во все ткани и клетки живого организма. +8 2 6 О2 2е,6е кислород

кислород В свободном состоянии кислород существует в виде двух аллотропных видоизменений : кислород и озон. Озон существует в верхних слоях атмосферы и образует озоновый слой Земли, который защищает планету и ее обитателей от ультрафиолетового излучения.

азот Азот –простое вещество. В природе азот содержится в атмосфере и составляет примерно 78%. Азот – жизненно важный элемент. Все основные части клеток тканей организмов построены из белковых молекул, в состав которых входит азот. Без белка нет жизни, а без азота нет белка. Человек получает белки из растительной и белковой пищи. Животные получают готовые белковые вещества.


кремний В природе кремний – второй по распространенности после кислорода химический элемент. Самым распространенным соединением кремния является оксид кремния –SiO2 (кремнезём). Оксид кремния необходим для жизни растений и животных. Тростники, камыши стоят крепко, а стебли зерновых настолько крепки, что выдерживают и дождь, и ветер. Чешуя рыб, панцири насекомых , крылья бабочек, перья птиц, шерсть животных прочны, так как содержат кремнезем. Кремний придает гладкость и прочность костям человека. Природные соединения кремния – силикаты, в чистом виде являются драгоценными камнями, например: аквамарин, топаз, изумруд и другие. +14 22 8 4 кремний 2 Si

углерод Углерод – простое вещество, занимает 11 место по распространенности на Земле. В природе имеется как в свободном состоянии, так и в виде соединений. Углерод существует в трех аллотропных соединениях, отличающихся по строению кристаллической решетки : алмаз, графит и уголь. Углерод входит в состав многих веществ – мела, известняка, мрамора, доломита и других. Соединения углерода – основной компонент нефти и природного газа. Углерод входит в состав белков, нуклеиновых кислот, углеводов – веществ, без которых невозможна жизнь. 4 +6 2 С Углерод 2

углерод Он –основа многообразия органических соединений, из которых построены все живые организмы на нашей планете. Углерод – биогенный элемент, его соединения играют особую роль в жизнедеятельности растительных и живых организмов.

фосфор Фосфор является составной частью тканей организма человека, животных и растений. В организме человека большая часть фосфора связана с кальцием. Фосфор содержится в костях, в нервной и мозговой тканях, в крови и молоке. В растениях и животных фосфор входит в состав белков. Фосфорные соединения аккумулируют энергию, регулируют жизнеобеспечение организма. Фосфор активизирует умственную и физическую деятельность человека. Из фосфора, поступающего в организм человека с пищей ( с яйцами и хлебом), строится АТФ –аденозинтрифосфорная кислота. 15 2 8 5 Р 2е,8е,5е ФОСФОР 2

ФОСФОР АТФ служит собирателем и носителем энергии и нуклеиновой кислоты ДНК и РНК. Они осуществляют передачу наследственности организма. АТФ расходуется в печени, мышцах, мозгу. Фосфор – это элемент жизни и мысли. Много фосфора не только в животных продуктах, но и в овощах : моркови, свёкле, редисе, луке, огурцах, цветной капусте, картофеле и других. Организм всасывает от 50 до 90 % содержащегося в пище фосфора.


Фтор Фтор входит в состав тканей живых организмов, костей и зубной эмали. Фтор входит в состав зубных паст, не в свободном виде, а в виде его соединений. Благодаря этому важному компоненту, который участвует в построении зубной эмали и костей, предотвращается такое заболевание, как кариес зубов. Фтор является необходимым элементом при обмене веществ в железах, мышцах и нервных клетках. +9 2 7 F2e,7e Фтор

Хлор Хлор- один из химических элементов, без которых невозможно существование живых организмов. Хлор участвует в образовании желудочного сока. Основная форма поступления хлора в организм – хлорид натрия. Хлор участвует в формировании плазмы крови, стимулирует обмен веществ, рост волос, придает бодрость и силу. Вместе с тем хлор содержится в очень опасном для жизни и здоровья веществе – диоксине. Соединения хлора – одна из причин разрушения озонового слоя Земли. +17 2 8 7 Cl2e,8e,7e ХЛОР

Йод Йод –это тот элемент, без которого человек не может жить. Йод участвует в образовании гомона щитовидной железы тироксина. Недостаток его в воде и пище снижает выработку гормона щитовидной железы и приводит к заболеванию эндемическим зобом. Недостаток йода приводит к нарушению роста человека и умственного развития, вплоть до кретинизма. Гормон щитовидной железы регулирует мускульное возбуждение, биение сердца, аппетит, пищеварение, работу мозга. Йод поступает в организм вместе с пищей: хлебом, молоком, водой, морской капустой и другими морскими продуктами. Йод в виде спиртового раствора (5-10%) является сильным антисептиком. +53 2 8 15 25 I I 2e,8e,18e,25e Йод

сера Сера- жизненно важный химический элемент. Она входит в состав белков в виде серосодержащих аминокислот всех живых организмов. Достаточная концентрация веры обеспечивает нормальное течение синтеза инсулина. Инсулин регулирует углеводный обмен, функцию и структуру соединительной ткани. Сера участвует в окислительно – восстановительных процессах организма. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос. Сера поступает в организм с животными и растительными продуктами. Серой богаты бобовые растения ( горох, чечевица), овсяные хлопья, лук, редис, морковь, чеснок, миндаль, капуста и другие. +16 2 8 6 S 2e,8e,6e S Сера

вывод Неметаллы имеют большое биологическое значение. Неметаллы являются составными частями Вселенной, жизненно необходимы для всего живого на Земле. Неметаллы принимают активное участие в процессах жизнедеятельности живых организмов. Без неметаллов невозможно существование жизни на Земле в том виде, в каком она существует в настоящее время.
Краткое описание документа:
Неметаллы имеют большое биологическое значение. Неметаллы являются составными частями Вселенной, жизненно необходимы для всего живого на Земле.
Без неметаллов невозможно существование жизни на Земле в том виде, в каком она существует в настоящее время.

В презентации приведены несколько примеров неметаллов (чаще всего встречающихся и очень важных), она рассказывает об их особенностях, их роли в организме, о их свойствах.
Описание разработки
Основной формой хлора, находящегося в организме, является поваренная соль, поступающая с пищей. Анионы хлора играют важную биологическую роль. Они активируют ферменты, создают среду для действия протеолитических ферментов желудочного сока, обеспечивают ионные протоки через клеточные мембраны, участвуют в поддержании давления.
Фосфор играет очень важную роль в обмене веществ в организме. Он входит в состав скелета животных, в состав зубов, также в состав белков, нуклеиновых кислот, нуклеотидов и др.
Он является необходимым элементом АТФ. Гидролиз АТФ сообщает организму необходимую для жизни энергию. Фосфор относится к структурным (тканеобразующим) макроэлементам, его содержание в организме взрослого человека составляет около 700 г. остатки фосфорной кислоты входят в состав буферной системы крови, регулируя ее значение рН
Фосфолипиды являются основным компонентом мембран всех клеток в организме человека.
Содержимое разработки

Биологическая роль неметаллов для жизнедеятельности живых организмов
Продукты, содержащие фосфор
Пищевые источники калия

-75%
Со времени создания периодической таблицы принято разделять химические элементы на металлы и неметаллы. Хотя эта сравнительная градация условна, существуют элементы, в определенных условиях дающие нетипичные реакции — алюминий может вступать в реакцию со щелочью, а германий проводит электрический ток. Неметаллы — это элементы, образующие в свободном состоянии простые вещества без свойств и внешних признаков металлов. Они не имеют общих физических свойств, кроме низкой тепло- и электропроводности.

Характеристики и физические свойства
Хотя химических элементов-неметаллов всего 16, они являются настоящими кирпичиками жизни, из них состоят все органические соединения. Ученые выяснили, что земная кора на 76% состоит из кремния и кислорода, а водород является самым распространенным веществом во Вселенной, из него состоят все объекты космоса, а также наше светило.
В растительном и животном мирах неметаллы составляют больше 96% от общей массы и 96,7% от массы человека. Это органогенные элементы, формирующие молекулы белков, жиров, углеводов и нуклеиновых кислот. Безусловно, без этих простых веществ привычное существование было бы невозможным.
Основная масса металлов, кроме золота и меди, не обладает цветом, только металлическим блеском. Неметаллы ярко и разнообразно окрашены:
- Фосфор может быть белым, черным или красным;
- Йод всегда фиолетовый с рыжеватым оттенком;
- Бром отличается кирпично-красным насыщенным цветом;
- Фтор в спокойном состоянии оранжевый или желтый;
- Водород, доведенный до жидкого состояния, становится голубым.
Значительное влияние на физические свойства неметаллов оказывают их молекулярное строение и вид кристаллической решетки. Кремний, как и алмаз с атомным кристаллическим строением решетки, обладает большой прочностью и высокой температурой плавления и кипения. Соединения с молекулярной решеткой (йод, сера и фосфор) начинают плавиться и кипеть при довольно низких температурах.

Простые вещества-неметаллы можно разделить на три вида агрегатных состояний: газы, жидкости и твердые вещества. Однако эта классификация будет верной только при стандартных параметрах окружающей среды, при крайне низких или высоких температурах состояние веществ может меняться.
Самую большую группу составляют газообразные неметаллы: кислород, азот, водород, белый фосфор, озон. Они обладают высокой сжимаемостью и расширяемостью, легко смешиваются между собой и заполняют весь объем сосуда. Кислород является сильным окислителем, необходимым для развития жизни на планете, а легко воспламеняющийся белый фосфор быстро образует активные токсичные соединения, поэтому смертельно опасен.
К жидким неметаллам можно отнести только бром — тяжелую темно-бурую вязкую жидкость, обладающую резким и неприятным запахом. Несмотря на то что в природе бром является смертельным ядом, даже его пары вызывают сильное раздражение слизистой и кожных покровов, он присутствует в организме человека, предохраняя от гормональных сбоев.
К твердым веществам относят бор, красный и черный фосфор, мышьяк, кремний, серу, йод и все стабильные аллотропные модификации углерода. В обычном состоянии они являются веществами с прочной атомной кристаллической решеткой, обладают высокой твердостью, но при этом хрупкие, легко слоятся и ломаются.
Интересным примером разных свойств одного и того же неметалла станет сравнение двух разновидностей углерода — алмаза и графита. Утверждение о твердости алмаза имеет научное обоснование — расположение атомов в кристаллической решетке этих веществ настолько различно, что алмаз разрушить практически невозможно, а графит легко ломается и крошится.
Место в периодической системе
В системе химических элементов неметаллы не выделены в отдельную группу. Определить, является ли простое вещество неметаллом, можно, проведя воображаемую диагональную линию от Бора к Астату. В правом верхнем углу останутся неметаллы и инертные газы, а слева внизу -вещества со свойствами металла, а также отдельные подгруппы — лантаноиды и актиноиды. По своим физическим свойствам инертные газы близки к неметаллам, поэтому их часто рассматривают вместе.
Элементы, расположенные возле воображаемой диагонали, обладают двойственным характером и считаются полуметаллами (металлоидами). Список неметаллов в таблице Менделеева зависит от их положения в системе и количества электронов на внешнем слое:
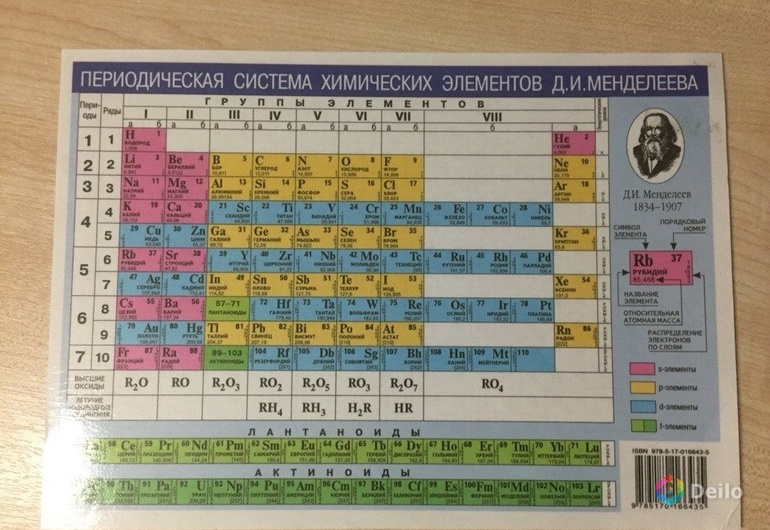
- Бор (B) имеет всего 3 электрона.
- Углерод © и кремний (Si) по 4.
- На внешнем слое азота (N), фосфора (P) и мышьяка (As) находятся 5 электронов.
- Кислород (O), сера (S), скандий (Se), теллур (Te) — 6 электронов.
- Фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At) обладают почти завершенным внешним слоем из 7 электронов.
Отдельно находятся водород и гелий, расположенные в левом и правом верхнем углу таблицы. Это объясняется уникальностью атома водорода, имеющего всего 1 электрон на внешнем слое. Причем водород может одинаково хорошо проявлять свойства как восстановителя, отдавая его, так и окислителя, принимая дополнительный электрон.
Химические особенности
Для большинства элементов этой группы характерна способность вступать в быстрые окислительно-восстановительные реакции, это обеспечивают особенности строения атомов неметаллов. Их атомы содержат большое количество электронов (4−8) на внешнем электронном уровне и способны принимать дополнительные для его устойчивой конфигурации. Благодаря этому образуются отрицательно заряженные ионы, увеличивающие заряд ядра, атом сжимается, а его радиус уменьшается.
Эти процессы ослабляют восстановительные свойства неметаллов, а окислительная способность и электроотрицательность увеличиваются. Некоторые, например, бром, являются окислителем для большинства металлов, но при этом выступают восстановителем для более сильных неметаллов.
Проявляемые химические свойства неметаллов, их активность, возможные степени окисления и характер получаемых соединений могут варьироваться в зависимости от их места в периодической системе и текущего агрегатного состояния.
Взаимодействие с другими веществами
Каждый неметалл обладает специфическими свойствами, характерными только для него, которые подробно рассматриваются при изучении неорганической химии. Общими свойствами является способность реагировать с металлами, водородом и кислородом.
При взаимодействии с металлами большинство неметаллов выступают окислителями и в образующихся бинарных соединениях проявляют отрицательную степень окисления:

- При реакции активных металлов с водородом образуются твердые нелетучие гидриды. Такие неметаллы как кремний, фосфор и бор вообще неспособны на соединения с водородом.
- Реакции металлов и неметаллов с хлором образуют хлориды. Многие металлы (например, железо) при реакции с хлором начинают гореть, образуя соединения, относящиеся к классу солей. При этом хлорид неметалла никогда не будет солью.
- Взаимодействие с кислородом дает оксиды, которые разделяют на пероксиды и надпероксиды.
- Связь с серой образует сульфиды. При этом для получения формулы сульфида алюминия (Al2S3) вещества нужно нагреть, а для сульфида натрия (Na2S) достаточно простого механического перемешивания.
- Для неметаллов нехарактерно взаимодействие с водой и кислотами.
Неметаллы могут вступать в реакции между собой, при этом более электроотрицательный элемент будет играть роль окислителя, а менее отрицательный станет восстановителем.
Получение и применение
Некоторые элементы встречаются в природе в свободном виде, поэтому их можно выделить из смесей или очистить физическим методом. Фтор, хлор, бром и йод встречаются только в виде соединений, поэтому нужные вещества получают методом химических реакций:
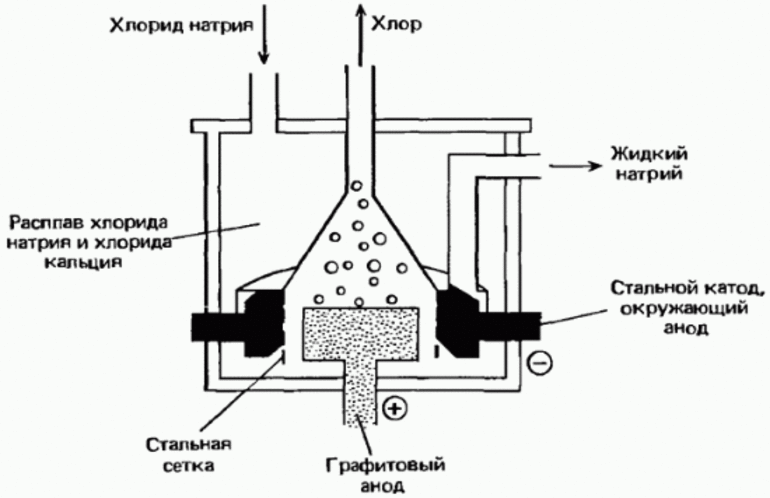
- Хлор получают методом электролиза хлорида натрия;
- Кремний — методом прокаливания в промышленных печах смеси песка с коксом;
- Фосфор восстанавливают из фосфата кальция, добывая его из апатита и фосфорита;
- Селен и теллур являются остаточными продуктами производства серной кислоты;
- Труднее всего производить мышьяк, для этого применяется сложная цепь химических реакций кислорода и углерода с мышьяковистым колчеданом;
- Для получения азота, кислорода и инертного газа аргона используют дистилляцию жидкого воздуха, который предварительно подвергают воздействию повышенного давления и низких температур.
В земных условиях водород встречается только в связанном состоянии в виде водородных соединений, поэтому для его выделения используют различные химические методы, в основном паровую конверсию метана или природного газа.
Учитывая разнообразные свойства неметаллов, они находят применение в большинстве отраслей нашей жизни: медицине, пиротехнике, сельском хозяйстве, пищевой промышленности и для подготовки высоких температур. Для дезинфекции воды используют хлор и озон, медицина невозможна без йода и активированного угля (углерод), жидкий азот применяют в косметологии, а сера помогает бороться с болезнями растений.
Читайте также:

